Les zoonoses correspondent aux infections transmises à l’homme à partir d’une source animale. Les micro-organismes en cause sont capables d’adaptation pour infecter ou survivre dans les divers hôtes rencontrés. Certaines zoonoses peuvent occasionner des maladies émergentes, car cette adaptation à plusieurs hôtes contribue à favoriser les mutations, modifiant ainsi la virulence pour l’être humain.1
En 2001, sur les 1 415 organismes considérés comme pathogènes pour l’homme, 61 % étaient d’origine zoonotique ; parmi les 175 espèces considérées comme « émergentes », 75 % étaient d’origine zoonotiques.2 De même, une analyse réalisée en 2008 sur l’ensemble des infections émergentes montre que 60,3 % d’entre elles sont des zoonoses.3
Par conséquent, les zoonoses représentent un potentiel danger pour la santé humaine. Il est important de tenir compte de la notion d’« Une seule santé » (One Heath), qui positionne la santé humaine au sein de l’ensemble des risques environnementaux. Les déterminants pouvant influencer l’épidémiologie des zoonoses sont de ce fait multiples :4
- modifications des micro-organismes (surtout pour les virus, par mutations géniques) ;
- modifications environnementales (changement climatique et impact sur certains vecteurs) ;
- modifications survenant chez les populations animales hôtes (que ce soit pour l’élevage, avec les risques sanitaires alimentaires, ou dans la faune sauvage avec l’évolution des relations homme-animal, comme la multiplication des trafics illégaux d’animaux) ;
- modifications du comportement humain ; des phénomènes socioéconomiques, comme les mouvements de population et les changements de notre relation avec l’environnement, dont l’évolution des paysages (déforestation, urbanisation…) et l’évolution de la biodiversité, ont un impact sur le risque de contage à partir d’une source animale.
Un certain nombre de zoonoses font l’objet en France d’un suivi épidémiologique réalisé par Santé publique France.5
Une démarche diagnostique complexe
Pour le médecin de premier recours, le diagnostic des zoonoses est un défi, en raison de leur rareté, de leur diversité clinique et de leur variabilité d’expression, mais aussi du fait de la difficulté de la mise en évidence de l’agent causal. L’exposition à un risque zoonotique spécifique est à rechercher car elle permet d’orienter la démarche diagnostique. Cette dernière repose avant tout sur les points d’appel cliniques (types de symptômes, évolutivité de l’infection) qui ne sont pas toujours spécifiques. Par ailleurs, les examens complémentaires biologiques peuvent apporter de précieux renseignements, utiles à l’orientation diagnostique.
Parmi les éléments les plus importants à relever, le médecin peut facilement identifier les manifestations inflammatoires (fièvre, syndrome inflammatoire), qui sont souvent au premier plan.
Procéder à un interrogatoire minutieux
L’existence d’un voyage en zone tropicale doit être recherchée car il peut être à l’origine de zoonoses, mais les infections strictement tropicales ne sont pas directement abordées dans cet article. Certaines expositions sont particulièrement importantes à identifier, en particulier en cas d’effraction cutanée provoquée par un animal. Une morsure animale avec une inflammation rapide de la plaie doit faire évoquer une pasteurellose ; la manipulation d’un gibier sans précaution de contact, une tularémie ; le contact avec des rats ou de l’eau douce, une leptospirose.
L’existence d’une piqûre de tique est un événement moins fréquent qu’une piqûre de moustique mais aussi plus difficile à identifier : la piqûre de moustique est facile à reconnaître en raison du prurit qu’elle génère, celle de la tique est indolore et passe en général totalement inaperçue. Il est important de noter que l’absence de notion de piqûre de tique ne permet en aucun cas d’écarter le risque de transmission d’une maladie vectorielle à tiques. Dans d’autres situations, une simple exposition n’a qu’une valeur d’orientation diagnostique bien plus faible.
Signes cliniques
L’existence d’un point d’appel clinique, avec ou sans fièvre, peut faciliter la démarche diagnostique (tableau, fig. 1) :
- une adénopathie oriente vers une tularémie ou une bartonellose ;
- des signes neuroméningés peuvent révéler une méningoencéphalite à tiques, une infection liée au virus West Nile ou une autre arbovirose ;
- des signes cutanés évoquent une tularémie, une leishmaniose, une poxvirose ou une mycobactériose ;
- des signes respiratoires doivent faire penser à une coxiellose (fièvre Q) ou à une chlamydiose (psittacose).
Les manifestations cliniques peuvent se développer de façon plus ou moins rapide après le contage, ce qui peut constituer un argument d’orientation diagnostique à prendre en compte : si la plupart des zoonoses ont des incubations courtes, certaines se développent de façon subaiguë (bartonellose, brucellose…) et d’autres peuvent évoluer sur le long terme (borréliose de Lyme, forme chronique de la fièvre Q, échinococcoses…).
Place des examens complémentaires
L’approche clinique seule peut ainsi s’avérer insuffisante pour orienter le diagnostic. Dans ce cas, des éléments biologiques simples peuvent aider : présence d’une cytopénie (anaplasmose), thrombopénie (leptospirose), cytolyse hépatique (anaplasmose, leptospirose), insuffisance rénale (leptospirose, infection liée aux hantavirus).
Parfois, l’imagerie permet de détecter une zoonose, en particulier au cours des échinococcoses, souvent asymptomatiques pendant de nombreuses années, en l’absence de complications.
Principales zoonoses à connaître
Les plus fréquentes des zoonoses sont au nombre de six : pasteurelloses, bartonelloses, tularémie, leptospirose, fièvre Q et borréliose de Lyme.
Pasteurelloses
Les pasteurelloses constituent probablement les zoonoses les plus fréquentes, bien que leur diagnostic soit rarement confirmé. En effet, il s’agit de la principale complication infectieuse faisant suite à une morsure animale. La plupart des mammifères sont porteurs de Pasteurella multocida, son agent causal dans la sphère buccale.
La pasteurellose se manifeste par une réaction inflammatoire initialement localisée à l’endroit de l’effraction cutanée. Sa caractéristique principale est qu’elle apparaît rapidement, dans un délai d’environ vingt-quatre heures. Chez les sujets fragiles, il existe un risque de dissémination systémique de l’infection, avec fièvre et bactériémie. Diverses localisations infectieuses hématogènes sont décrites (arthrites…).
Le diagnostic étiologique est rarement fait en l’absence de dissémination : l’initiation d’une antibiothérapie adaptée, proposée de façon systématique en cas d’effraction cutanée profonde à la suite d’une morsure animale, évite la survenue de complications. La bactérie peut être isolée à partir d’un prélèvement local ou dans les hémocultures en cas de formes disséminées.
Le traitement repose sur des bêtalactamines : l’association amoxicilline et acide clavulanique, traitement de première intention en cas de morsure, est efficace. En cas d’allergie à la pénicilline, la doxycycline est une alternative.
Bartonelloses : l’exemple de la maladie des griffes du chat
Les Bartonella sont des bactéries à l’origine de diverses infections, dont l’expression clinique est variable selon l’espèce en cause. La plus fréquente est la maladie des griffes du chat due à Bartonella henselae. Le réservoir de cette bactérie est le chat, qui peut contaminer l’être humain à l’occasion d’une griffure ou plus rarement d’une morsure. Ce sont surtout les chatons qui en sont porteurs, au niveau de la sphère buccale.6
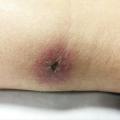
L’infection est assez progressive, avec une incubation de plusieurs semaines. L’endroit de la griffure est rarement l’objet d’une réaction inflammatoire ; seule une petite lésion nodulaire peut parfois témoigner de l’inoculation. Le point d’appel principal est constitué par des adénopathies dans le territoire de drainage de l’effraction cutanée initiale. Ces adénopathies ont en général un caractère inflammatoire et peuvent évoluer vers une fistulisation. L’évolution s’étend sur plusieurs semaines, et les signes généraux comme la fièvre sont plus fréquents chez les enfants. Des localisations à distance du territoire d’inoculation (ostéoarticulaire, hépatique, splénique, endocardite, méningoencéphalite…) sont décrites mais restent très rares.6
Le diagnostic doit être évoqué cliniquement sur l’association d’une adénopathie localisée et d’une notion de contage avec des chats. La bactérie est difficilement mise en évidence car elle ne pousse pas sur les milieux de culture usuels. La sérologie peut être utile, avec toutefois les limites habituelles : délais d’apparition des anticorps et manque de spécificité, surtout en présence de taux faibles. La ponction ganglionnaire reste la technique la plus performante pour affirmer le diagnostic, en mettant en évidence Bartonella henselae par PCR – ce qui nécessite d’avoir préalablement poser l’hypothèse diagnostique, afin d’orienter le laboratoire de microbiologie. Si une biopsie est réalisée, l’analyse histologique peut mettre en évidence une réaction inflammatoire granulomateuse avec nécrose pyogène.6
Le traitement est mal codifié. La doxycycline est souvent proposée, mais son intérêt est peu évalué, et l’évolution clinique est souvent longue (plusieurs semaines), quel que soit le traitement. L’azithromycine est une alternative intéressante et mieux évaluée chez l’enfant ou chez le patient immunodéprimé. La durée du traitement n’est pas consensuelle, mais l’usage fait que l’on privilégie des traitements courts, d’une à deux semaines.6
Tularémie
La tularémie est due à Francisella tularensis. Il s’agit d’une maladie à déclaration obligatoire.
Plusieurs modes de contamination sont connus. L’inoculation à la suite d’une manipulation de certains animaux (principalement les lagomorphes : lièvres et lapins sauvages) est la plus fréquente. Cette infection peut également être transmise par piqûre de tique ou par voie respiratoire (potentiel agent de bioterrorisme). En outre, la bactérie peut se transmettre par voie transcutanée, même en l’absence d’effraction cutanée. De ce fait, la manipulation d’animaux sauvages impose le port de gants. De même, la manipulation au sein d’un laboratoire microbiologique impose des mesures de sécurité importantes : l’hypothèse diagnostique se doit d’être signalée avant d’envoyer le prélèvement au laboratoire pour que celui-ci puisse mettre en place les moyens de protection de son personnel.
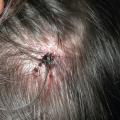
Le diagnostic doit être évoqué devant toute adénopathie inflammatoire, surtout en cas d’exposition par manipulation animale ou à la suite d’une piqûre de tique. Cette adénopathie présente, en général, un caractère inflammatoire et peut apparaitre quelques jours après l’inoculation. À l’endroit de l’inoculation, on retrouve souvent une lésion ulcérée (fig. 3). Elle peut s’accompagner de fièvre. Des formes disséminées ont été décrites : bactériémie et localisation pulmonaire (surtout en cas d’inhalation).
La confirmation du diagnostic peut se faire par la réalisation d’une sérologie avec recherche d’immunoglobulines M (IgM). L’identification directe de la bactérie est possible, surtout par PCR au sein de laboratoires équipés pour manipuler les agents pathogènes de niveau 3.
Le traitement repose sur une antibiothérapie : la doxycycline, les fluoroquinolones et les aminosides sont efficaces. Il est actuellement d’usage de prioriser les fluoroquinolones, qui semblent avoir une efficacité clinique satisfaisante, bien qu’il n’existe pas de validation sur des essais thérapeutiques méthodologiquement robustes.
Leptospirose
La leptospirose est une infection due à Leptospira interrogans, dont L. i. icterohaemorrhagiae est le sérotype le plus connu et souvent considéré comme le plus pathogène. Son expression clinique est peu spécifique (fièvre) mais ses complications peuvent être sévères. Elle est probablement sous-diagnostiquée du fait des difficultés de sa confirmation microbiologique.
Son réservoir est constitué par les rats qui contaminent leur environnement hydrique par leurs déjections contenant la bactérie. La baignade ou le contact avec l’eau douce des lacs et rivières (pratique de sports, d’activités de loisir) est le mode de contamination le plus classique en France.7
La principale manifestation clinique est une fièvre aiguë, sans autre orientation clinique, en dehors d’un syndrome polyalgique assez peu spécifique. La notion d’exposition peut amener à évoquer le diagnostic, ainsi que des anomalies biologiques assez caractéristiques : association d’une insuffisance rénale, de perturbation des tests hépatiques et d’une thrombopénie – sachant qu’aucune de ces anomalies n’est constante. Les complications peuvent mettre en jeu le pronostic vital : méningoencéphalite lymphocytaire, myocardite, sepsis, voire défaillance multiviscérale.7
L’ensemble des manifestations de la leptospirose s’apparente souvent à une autre zoonose : la fièvre hémorragique avec syndrome rénal. Due à des hantavirus, cette dernière doit être systématiquement évoquée parmi les diagnostics différentiels, dans le nord-est de la France métropolitaine (Ardennes, Franche-Comté).7
Le diagnostic repose en priorité sur la mise en évidence de la bactérie dans le sang ou les urines par PCR. La recherche d’IgM peut être une aide précieuse mais tardive (à partir de J6) et peu spécifique.7
Le traitement repose sur l’utilisation des bêtalactamines par voie parentérale (ceftriaxone, céfotaxime). En cas d’allergie, la doxycyline est une alternative.7
Fièvre Q
La fièvre Q est une infection liée à Coxiella burnetii. Cette bactérie est présente chez les animaux d’élevage (bovins, caprins, ovins). La transmission humaine se fait par inhalation et concerne plus volontiers les populations vivant en milieu rural, à proximité de ces élevages.
Cette infection peut se manifester sous forme aiguë par une pneumonie, ou plus rarement sous une forme chronique, dont l’endocardite est l’expression la plus connue. La pneumonie a les caractéristiques d’une forme atypique à début progressif, avec des signes respiratoires plus ou moins discrets et la présence de signes extrarespiratoires. Cette forme s’accompagne souvent d’une hépatite, avec une cytolyse ou une cholestase marquée, qui peut être un point d’appel à identifier.
Le diagnostic repose sur la sérologie (les différents types d’anticorps renseignent sur la phase de l’infection) ou la PCR.
Le traitement repose principalement sur la doxycycline, antibiotique de première intention. Les formes chroniques nécessitent un traitement prolongé, dont la durée peut être guidée par l’évolution sérologique. Un traitement par hydroxychloroquine est classiquement associé à la doxycycline, dans les formes chroniques.
Borréliose de Lyme
Il s’agit de la zoonose la plus fréquente en France : elle est due à Borrelia burgdorferi sl et est exclusivement transmise par piqûre de tique.8 Il s’agit d’une infection très peu inflammatoire (pas ou peu de fièvre) et d’évolution subaiguë, contrairement aux autres maladies vectorielles à tiques.
À la phase précoce, le diagnostic repose uniquement sur la présence d’un érythème migrant. Les signes cliniques sont moins spécifiques lors de la phase disséminée, associant des signes de radiculite et d’arthrite des grosses articulations. Les autres atteintes sont plus rares. À ce stade de l’infection, le diagnostic repose sur la présence de symptômes compatibles avec une sérologie positive avec, de préférence, une confirmation par la réalisation d’une ponction lombaire ou articulaire selon les symptômes.8
Le traitement repose sur la doxycycline en première intention ou une bêtalactamine (amoxicilline ou ceftriaxone selon le stade de la maladie).8
Que dire à vos patients ?
Les animaux sont porteurs de micro-organismes pouvant être une source de contamination pour l’être humain : toute effraction cutanée ou contact direct peut être à l’origine d’une zoonose.
La prévention a une importance toute particulière :
- il est toujours utile de prévenir les piqûres d’arthropodes (moustiques et tiques) ;
- les animaux ne sont pas des jouets ; tout contact direct expose à certains risques, surtout dans le milieu sauvage.
Certaines ressources peuvent être utiles :
- le site de Santé publique France pour les maladies à déclaration obligatoire : https ://bit.ly/4k9bBcf
- le site des centres de référence des maladies vectorielles liées aux tiques : https ://crmvt.fr/
2. Taylor LH, Latham SM, Woolhouse MEJ. Risk factors for human disease emergence. Philosophical Transactions of the Royal Society of London Series B-Biological Sciences 2001;356(1411):983-9.
3. Jones KE, Patel NG, Levy MA, et al. Global trends in emerging infectious diseases. Nature 2008;451(7181):990-4.
4. Sánchez CA, Venkatachalam-Vaz J, Drake JM. Spillover of zoonotic pathogens: A review of reviews. Zoonoses Public Health 2021;68:563-77.
5. Santé publique France. Maladies transmissibles de l’animal à l’homme. https://www.santepubliquefrance.fr/
6. Boulouis HJ, Chomel B. Les bartonelloses, maladies infectieuses émergentes. Rev Prat 2004;54(18):1982-6.
7. Institut Pasteur. Leptospirose. Septembre 2024. https://bit.ly/4jHLust
8. Haute Autorité de santé. Recommandations borréliose de Lyme et autres maladies vectorielles à tiques (MVT). Février 2025. https://bit.ly/3HFNO63

 Encadrés
Encadrés