La prévalence des lésions kystiques pancréatiques (LKP) est estimée, selon les études, entre 16 et 46 % et elle augmente avec l’âge.1,2 La plupart sont bénignes, mais certaines, comme les tumeurs intracanalaires papillaires et mucineuses du pancréas (TIPMP) et les tumeurs kystiques mucineuses, peuvent être précancéreuses, avec un faible risque d’évolution vers un adénocarcinome du pancréas cependant. Le suivi proposé est débattu car coûteux, parfois invasif. Or seule une très faible partie de ces patients auront des lésions évolutives et potentiellement invasives.
Modalités de découverte
La découverte de LKP est généralement fortuite, avec des lésions de petite taille (inférieure à 1 cm). Dans une étude de cohorte prospective allemande, regroupant plus de 1 600 patients, la prévalence des lésions kystiques en population générale adulte était estimée à 46 %, avec comme seul facteur de risque un indice de masse corporelle élevé.2
Les rares LKP volumineuses peu-vent être diagnostiquées lors d’un bilan de douleurs abdominales.
La découverte de lésions liquidiennes après pancréatite aiguë doit orienter vers des pseudokystes, qui sont des lésions non tumorales développées à la suite des phénomènes inflammatoires et d’une rupture canalaire ; ils sont bordés par une pseudocapsule fibreuse et non par un épithélium, d’où le terme de pseudokyste.
Le spectre des LKP est largement dominé par les TIPMP, qui représentent plus de 90 % des motifs de consultation pour ce motif.
Après les TIPMP, on observe, parmi les LKP et par ordre de fréquence : les cystadénomes séreux, les tumeurs kystiques mucineuses, plus rarement les tumeurs neuro-endocrines kystiques, les tumeurs solides et pseudopapillaires (TSPP ou tumeur de Frantz), la transformation kystique des acini, les lymphangiomes kystiques et les kystes lympho-épithéliaux.
Quel bilan réaliser ?
Il est important de porter le diagnostic exact, car la prise en charge et le suivi peuvent différer.
Le scanner et l’imagerie par résonance magnétique (IRM) sont les examens de première intention. Le scanner doit être réalisé avec des coupes fines, centrées sur le pancréas, sans, puis avec injection, au temps artériel, portal et, dans l’idéal, pancréatique. L’IRM doit comporter des séquences T1, T2, diffusion et de wirsungo-IRM.
En cas de doute persistant, une écho-endoscopie, éventuellement associée à une ponction selon la nature du kyste suspecté, peut être proposée.
Pour les TIPMP, un bilan biologique comprenant glycémie à jeun, hémoglobine glyquée (HbA1c), dosage de l’antigène carbohydrate (CA 19 - 9) est recommandé.
Quelle prise en charge et quelle surveillance ?
Deux situations sont à distinguer : lésions précancéreuses (TIPMP ou tumeurs kystiques mucineuses) et lésions bénignes.
Lésions précancéreuses : TIPMP et tumeurs kystiques mucineuses
La politique de surveillance, et parfois de résection préventive de ces lésions à risque de transformation, est proposée du fait :
- de l’absence d’outils diagnostiques sensibles et spécifiques quant au grade de dysplasie ;
- d’un taux de mortalité du cancer du pancréas élevé (survie toujours inférieure à 20 % à cinq ans, tous stades confondus) ;3
- d’un manque de connaissances sur les facteurs prédictifs de dégénérescence au cours des TIPMP et des tumeurs kystiques mucineuses.
Ce suivi est débattu car coûteux, potentiellement invasif (en cas d’usage répété de l’écho-endoscopie avec anesthésie générale) et imparfait (développement possible de cancer dans l’intervalle entre deux examens).
TIPMP
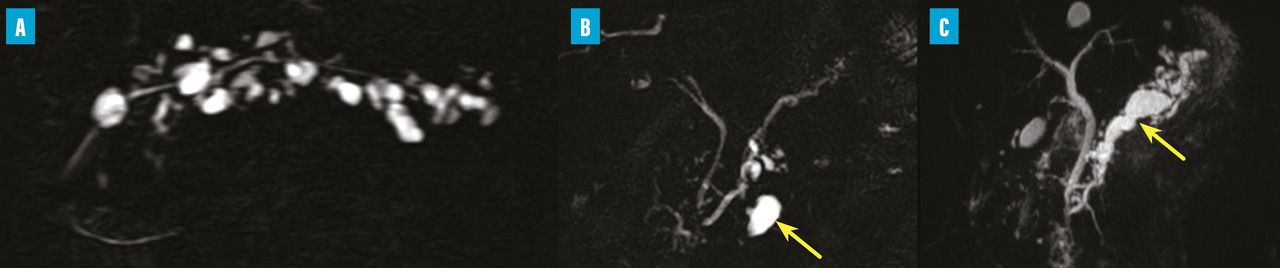
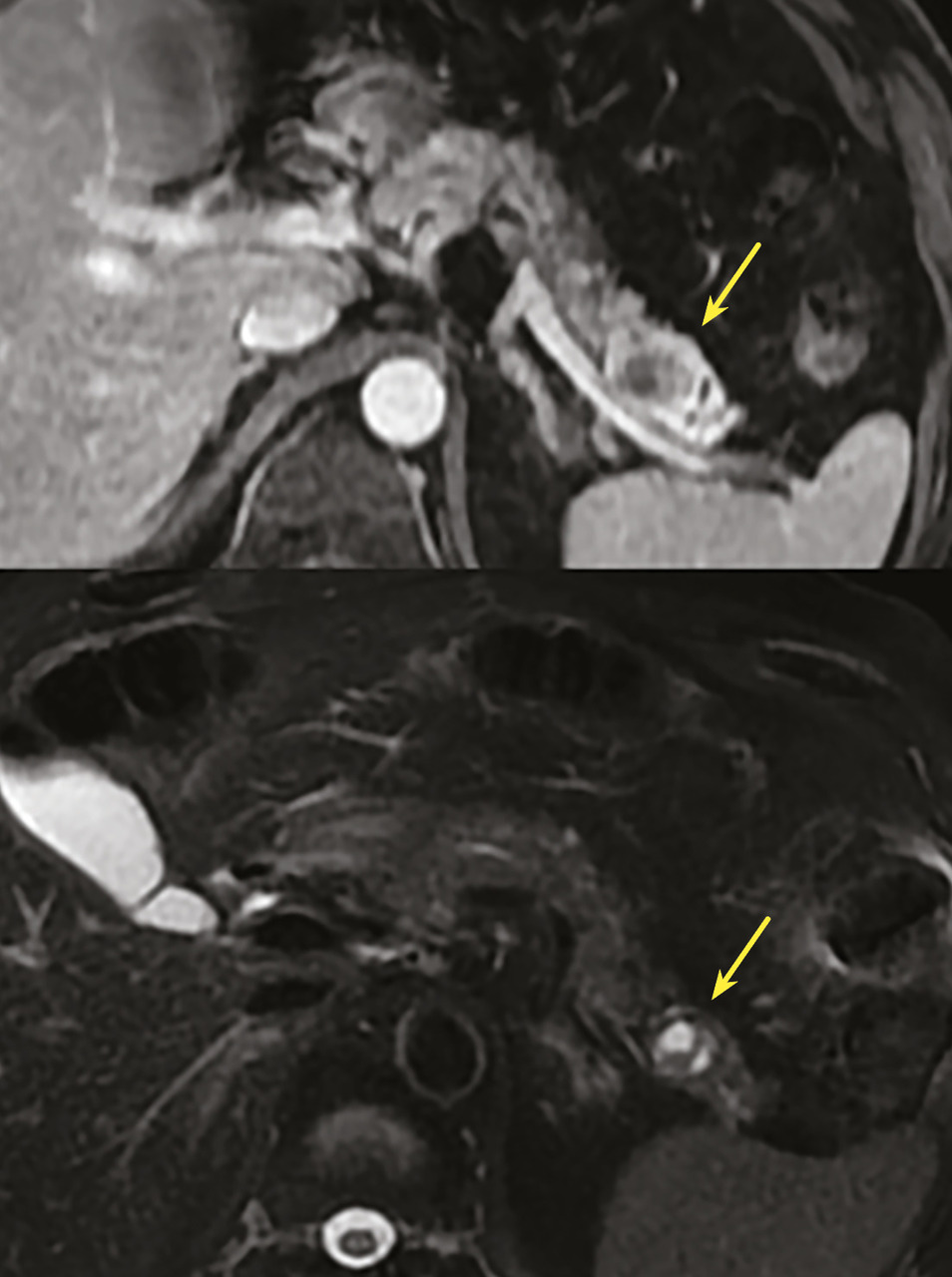
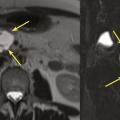
Les TIPMP sont des lésions canalaires intra-épithéliales développées aux dépens des canaux pancréatiques (principal ou/et secondaires) [fig. 1]. Elles prédominent au niveau de la tête et du crochet, mais peuvent concerner toute la glande. La composante kystique des TIPMP présente un épithélium de type mucineux avec production de mucus. Au cours du processus d’oncogenèse, des papilles commencent à se former, et différents phénotypes cellulaires distincts ont été décrits, corrélés à leur pronostic.
Les recommandations pour la prise en charge et le suivi des patients avec TIPMP se sont complexifiées, avec un enchaînement de publications de recommandations : internationales en 2017,4 européennes en 20185 et par un groupe d’experts en 2024.6
Au vu des données épidémiologiques et de la prévalence des lésions kystiques pancréatiques, la proportion de la population française présentant une TIPMP est vraisemblablement grande. Dans une étude en population générale adulte française,7 la prévalence des TIPMP des canaux secondaires était de 7 %, sachant que ce taux augmente avec l’âge et pourrait être supérieur à 10 % au-delà de 60 ans. Cela représente plusieurs millions de Français porteurs d’une TIPMP des canaux secondaires. Sachant que l’incidence du cancer du pancréas est estimée à 16 000 nouveaux cas par an et que l’on estime qu’environ 10 % des cancers se développent sur une lésion de TIPMP préexistante, on peut affirmer facilement que le risque de malignité des TIPMP est très faible.
Les experts distinguent des critères à haut risque de malignité (indications absolues à une résection chirurgicale) et des signes d’inquiétude (indications relatives à une résection préventive) [tableau]. Selon les données de la littérature, le taux de survie spécifique à cinq ans est meilleur dans le groupe de patients avec signes d’inquiétude comparativement au groupe de patients avec critère à haut risque de malignité (96,2 % versus 60,2 %).8
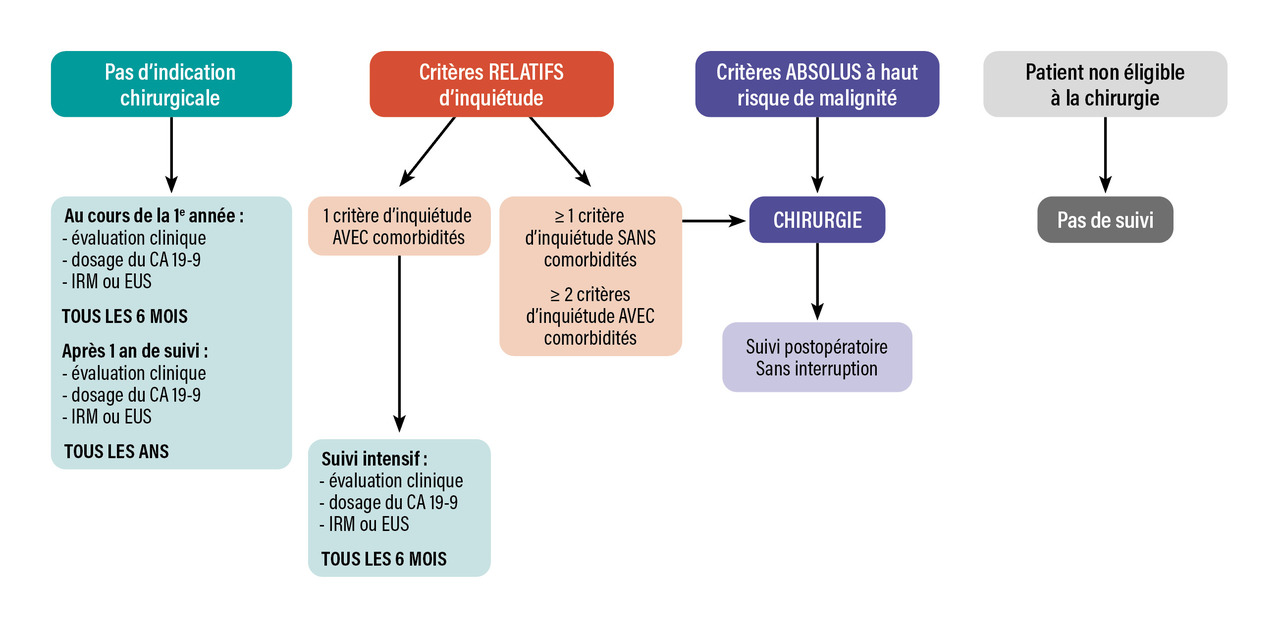
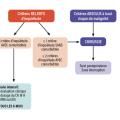
Le schéma de surveillance proposé par les experts européens est présenté dans la figure 2. Cependant, la pertinence médicale de ce schéma de prise en charge n’a pas été évaluée ; de plus, cette surveillance a un coût dont le potentiel bénéfice médico-économique n’est pas connu à ce jour. Les Européens proposent de suivre ce schéma tant que les patients sont éligibles à une chirurgie.
Dans une étude publiée en 2017, ayant inclus 363 patients suivis plus de cinq ans pour TIPMP des canaux secondaires, le risque de cancer était de 2,4 % au cours des cinq premières années de suivi et de 4,4 % ensuite. Le risque de malignité (lésion de haut grade ou invasive) était respectivement de 4,3 et 5,5 %.9
Quand une résection est décidée et en dehors de forme invasive, il est recommandé de toujours privilégier les résections pancréatiques limitées : énucléation, pancréatectomie médiane…
Des études récentes suggèrent qu’un arrêt de la surveillance des TIPMP des canaux secondaires pourrait être envisagé lorsque celles-ci sont de taille inférieure à 20 mm, sans critère d’inquiétude ou de risque de malignité, et stables après cinq ans de suivi, particulièrement chez les patients âgés de plus de 75 ans.10
En cas de comorbidités importantes et/ou si les lésions pancréatiques ne sont pas opérables, on peut surseoir à une surveillance.
Tumeur kystique mucineuse
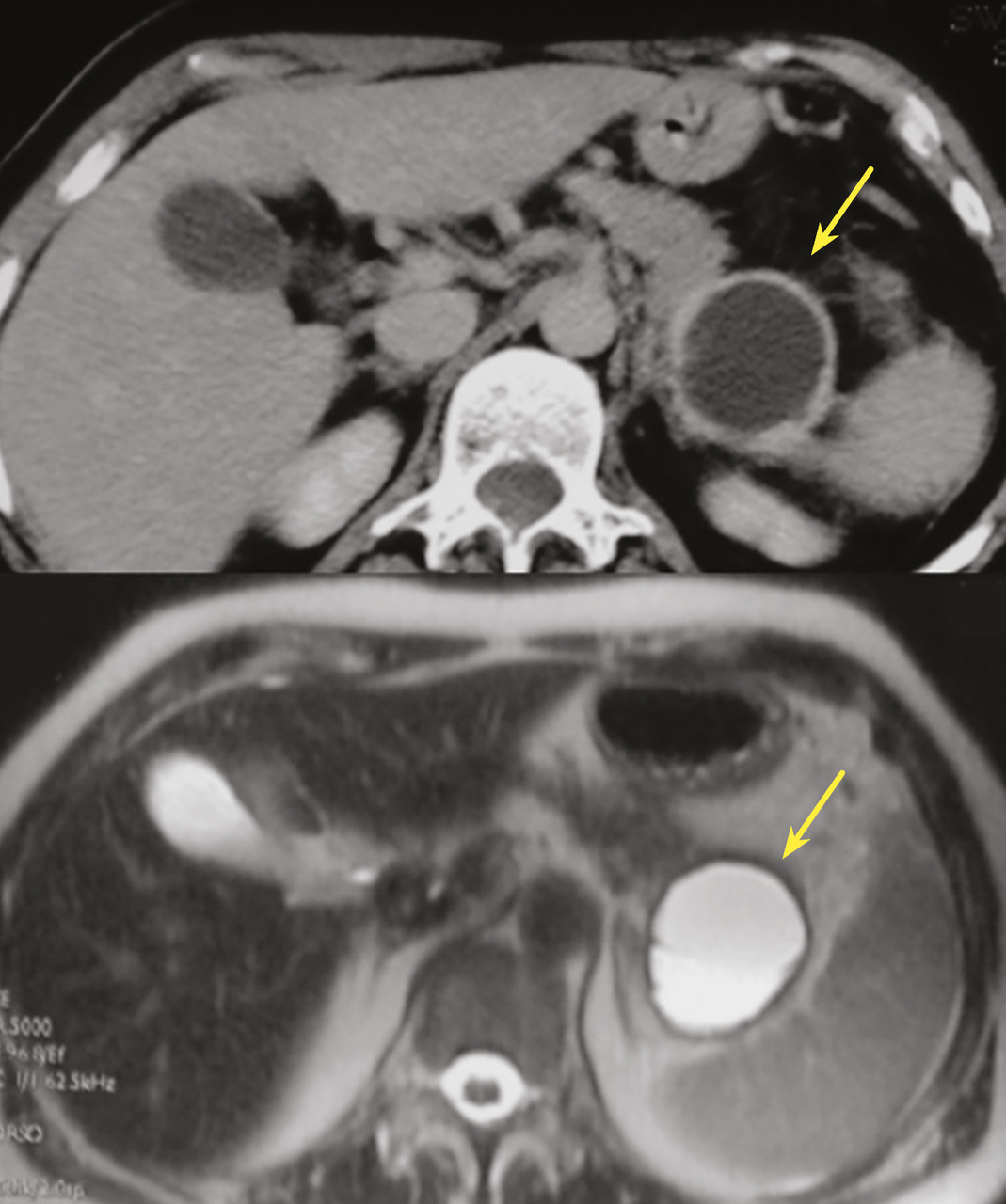
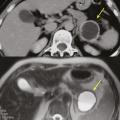
Les tumeurs kystiques mucineuses (TKM) sont des lésions précancéreuses bordées par un revêtement épithélial, sécrétant de la mucine. Il est caractéristique de trouver un stroma de type ovarien, positif en immunohistochimie à la progestérone. Le sex-ratio est fortement en faveur des femmes : (20 femmes pour 1 homme). La découverte est principalement fortuite ou plus rarement sur pancréatite aiguë. Il s’agit d’une lésion unique, macrokystique, sans communication avec les canaux pancréatiques. Elle se situe quasi exclusivement au niveau de la face postérieure du corps et de la queue du pancréas (fig. 3). La lésion est uni- ou multiloculaire, limitée, hypodense, avec rehaussement de la paroi. Il existe de possibles nodules muraux, calcifications périphériques ou cloisons internes.
Le taux de risque d’évolution vers un cancer est inconnu. Les critères comme une taille supérieure à 7 cm, une épaisseur des septas et de la paroi supérieure à 3 mm, un nombre de kystes supérieur à quatre, la présence de nodules, un contenu liquidien hyperintense en séquences IRM T1, une compression ou infiltration périlésionnelle sont associés à des critères de dégénérescence en cystadénocarcinome.11
Dans les recommandations européennes, les experts proposent (à l’instar des TIPMP) une surveillance si la taille de la lésion est inférieure à 40 mm, en cas d’absence de nodules et si le patient est asymptomatique. Pour les lésions de 30 à 40 mm, il est recommandé de prendre en compte l’âge et les comorbidités. Les modalités de surveillance sont la réalisation d’une IRM ou d’une écho-endoscopie tous les six mois pendant un an puis tous les ans. En cas de résection, celle-ci doit être la plus limitée possible, en privilégiant la chirurgie d’épargne de type énucléation ou pancréatectomie médiane. Le risque de récidive postopératoire est nul, il n’est pas recommandé de suivi spécifique si la résection était complète.
Lésions bénignes
Trois entités se distinguent : cystadénome séreux, kyste lympho-épithélial et lymphangiome pancréatique.
Cystadénome séreux
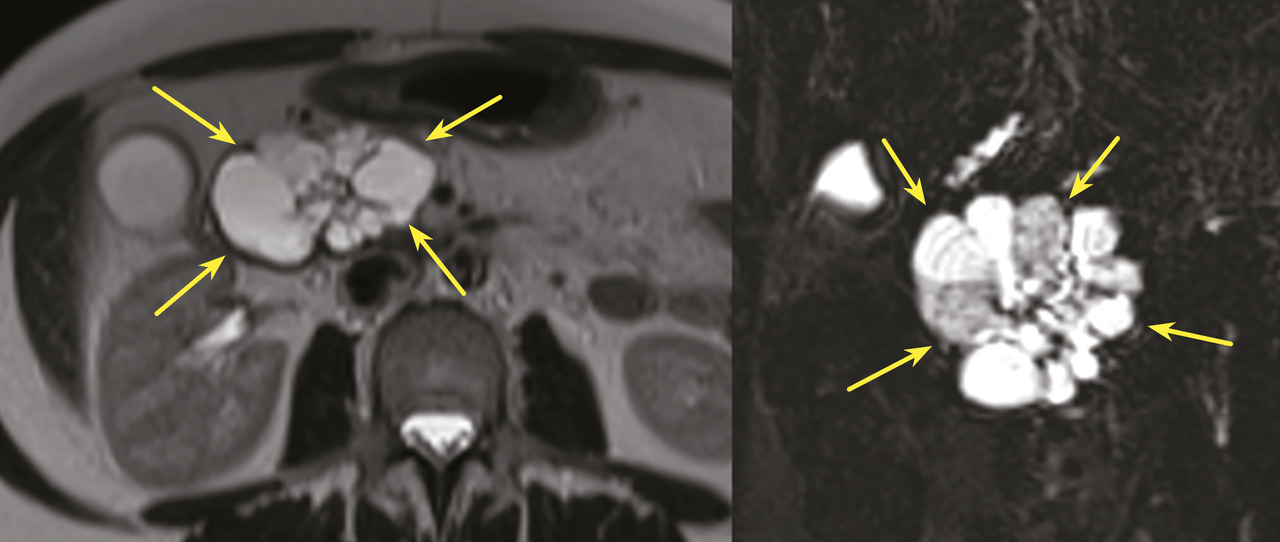
Il s’agit d’une tumeur kystique multiloculaire pouvant mesurer de 1 à plus de 20 cm, avec un aspect de « cicatrice » fibreuse centrale, parfois calcifiée (fig. 4). Ils sont plus fréquents chez les femmes (3 femmes pour 1 homme) avec un âge médian au diagnostic autour de 60 ans. Ils sont le plus souvent de découverte fortuite ou secondaire à l’exploration de douleurs abdominales aspécifiques. Leur taille est stable dans le temps dans 60 % des cas, ou avec une croissance lente (4 mm/an). Les complications sont rares, et la dégénérescence exceptionnelle (moins de dix cas décrits dans la littérature), la surveillance n’est donc pas nécessaire. Pour les exceptionnelles lésions volumineuses (10 % de séreux macrokystiques), une chirurgie peut se discuter12 si elles sont à l’origine de symptômes invalidants.
Kyste lympho-épithélial
Rare et bénin, le kyste lympho-épithélial ne nécessite pas de surveillance particulière et aucune exérèse n’est recommandée. C’est une lésion de forme arrondie, uni- ou multiloculaire, polylobée, exopancréatique dans 75 % des cas, sans dilatation canalaire, avec un sex-ratio masculin (4 :1). La taille moyenne est de 30 à 40 mm. Il existe des amas de kératine visibles sous la forme de spots hyperéchogènes à l’échographie, hyperdenses en tomodensitométrie (TDM), hyperintenses en T1 et hypo-intenses en T2 à l’IRM. Un contingent graisseux intralésionnel peut être mis en évidence à l’IRM.13
Lymphangiome pancréatique
Rare lésion vasculaire bénigne d’origine lymphatique, congénitale (due à une anomalie de développement embryologique) ou acquise (liée à l’obstruction du tissu lymphatique par de la fibrose), le lymphangiome pancréatique ne nécessite pas de surveillance si le patient est asymptomatique car ce kyste est bénin sans risque de dégénérescence. Dans deux tiers des cas, il se situe dans la région corporéo-caudale et les espaces graisseux rétropéritonéaux. Sa taille peut varier de 2 à 20 cm. Si cette lésion se complique (hémorragie intrakystique essentiellement), une résection peut être réalisée et doit être complète pour limiter le risque de récidive locale.14
Lésions kystiques pancréatiques (très) rares
Parmi les autres LKP beaucoup plus rares, certaines sont bénignes ou d’autres à potentiel malin.
Les LKP « a priori bénignes » sont de description très récente et leur histoire naturelle n’est pas connue. Il en est ainsi de la transformation kystique des acini (TKA), une entité de kyste bénin épithélial décrite depuis moins de dix ans, correspondant à une « kystisation » ou « vacuolisation » des acini.15 La différenciation cellulaire est canalaire, sans atypies nucléaires. Les kystes sont souvent multiples, en amas, périphériques, de petite taille, sans communication avec le canal principal. Des calcifications intrakystiques sont possibles. Parfois, le diagnostic différentiel avec une TIPMP des canaux secondaires peut être difficile.16 Il n’a jamais été rapporté de cancer du pancréas développé aux dépens de TKA. Il n’y a aucune indication à une résection.
Parmi les LKP à potentiel malin avec risque de métastases en cas de rupture capsulaire de la lésion, on trouve la rare TSPP, ou tumeur de Frantz, pour laquelle une chirurgie d’emblée en monobloc est proposée. Ces tumeurs ont un sex-ratio féminin (1 :10), elles sont plus fréquentes chez les femmes jeunes (avant l’âge de 30 ans). Le diamètre moyen au diagnostic est de 9 cm et la localisation est corporéocaudale dans deux tiers des cas. En cas de grande taille, un saignement intralésionnel avec risque de rupture capsulaire peut survenir. En cas de métastases synchrones hépatiques et/ou péritonéales, l’exérèse de la totalité des lésions est préconisée (après chimiothérapie selon les cas). De rares cas de transplantation hépatique sont décrits.17
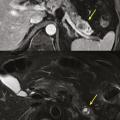
Toujours parmi les LKP rares à potentiel malin, on compte les tumeurs neuro-endocrines (TNE) kystiques (20 % des TNE pancréatiques) [fig. 5]. De découverte fortuite et non fonctionnelles, les TNE kystiques sont uniques, uniloculaires, bien différenciées, de bas grade, c’est-à-dire avec un indicateur de prolifération Ki67 < 3 %, et la présence d’une masse hypervasculaire (nodule) au niveau de la paroi. La partie charnue tissulaire peut être de petite taille.
La prise en charge a longtemps reposé sur une résection systématique des lésions, indépendamment de leur taille ou de leur grade. Des essais prospectifs européens sont en cours pour évaluer le risque de métastases ganglionnaires et à distance en cas de surveillance, pour ainsi valider (ou non) une attitude attentiste.
Selon l’âge et les comorbidités, on peut recommander de surveiller les TNE mesurant moins de 2 cm avec une imagerie en coupe (scanographie ou IRM) tous les six mois pendant dix-huit mois puis tous les ans. En cas de résection, une chirurgie d’épargne est à proposer pour les tumeurs mesurant moins de 2 cm.
Résection et surveillance selon la nature de la lésion
Les lésions kystiques pancréatiques sont d’autant plus fréquentes avec l’âge, la plupart du temps bénignes, avec un risque de dégénérescence pour les TIPMP et les tumeurs kystiques mucineuses.
Les indications de résection d’emblée sont les TIPMP avec signes de malignité, les tumeurs kystiques mucineuses de grande taille avec nodules, les TSPP et les tumeurs neuro-endocrines mesurant plus de 2 cm, ou avec un indice de prolifération supérieur à 3 %.
Les stratégies de surveillance concernent les TIPMP et les tumeurs kystiques mucineuses et parfois les petites tumeurs neuro-endocrines kystiques.
Un protocole de surveillance n’est justifié que pour les patients potentiellement éligibles à un geste chirurgical.
2. Kromrey ML, Bülow R, Hübner J, et al. Prospective study on the incidence, prevalence and 5-year pancreatic-related mortality of pancreatic cysts in a population-based study. Gut 2018;67(1):138‑45.
3. Mas L, Bachet JB. Évolutions épidémiologiques, des modalités de traitement et de survie du cancer du pancréas. Étude PAPRICAP. Hépato-Gastro Oncol Dig 2024;31(4):9‑13.
4. Tanaka M, Fernández-Del Castillo C, Kamisawa T, et al. Revisions of international consensus Fukuoka guidelines for the management of IPMN of the pancreas. Pancreatol Off J Int Assoc Pancreatol IAP Al 2017;17(5):738‑53.
5. European Study Group on cystic tumours of the pancreas. European evidence-based guidelines on pancreatic cystic neoplasms. Gut 2018;67(5):789‑804.
6. Ohtsuka T, Fernandez-Del Castillo C, Furukawa T, et al. International evidence-based Kyoto guidelines for the management of intraductal papillary mucinous neoplasm of the pancreas. Pancreatol Off J Int Assoc Pancreatol IAP Al 2024;24(2):255‑70.
7. Laurent L, Vullierme MP, Rebours V, et al. Estimation of the prevalence of intraductal papillar mucinous neoplasm of the pancreas in the French population through patients waiting for liver transplantation. United Eur Gastroenterol J2017;5(4):499‑503.
8. Crippa S, Bassi C, Salvia R, et al. Low progression of intraductal papillary mucinous neoplasms with worrisome features and high-risk stigmata undergoing non-operative management: A mid-term follow-up analysis. Gut 2017;66(3):495‑506.
9. Pergolini I, Sahora K, Ferrone CR, et al. Long-term risk of pancreatic malignancy in patients with branch duct intraductal papillary mucinous neoplasm in a referral center. Gastroenterology 2017;153(5):1284-1294.e1.
10. Marchegiani G, Pollini T, Burelli A, et al. Surveillance for presumed BD-IPMN of the pancreas: Stability, size, and age identify targets for discontinuation. Gastroenterology 2023;165(4):1016-1024.e5.
11. Di Paola V, Manfredi R, Mehrabi S, et al. Pancreatic mucinous cystoadenomas and cystoadenocarcinomas: Differential diagnosis by means of MRI. Br J Radiol 2016;89(1057):20150536.
12. Jais B, Rebours V, Malleo G, et al. Serous cystic neoplasm of the pancreas: A multinational study of 2622 patients under the auspices of the International Association of Pancreatology and European Pancreatic Club (European Study Group on Cystic Tumors tab).
13. Mege D, Gregoire E, Barbier L, et al. Lymphoepithelial cyst of the pancreas: An analysis of 117patients. Pancreas 2014;43(7):987‑95.
14. Colovic RB, Grubor NM, Micev MT, et al. Cystic lymphangioma of the pancreas. World J Gastroenterol 2008;14(44):6873‑5.
15. Singhi AD, Norwood S, Liu TC, et al. Acinar cell cystadenoma of the pancreas: A benign neoplasm or non-neoplastic ballooning of acinar and ductal epithelium? Am J Surg Pathol 2013;37(9):1329‑35.
16. Delavaud C, d’Assignies G, Cros J, et al. CT and MR imaging of multilocular acinar cell cystadenoma: Comparison with branch duct intraductal papillary mucinous neoplasia (IPMNs). Eur Radiol 2014;24(9):2128‑36.
17. Łągiewska B, Pacholczyk M, Lisik W, et al. Liver transplantation for nonresectable metastatic solid pseudopapillary pancreatic cancer. Ann Transplant 2013;18:651‑3.