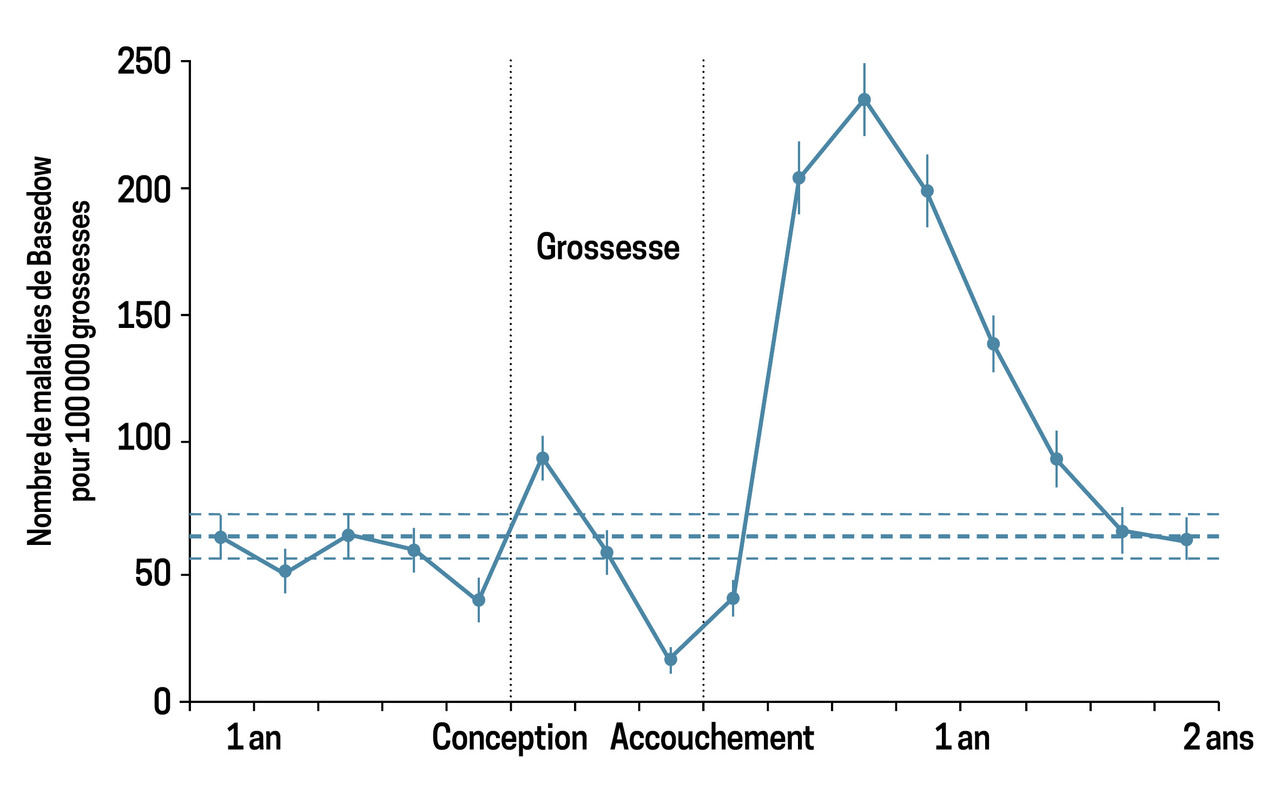
La maladie de Basedow est une maladie auto-immune de la glande thyroïde liée à la présence d’anticorps antirécepteurs de la thyréostimuline (TSH) stimulants, responsable d’une hypersécrétion d’hormones thyroïdiennes par les cellules thyroïdiennes. Elle est la cause la plus fréquente d’hyperthyroïdie au cours de la grossesse (0,2 %), responsable d’une thyrotoxicose, avec de possibles complications maternelles, obstétricales, fœtales et néonatales (fig. 1).1
Les antithyroïdiens de synthèse constituent le traitement de première intention de la maladie de Basedow ; leur passage transplacentaire peut néanmoins être responsable d’une hypothyroïdie fœtale et de malformations.
Au cours d’une grossesse, la maladie de Basedow impose une prise en charge multidisciplinaire (endocrinologue, obstétricien, pédiatre) pour limiter les complications maternelles et fœtales liées à l’hyperthyroïdie auto-immune et au traitement par antithyroïdiens de synthèse.
Signes cliniques
Les signes cliniques de la maladie de Basedow sont secondaires à plusieurs phénomènes :
- activation du système nerveux autonome ;
- hyperthyroïdie auto-immune liée aux anticorps antirécepteurs de la TSH (avec un pic de sécrétion au premier trimestre, puis une diminution au cours des deuxième et troisième trimestres), liée à la tolérance immunologique, à une récidive ou à un rebond en post-partum ;
- sécrétion placentaire d’hCG prédominante au premier trimestre de grossesse et stimulant également la sécrétion thyroïdienne.
Hyperthyroïdie maternelle
Elle est marquée par des palpitations, une tachycardie, une asthénie, une anxiété, une insomnie, une perte de poids ou une absence de prise de poids, voire des complications obstétricales telles que prééclampsie, fausse couche, menace d’accouchement prématuré ou prématurité.2,3 Après l’accouchement, une aggravation ou une récidive de l’hyperthyroïdie de la mère est possible.
Plus rarement, une crise thyrotoxique peut survenir (moins de 1 grossesse sur 120 000), au décours d’un épisode infectieux ou d’hypertension artérielle gravidique, avec tachycardie, fièvre, troubles neurologiques, insuffisance cardiovasculaire et/ou insuffisance pluriviscérale, constituant une urgence médicale et une nécessaire admission dans une unité de réanimation médicale.
Le diagnostic de maladie de Basedow peut être orienté par l’examen clinique, avec un goitre plus ou moins important, homogène et vasculaire, et des manifestations extrathyroïdiennes (exophtalmie, myxœdème prétibial, acropachie).
Hyperthyroïdie fœtale
Elle est rare (moins de 1 % des maladies de Basedow gravidiques) et liée à deux phénomènes :
- le passage transplacentaire de la T4 maternelle responsable d’une tachycardie ;
- le transfert maternofœtal des anticorps antirécepteurs de la TSH au cours de la seconde moitié de la grossesse, avec un goitre, une tachycardie, un retard de croissance intra-utérin, une accélération de la maturation osseuse, une insuffisance cardiaque ou une morbimortalité fœtale.
Hyperthyroïdie néonatale
Elle est secondaire au transfert des anticorps antirécepteurs de la TSH maternels et marquée par une irritabilité, une diarrhée ou un trouble de l’alimentation responsable d’une difficulté à la prise de poids, une diminution de la fontanelle antérieure, une tachycardie, une hypertension artérielle, une insuffisance cardiaque, une hépatosplénomégalie, une cholestase, une thrombocytopénie. L’hyperthyroïdie néonatale est transitoire ; sévère, elle impose un traitement par bêtabloquants, voire, plus rarement, par antithyroïdiens de synthèse.
Poser le diagnostic
Au cours d’une grossesse, le diagnostic d’hyperthyroïdie se fait devant l’augmentation de la concentration de T4 libre ou de T4 totale (supérieure à 1,5 fois la limite supérieure de la normale), alors que la concentration de la TSH est basse (inférieure à 0,1 mU/L).4
Le dosage de la T3 libre est rarement utile au diagnostic positif de thyrotoxicose mais participe à l’évaluation de l’importance de l’hyperthyroïdie.
Le diagnostic de maladie de Basedow repose sur la mise en évidence des anticorps antirécepteurs de la TSH (immunodosage enzymatique, avec une sensibilité de 97 % et une spécificité de 99 %), dont l’activité stimulante impose de réaliser un dosage fonctionnel.
Chez la mère, une échographie cervicale montre une hyperplasie de la thyroïde, hypervascularisée ; chez le fœtus (après 20 semaines de grossesse), l’examen échographique peut mettre en évidence un goitre fœtal associé à une tachycardie et une avance de la maturation osseuse.5
Diagnostic différentiel : la thyrotoxicose transitoire non auto-immune
Le principal diagnostic différentiel d’une maladie de Basedow en début de grossesse est la thyrotoxicose gestationnelle transitoire non auto-immune ; elle concerne 1 à 5 % des grossesses.6
Cette pathologie peut être liée à une augmentation de la concentration d’hCG (grossesses multiples, tumeurs trophoblastiques telles que la môle hydatiforme ou le choriocarcinome), exceptionnellement à une mutation hétérozygote du récepteur de la TSH sensible à hCG (entraînant une hyperthyroïdie pendant toute la grossesse et qui récidive à chaque grossesse) ou à l’augmentation de l’activité TSH-like de certaines formes moléculaires d’hCG.7
L’hyperthyroïdie au cours d’une thyrotoxicose gestationnelle transitoire non auto-immune est modérée (tachycardie, anxiété, hypernervosisme, thermophobie, tremblements), transitoire (entre 4 - 9 semaines et 14 - 20 semaines de grossesse), associée rarement à des nausées, des vomissements et à une perte de poids de plus de 5 % en situation d’hyperemesis gravidarum.
Le diagnostic est confirmé par une hyperthyroïdie (TSH basse, T4 libre augmentée) alors que la T3 libre est normale ou modérément augmentée. Un rapport TT3/TT4 bas et surtout l’absence d’anticorps antirécepteurs de la TSH permettent d’affirmer le diagnostic (tableau).
Un traitement par bêtabloquants peut être envisagé si l’hyperthyroïdie est symptomatique. Les antithyroïdiens de synthèse ne sont pas indiqués du fait du caractère transitoire de la thyrotoxicose gestationnelle non auto-immune, le plus souvent sans conséquence sur l’évolution de la grossesse.
Plus rarement, au cours d’une grossesse, la thyrotoxicose peut être secondaire à un goitre multinodulaire hyperfonctionnel, à un nodule toxique, à une thyroïdite subaiguë de De Quervain, à une thyroïdite aiguë, à une thyrotoxicose factice, à un adénome thyréotrope ou à un goitre ovarien hyperfonctionnel.
Prise en charge thérapeutique
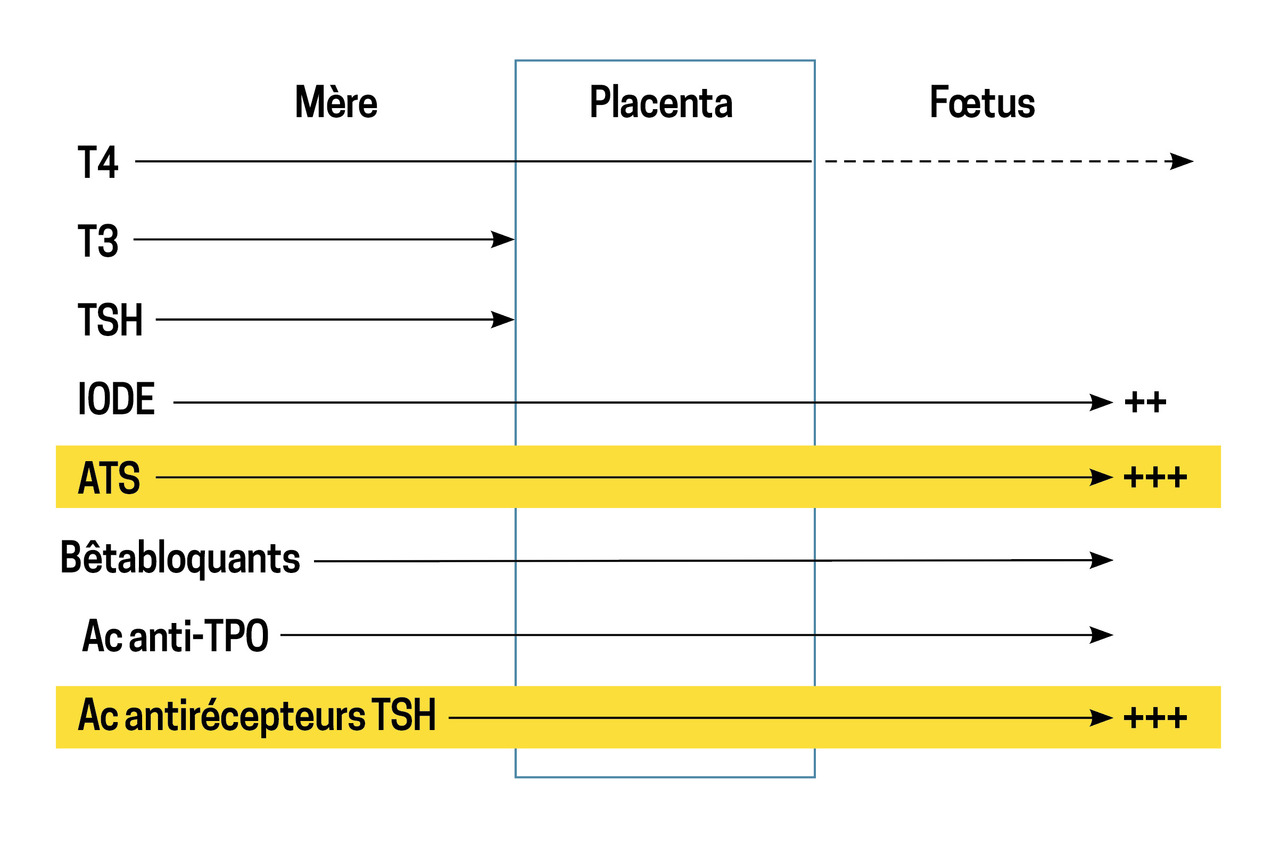
La consultation prégestationnelle d’une patiente ayant un antécédent de maladie de Basedow ou ayant une hyperthyroïdie auto-immune doit permettre de prévenir les complications liées à la thyrotoxicose et au traitement (encadré 1). En effet, au cours d’une grossesse, la maladie de Basedow responsable d’une hyperthyroïdie impose différents types de traitement (fig. 2).8 - 10
Traitement symptomatique
Les bêtabloquants sont utilisés pour le traitement symptomatique de la thyrotoxicose.
Du fait des risques de bradycardie fœtale, de ralentissement de la croissance fœtale et d’hypoglycémie néonatale, la durée de ce traitement doit être la plus courte possible, à la dose minimale, en fonction de la thyrotoxicose et de la réponse cardiaque.
Antithyroïdiens de synthèse : traitement de première intention
Les antithyroïdiens de synthèse (ATS) constituent le traitement de première intention d’une maladie de Basedow au cours de la grossesse. Ils sont de deux types : imidazolés (carbimazole, méthimazole) et thio-uraciles (propylthio-uracile, benzylthio-uracile).
Mécanisme d’action
Les ATS inhibent l’incorporation de l’iode dans la tyrosine et le couplage des iodotyrosines en iodothyronines, entraînant une inhibition de la synthèse des hormones thyroïdiennes de manière dose-dépendante.
De plus, le propylthio-uracile inhibe la désiodase de type 2 et diminue la concentration de la T3, hormone biologiquement active.
Au cours du traitement par ATS, le taux des anticorps antirécepteurs de la TSH diminue.
Le transfert placentaire est plus important pour les ATS que pour la lévothyroxine (LT4), et la thyroïde fœtale est plus sensible aux ATS que la thyroïde maternelle. Ces deux phénomènes expliquent le risque de goitre et d’hypothyroïdie fœtale au cours d’un protocole thérapeutique block and replace*.
Le traitement par titration de dose d’ATS doit permettre de restaurer une euthyroïdie (dose minimale pour une T4 libre à la limite supérieure de la normale ou une T4 totale inférieure à 1,5 fois la limite supérieure de la normale).
Le bilan fonctionnel thyroïdien (TSH, T4 libre ou T4 totale) est surveillé toutes les deux à quatre semaines au cours du traitement par ATS afin de dépister une hypothyroïdie iatrogène.
Effets indésirables maternels et tératogènes
Les ATS peuvent être responsables d’effets indésirables cutanés allergiques (prurit, urticaire dans moins de 5 % des cas), d’une altération du goût (dysgueusie, agueusie), d’une fièvre, d’un syndrome polyarticulaire, d’une vascularite à anticorps anticytoplasme des polynucléaires neutrophiles (ANCA ; rare au cours de la grossesse), d’une agranulocytose (0,15 %) imposant une surveillance de l’hémogramme et de complications hépatiques cholestatiques (imidazoles) ou d’une insuffisance hépatocellulaire (propylthio-uracile) imposant une surveillance biologique des paramètres hépatiques.
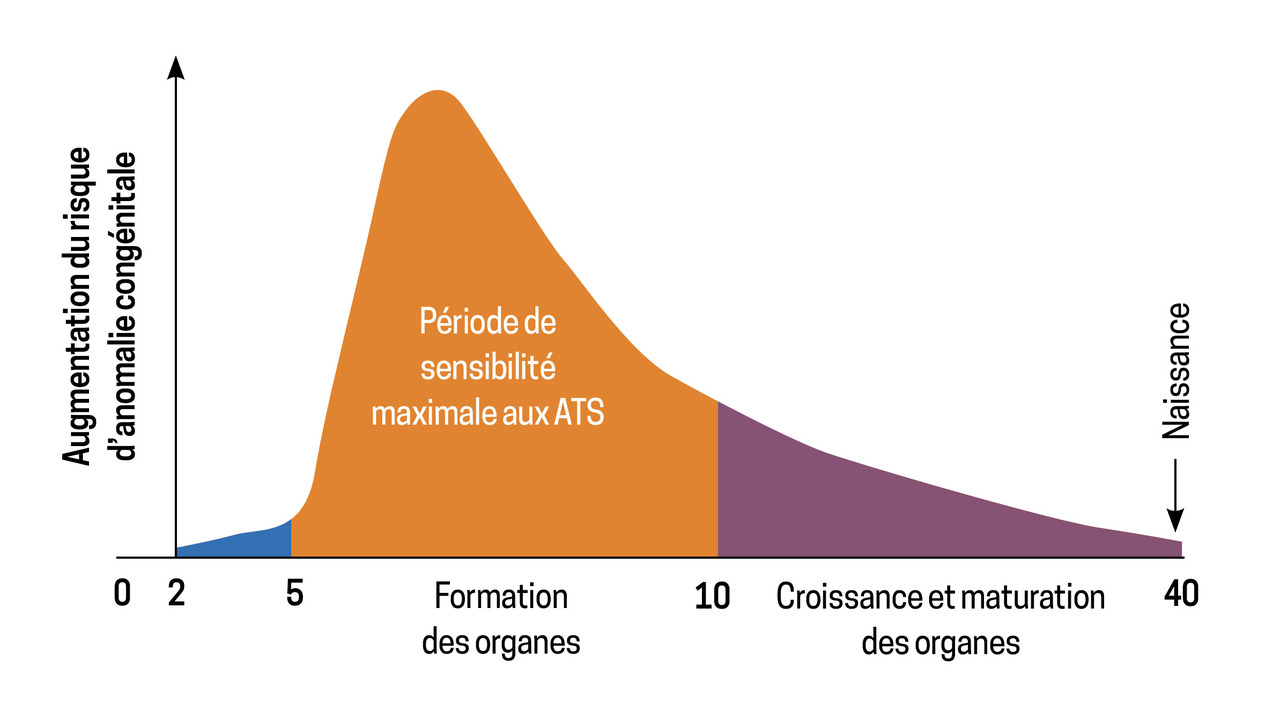
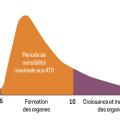
Des effets tératogènes peuvent apparaître selon la date de début de traitement par rapport à l’ancienneté de la grossesse et à la classe de l’ATS, avec un risque plus important avec les imidazolés prescrits entre six et dix semaines de gestation (figure 3).11 L’embryopathie aux imidazolés (2 à 4 %) associe un syndrome dysmorphique (bec de lièvre), une atrésie des choanes et de l’œsophage, un trouble de la paroi abdominale ou un omphalocèle, une aplasia cutis, des malformations mammaires et urinaires. Le propylthio-uracile peut, quant à lui, être responsable de l’apparition de kystes du visage et du cou et d’anomalies du tractus urinaire (2 à 3 %).
Antithyroïdiens de synthèse en pratique
Ainsi, une hyperthyroïdie diagnostiquée en début de grossesse est traitée par le propylthio-uracile, et un traitement par imidazolés antérieur à la grossesse doit être remplacé par le propylthio-uracile au début du premier trimestre de grossesse (avant la période critique du risque tératogène, entre 6 et 10 semaines de gestation).12
Après le premier trimestre de grossesse, le traitement par propylthio-uracile peut être poursuivi ou remplacé par un imidazolé, du fait du risque d’insuffisance hépatocellulaire au cours du traitement par propylthio-uracile.
Parallèlement à l’évolution du taux des anticorps antirécepteurs de la TSH, les doses d’ATS sont diminuées et le traitement peut être arrêté à la fin du deuxième ou au début du troisième trimestre, imposant une surveillance du bilan thyroïdien toutes les quatre à huit semaines.
Le traitement par ATS peut être poursuivi au cours de l’ allaitement maternel (doses d’imidazolés inférieures à 20 - 30 mg/j, de propylthio-uracile inférieures à 300 mg/j, fractionnées en deux ou trois prises après les tétées) avec une surveillance mensuelle de la fonction thyroïdienne du nouveau-né (encadré 2).
Place de la chirurgie
Parmi les autres traitements possibles de la maladie de Basedow, une thyroïdectomie totale peut être réalisée au cours du deuxième trimestre de grossesse en cas de thyrotoxicose non contrôlée en dépit d’une dose importante d’ATS, du fait des effets indésirables des ATS, d’un goitre compressif ou lorsque la patiente exprime un désir de grossesse rapide ou le souhait d’un traitement radical de la maladie de Basedow.
Une chirurgie au premier trimestre expose à un risque d’avortement et, au cours du troisième trimestre, à une menace d’accouchement prématuré, voire à une mort fœtale intra-utérine.
La thyroïdectomie totale peut être préparée par un traitement transitoire par iodure de potassium (contrôle de la thyrotoxicose, diminution de la vascularisation de la thyroïde) et impose une hormonothérapie substitutive par lévothyroxine (dose supérieure à 1,6 mg/kg/j en postopératoire), afin de restaurer ou de maintenir une euthyroïdie et prévenir les conséquences maternelles et fœtales d’une hypothyroïdie post-chirurgicale.
Contre-indication à l’iode radioactif
Le traitement par iode radioactif est contre-indiqué pendant la grossesse (risque tératogène, augmentation du taux d’anticorps antirécepteurs de la TSH). Une grossesse ne peut être envisagée que six mois après un traitement par iode radioactif chez une patiente euthyroïdienne.
1. Consultation prégestationnelle
La consultation prégestationnelle d’une patiente ayant un antécédent de maladie de Basedow ou avec une hyperthyroïdie auto-immune doit permettre de prévenir les complications liées à la thyrotoxicose et au traitement.
Une femme en âge de procréer doit être informée de la nécessité :
- d’une contraception au cours du traitement par antithyroïdiens de synthèse (ATS) et de programmer les éventuelles grossesses ;
- de réaliser un test de grossesse dès les premiers jours de retard de règles afin de modifier un traitement block and replace : arrêt de la lévothyroxine et dose minimale du propylthio-uracile pour contrôler l’hyperthyroïdie de début de grossesse ;
- de l’arrêt du traitement par ATS imidazolés et mise en route d’un traitement par le propylthio-uracile dès le début de la grossesse ;
- de réaliser un dosage des anticorps antirécepteurs de la TSH si la dose d’ATS est faible, en vue d’envisager un arrêt du traitement par l’ATS et de mettre en place une surveillance fonctionnelle thyroïdienne et des anticorps antirécepteurs de la TSH ;
- des risques et bénéfices d’un traitement par ATS et par chirurgie ;
- de la contre-indication du traitement par iode radioactif pendant la grossesse.
En cas d’antécédent de maladie de Basedow, les recommandations sont les suivantes :
- en l’absence de traitement par ATS, une surveillance clinique et de la TSH s’impose ;
- s’il existe un antécédent de thyroïdectomie totale, le traitement par lévothyroxine doit être poursuivi, avec une augmentation systématique de la posologie au diagnostic de la grossesse, ainsi qu’un contrôle de la TSH et des anticorps antirécepteurs de la TSH à un mois ;
- si la patiente poursuit un traitement par ATS avec un protocole de titration ou un block and replace au début de la grossesse, le propylthio-uracile peut être poursuivi et les imidazolés suspendus ;
- s’il existe un antécédent de traitement par iode radioactif, il convient de différer d’au moins six mois la grossesse et de surveiller le taux des anticorps antirécepteurs de la TSH du fait du risque d’hyperthyroïdie fœtale.
2. Consultation post-gestationnelle
Chez la mère, un rebond immunologique est possible en post-partum exposant à une récidive ou à une aggravation de la thyrotoxicose. La surveillance fonctionnelle thyroïdienne (TSH) et immunologique (anticorps antirécepteurs de la TSH) est donc indispensable à 1, 3, 6 et 12 mois.
Devant une thyrotoxicose, il est recommandé d’éliminer une thyroïdite du post-partum avec épisode transitoire de thyrotoxicose, suivie d’une hypothyroïdie avant retour à une euthyroïdie. Dans cette situation, on constate l’absence d’anticorps antirécepteurs de la TSH et de fixation à la scintigraphie thyroïdienne (après un arrêt transitoire de l’allaitement maternel). Le traitement repose sur les bêtabloquants lors de l’épisode de thyrotoxicose et sur la lévothyroxine lors de l’hypothyroïdie.
Il n’y a pas de contre-indication à l’allaitement maternel chez une femme traitée par ATS, à la dose minimale, fractionnée après deux ou trois tétées. Cependant, une surveillance de la fonction thyroïdienne du nouveau-né est de rigueur.
Une hyperthyroïdie néonatale impose un traitement transitoire par ATS, guidé par l’évolution du taux des anticorps antirécepteurs de la TSH.
Que dire à vos patientes ?
En cas de maladie de Basedow, il convient de programmer toute grossesse. En effet, des complications maternelles et fœtales sont possibles.
Une prise en charge multidisciplinaire est nécessaire en cas de maladie de Basedow pour mener à terme une grossesse normale.
2. Korevaar TIM, Medici M, Visser TJ, et al. Thyroid disease in pregnancy: new insights in diagnosis and clinical management. Nat Rev Endocrinol 2017;13(10):610-22.
3. Nguyen CT, Sasso EB, Barton L, et al. Graves’ hyperthyroidism in pregnancy: A clinical review. Clin Diabetes Endocrinol 2018;4:4.
4. Puthiyachirakal MA, Hopkins M, AlNatsheh T, et al. Overview of thyroid disorders in pregnancy. Matern Health Neonatol Perinatol 2025;11(1):9.
5. Luton D, Le Gac I, Vuillard E, et al. Management of Graves’disease during pregnancy: The key role of fetal thyroid gland monitoring. J Clin Endocrinol Metab 2005;90(11):6093-8.
6. Guo N, Xue M, Liang Z. Advances in the differential diagnosis of transient hyperthyroidism in pregnancy and Graves’ disease. Arch Gynecol Obstet 2023;308(2):403-11.
7. Caron P, Broussaud S, Galano-Frutos JJ, et al. New variant (Val597Ile) in transmembrane region of the TSH receptor with human chorionic gonadotropin hypersensitivity in familial gestational hyperthyroidism. Clin Endocrinol (Oxf) 2020;93(3):339-45.
8. Chan SY, Marsh MS, Gilbert J, et al. Management of Thyroid Disorders in Pregnancy: Green-top Guideline No. 76. BJOG 2025;132(8):e130-61.
9. Shah R, Adamson SE, Jasim S. Management Aspects of Medical Therapy in Graves Disease. Endocr Pract 2025;31(4):536-46.
10. Petca A, Dimcea DAM, Dumitrașcu MC, et al. Management of Hyperthyroidism during Pregnancy: A Systematic Literature Review. J Clin Med 2023;12(5):1811.
11. Seo GH, Kim TH, Chung JH. Antithyroid Drugs and Congenital Malformations: A Nationwide Korean Cohort Study. Ann Intern Med 2018;168(6):405-13.
12. Haute Autorité de santé. Prise en charge des hyperthyroïdies en population générale. Décembre 2022.

 Encadrés
Encadrés