Si l’incidence de cette pathologie est relativement faible, estimée à 2,5/100 000 habitants par an en France, la prévalence est élevée, de l’ordre de 1 % de la population. Cette différence est liée au fait qu’elle débute chez l’adulte jeune et évolue de façon chronique durant toute la vie. Les disparités géographiques sont extrêmement marquées, avec un gradient Est-Ouest et Nord-Sud : la fréquence est importante en Asie (5,7/100 000 au Japon) et très faible en Afrique (0,2/100 000).
Sa physiopathologie n’est pas bien connue. Une prédisposition génétique est impliquée (maladie polygénique), mais elle est insuffisante à elle seule. S’y associent de probables facteurs environnementaux déterminant des anomalies de production et de clairance des IgA1 dans le secteur plasmatique.
Récemment, une équipe de l’Inserm a découvert le rôle potentiel d’une bactérie du microbiote intestinal, Akkermansia muciniphila . Leurs travaux montrent que cette bactérie dégrade les sucres présents sur les immunoglobulines A situées au niveau du mucus intestinal. Ces immunoglobulines « déglycosylées », lorsqu’elles repassent dans la circulation sanguine, sont perçues comme étrangères par le système immunitaire : séquestrées par des anticorps, elles forment des complexes immuns de haut poids moléculaire qui se déposent au niveau de la partie mésangiale des glomérules.
Quand l’évoquer ?
La manifestation la plus classique est la survenue d’hématuries macroscopiques pendant des épisodes d’infections muqueuses (ORL en particulier). Brunes, parfois rouges, sans aucun caillot, elles concernent la totalité de la miction, apparaissent dans les jours suivant le début de l’infection et perdurent jusqu’à sa disparition. Elles se distinguent ainsi des hématuries associées à une glomérulonéphrite aiguë post-streptococcique, qui surviennent au moins 10 jours après l’infection. La récidive de tels épisodes est très évocatrice. Rarement, une insuffisance rénale aiguë régressive complique le tableau, liée à une obstruction tubulaire par les cylindres hématiques.
Le plus souvent, aucun symptôme n’est rapporté par le patient, et c’est à l’occasion d’un bilan qu’on fait le diagnostic : bandelette urinaire, analyse systématique des urines, évaluation de la fonction rénale ou bilan d’HTA.
L’exploration minimale comporte une protéinurie des 24 heures ou rapportée à la créatininurie sur échantillon, un examen cytobactériologique des urines, la prise de la PA et l’estimation du DFG (créatinine). Une biopsie rénale est réalisée devant l’association protéinurie + hématurie ou DFGe < 60 mL/min/1,73 m2 + hématurie. En cas de microhématurie isolée (> 10 éléments/mm3), elle n’est pas nécessaire, mais un suivi spécialisé est recommandé. Une hématurie macroscopique récidivante avec sédiment urinaire et fonctionnement rénal normaux entre les épisodes est une indication plus discutée, le diagnostic étant alors presque certain, et le pronostic plutôt bon.
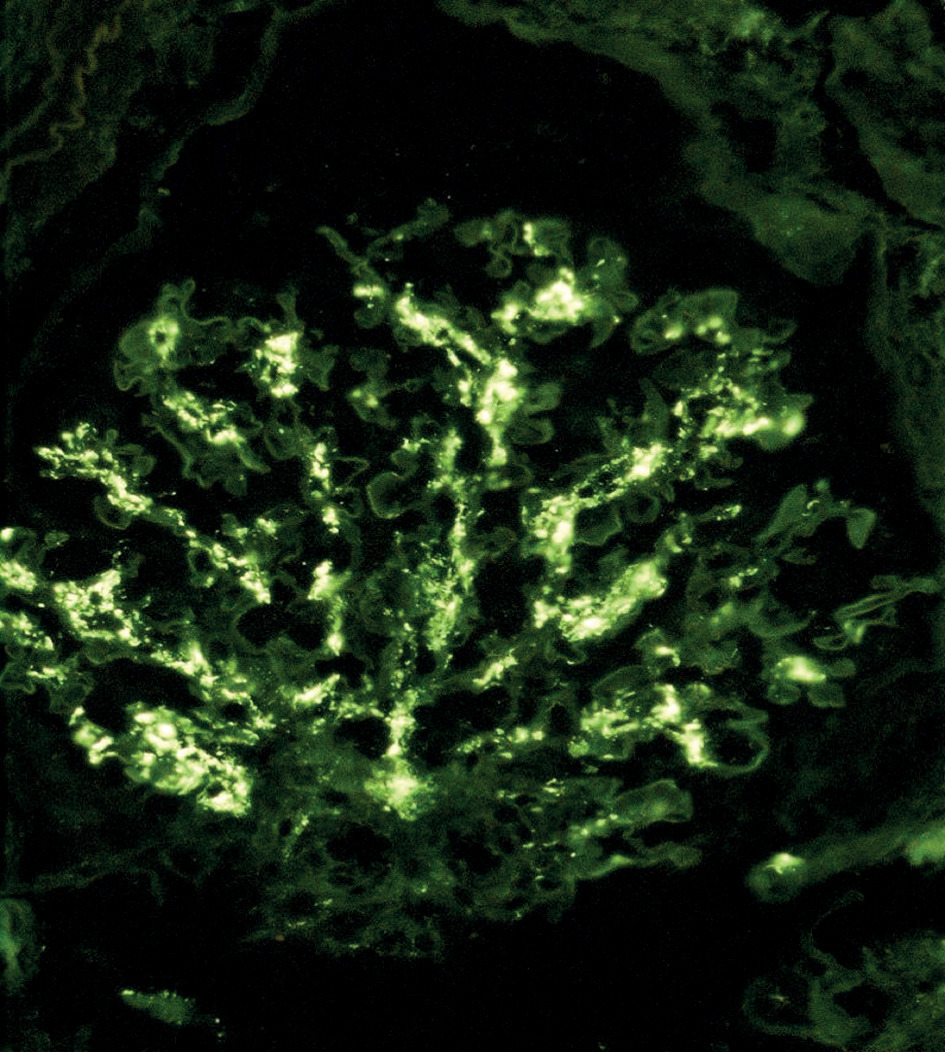
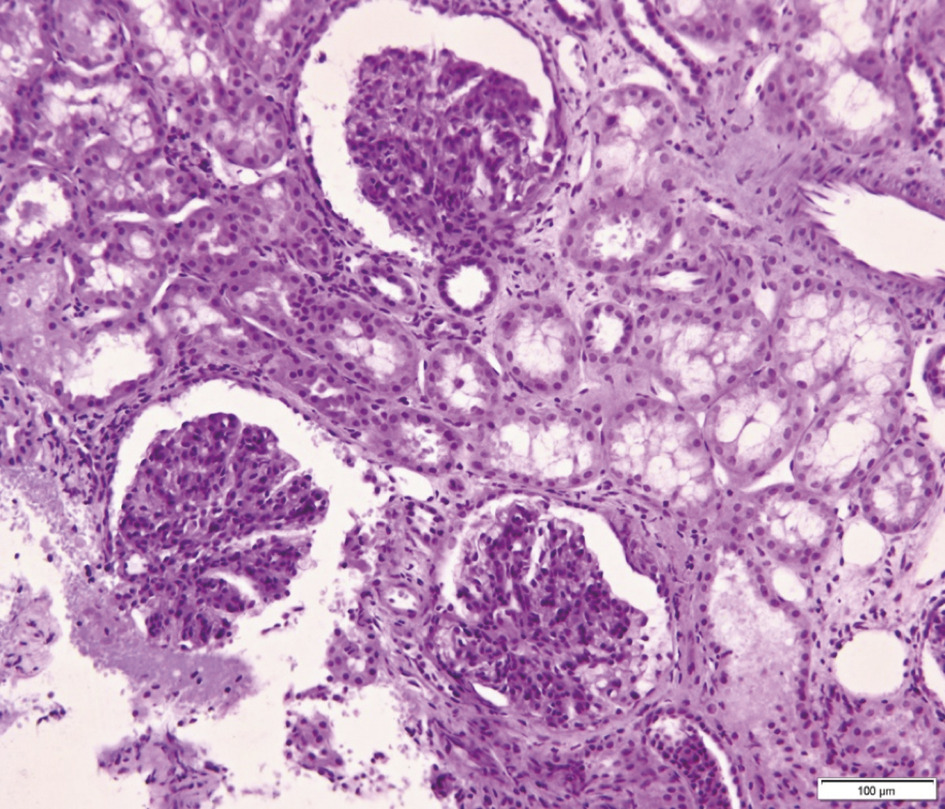
L’immunomarquage met en évidence des dépôts d’IgA au sein du mésangium, structure située entre les capillaires glomérulaires (fig. 1), diffus et volontiers associés à des agrégats de C3. Les lésions glomérulaires sont inconstantes : épaississement du mésangium, prolifération mésangiale (fig. 2), endocapillaire ou extracapillaire, hyalinose segmentaire et focale.
Évolution : hétérogène
Cette maladie peut évoluer vers l’insuffisance rénale chronique de stade 5 ou terminale (< 15 mL/min/1,73 m2), 20 ans après le diagnostic, mais de fortes disparités existent.
Les formes à microhématurie isolée ont un pronostic excellent, contrairement à celles associant forte protéinurie, HTA, altération du DFGe et lésions histologiques sévères. Ainsi, la stratification du risque est indispensable pour adapter la prise en charge. Certains marqueurs histologiques ont également un impact pronostique.
Quelle prise en charge ?
Si le risque d’évolution vers l’IR terminale est faible (microhématurie isolée, protéinurie < 0,5 g/j, absence d’HTA et DFG > 60 mL/min/1,73m2), de simples mesures hygiénodiététiques et un suivi spécialisé sont suffisants.
En cas de risque intermédiaire ou élevé (protéinurie > 0,5 g/j au diagnostic, plus ou moins associée à une HTA et une altération du DFGe), des mesures générales de néphroprotection sont recommandées. Une PA < 130/80 mmHg doit être obtenue avec des moyens non pharmacologiques (activité physique, correction du surpoids, réduction de la consommation d’alcool) et des thérapies médicamenteuses. Les inhibiteurs de l’ECA ou les antagonistes des récepteurs de l’angiotensine II sont des antihypertenseurs de choix. Un inhibiteur de SGLT2 peut être utilisé en 2e intention.
Dans les formes les plus sévères, à risque évolutif élevé, une corticothérapie peut être proposée dans certains cas après évaluation de la balance bénéfice/risque. Il n’y a pas de consensus parmi les experts sur le protocole optimal.
Enfin, en cas de progression vers une IR terminale, la transplantation rénale est fréquente, car les patients concernés sont jeunes (environ 50 ans) et ont peu de comorbidités. Cependant, les récidives sont fréquentes (25 % des receveurs de greffe).
O’Brien F. Néphropathie à immunoglobulines A. Manuel MSD juin 2023.
Gleeson PJ, Benech N, Chemouny J, et al. The gut microbiota posttranslationally modifies IgA1 in autoimmune glomerulonephritis. Sci Trans Med 2024;16:740.
Associations de patients :https://www.airg-france.fr ; https://www.francerein.org