La ménopause, phénomène physiologique débutant généralement vers l’âge de 50 ans, ne se limite pas à l’épuisement de la fonction ovarienne et à ses conséquences sur la fertilité. Il s’agit aussi d’un tournant dans la vie des patientes, avec un cortège de symptômes et d’affections qui dépassent largement la seule sphère gynécologique. Il s’agit bien d’une nouvelle étape de la vie, avec sa physiologie propre et une épidémiologie spécifique. Si, pour des raisons évidentes, sa gestion est de la responsabilité du gynécologue, celui-ci doit être considéré comme un coordinateur de la prise en charge qui, selon les cas, doit inclure différents spécialistes, y compris le médecin de famille. C’est bien là que la personnalisation de la prise en charge est essentielle : toutes les patientes ne déclarent pas l’ensemble des symptômes liés à la ménopause.
Un diagnostic rétrospectif
« Ménopause » est un mot de racine grecque qui signifie « arrêt des règles ». Et c’est bien de cela qu’il s’agit : la ménopause naturelle est un phénomène physiologique complexe de la vie des femmes, résultant de la cessation de la fonction ovarienne et se manifestant notamment par l’arrêt des menstruations. Biologiquement, la ménopause est marquée par un taux d’œstradiol sanguin effondré (inférieur à 20 pg/L) et un taux d’hormone folliculostimulante (FSH) élevé (supérieur à 30 UI/L). Par convention, le diagnostic de ménopause n’est posé qu’au terme d’une année complète sans règles, et cet aspect rétrospectif rend parfois le diagnostic périlleux à poser. Le gynécologue peut cependant s’aider des éléments échographiques tels qu’un endomètre fin, des ovaires de petite taille et sans follicules visualisés.
Les ultimes règles sont généralement précédées d’une période de quelques années de fluctuations hormonales, appelée périménopause, ou transition ménopausique, au cours de laquelle les cycles menstruels deviennent irréguliers avec apparition fréquente de symptômes ménopausiques transitoires. Tenter d’interpréter un bilan biologique hormonal durant cette période est difficile et n’est d’ailleurs pas recommandé tant les variations d’un cycle à l’autre peuvent être importantes.
En outre, un certain nombre de femmes sont toujours, à cet âge, sous contraception hormonale, ce qui peut masquer la transition ménopausique. Dans ce cas, il est utile de demander à la patiente d’arrêter le contraceptif vers l’âge habituel de la ménopause (en le remplaçant par une contraception mécanique) afin d’évaluer le retour ou non des règles.
Enfin, il peut être nécessaire de réaliser un dosage hormonal (œstradiol et FSH) chez les patientes qui ont eu une hystérectomie ou une endométrectomie, rendant impossible l’analyse d’un pattern menstruel, et chez les patientes porteuses d’un dispositif intra-utérin au lévonorgestrel.
Syndrome climatérique, sur le long terme
Au niveau clinique, la ménopause ne se limite pas à l’arrêt des menstruations : le manque d’œstrogènes est en effet responsable d’une série de symptômes constituant le syndrome climatérique, qui est un motif fréquent de consultation.
Au premier rang de ces symptômes, les bouffées de chaleur, diurnes et surtout nocturnes, sont ressenties par près de 80 % des patientes et se prolongent généralement pendant plusieurs années (en moyenne 4,5 années après les dernières règles). Environ 8 % des femmes déclarent encore avoir des bouffées de chaleur vingt ans après le début de la ménopause.1 La présence de bouffées de chaleur nocturnes altère significativement la qualité du sommeil. Ce dernier est également affecté par les symptômes anxiodépressifs, qui sont 2,5 fois plus fréquents au moment de la transition ménopausique.2 En moyenne, 40 % des femmes ménopausées rapportent des troubles du sommeil qui affectent grandement leur qualité de vie, ainsi qu’un « brain fog » (brouillard cérébral) qui peut entraîner des difficultés de concentration et réduire la compétitivité professionnelle.
Syndrome génito-urinaire
Les muqueuses vulvovaginales et urinaires expriment de nombreux récepteurs aux œstrogènes qui assurent le maintien d’une épaisseur épithéliale optimale et favorisent la lubrification tissulaire en stimulant notamment la production d’acide hyaluronique. Privées de l’action des œstrogènes, ces muqueuses s’assèchent et s’atrophient, donnant lieu à différents symptômes (inconfort vulvovaginal, dyspareunie, saignements post-coïtaux, diminution de la libido, anorgasmie, urgenturie, dysurie et infections urinaires fréquentes) regroupés sous le terme de syndrome génito-urinaire de la ménopause. Ces phénomènes sont classiquement décrits plusieurs années après le début de la ménopause, mais certaines patientes les rapportent précocement, parfois même au stade de la périménopause.
Première consultation pour ménopause, le bilan d’abord !
S’il est évident qu’au même titre que la puberté ou la grossesse, la ménopause est un événement physiologique – au sens de non pathologique –, il n’en reste pas moins que la qualité de vie des femmes peut être très altérée par les symptômes climatériques. Or, avec une espérance de vie moyenne actuelle de 85,3 ans, les femmes passent près de 40 % de leur vie en état de ménopause. Nombre d’entre elles sont encore professionnellement actives au moment de l’installation des symptômes, ce qui peut constituer une inégalité par rapport à leurs collègues masculins.
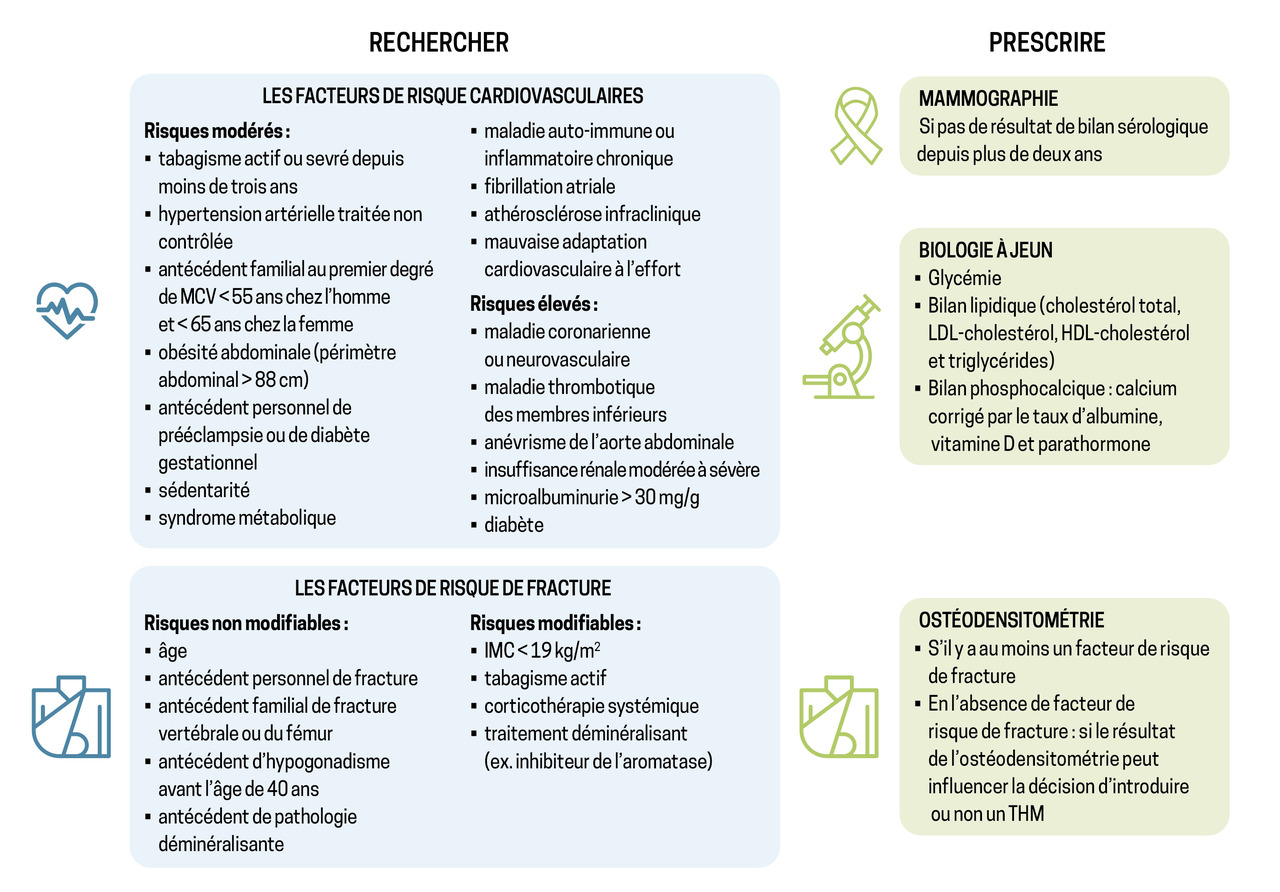
Assurer un suivi régulier des patientes ménopausées permet de prévenir et détecter précocement toute situation pouvant mener à une morbi-mortalité induite ou favorisée par le manque d’œstrogènes et l’âge. La fig. 1 reprend la liste des points indispensables à évaluer lors de la première consultation d’une patiente ménopausée. Ce bilan, essentiel et à répéter, doit précéder toute décision de prescrire un traitement hormonal de la ménopause (THM), dont l’indication repose exclusivement sur la balance bénéfices-risques propre à chaque patiente. Bien entendu, cette décision de traiter doit toujours être prise en concertation avec une patiente dûment éclairée.3
Des risques spécifiques aux femmes ménopausées
Ostéoporose : des fractures affectant l’autonomie
Le manque d’œstrogènes accentue le catabolisme osseux. En conséquence, l’os se fragilise, initialement au niveau de l’os trabéculaire et secondairement au niveau de l’os cortical. L’ostéoporose est un phénomène silencieux, souvent révélé par la survenue d’une fracture. Les fractures vertébrales sont les plus précoces et les plus fréquentes. Elles peuvent être asymptomatiques, en dehors de la perte staturale qu’elles entraînent. Leur impact sur le syndrome restrictif pulmonaire est souvent mal estimé. L’incidence des fractures du poignet et de la hanche augmente proportionnellement avec le nombre d’années suivant la ménopause, et on estime que, à l’âge de 80 ans, 15 % des femmes ont eu une fracture de la hanche. Cette fracture est source de morbidité importante : la moitié des patientes qui étaient autonomes avant la fracture ne le sont plus après. Si la mortalité reste élevée (12 à 37 % au cours de la première année qui suit la fracture), elle apparaît cependant en baisse.4
Déclin cognitif ?
Certaines études suggèrent la survenue, à la ménopause, d’un déclin cognitif (mémoire et concentration notamment) proportionnel au taux d’œstradiol résiduel. Cette hypothèse n’a toutefois pas été démontrée dans les analyses de cohortes.
Maladies cardiovasculaires, première cause de décès chez la femme ménopausée
Il est établi qu’avant la ménopause, les femmes sont moins affectées par les maladies cardiovasculaires (MCV) que les hommes du même âge. Il est aussi démontré que, dans les dix années qui suivent la ménopause, l’incidence des MCV augmente chez les femmes, pour égaler celle des hommes, et devient même la première cause de mortalité des femmes, devant le cancer du sein.
Ces données épidémiologiques constituent le fondement de l’hypothèse selon laquelle les œstrogènes ont une action protectrice contre le développement de l’athérosclérose. Ce phénomène a largement été étudié au cours du demi-siècle dernier.
Le premier constat est que la ménopause modifie profondément le profil métabolique : fréquente prise de poids avec redistribution des graisses au profit de l’abdomen et des viscères, installation d’une plus grande résistance à l’insuline et altération du bilan lipidique (augmentations du cholestérol total, du cholestérol à lipoprotéines de faible densité et des triglycérides). Au niveau moléculaire, de nombreuses études fondamentales et animales ont montré le rôle vasculoprotecteur des œstrogènes, qui favorisent la fonction endothéliale – principalement en augmentant la production d’oxyde nitrique, un puissant vasodilatateur reconnu pour ses propriétés antiathérogènes –, diminuent l’inflammation et exercent une activité antioxydante.
Partant de ces constats, il semblait évident que remplacer les œstrogènes chez les femmes ménopausées allait les protéger contre les MCV et ainsi prolonger leur espérance de vie. Les traitements hormonaux de la ménopause (THM) ont donc été largement prescrits dans ce but cardioprotecteur dans les années 1980.
Plusieurs études publiées au début du XXIe siècle ont cependant suggéré une absence d’effet protecteur, voire une augmentation du risque cardiovasculaire, notamment l’étude WHI (étude de cohorte randomisée en double aveugle), très critiquée car le traitement était donné à des patientes de 63 ans en moyenne, donc à distance de la ménopause. Les analyses en sous-groupe d’âge ont permis de suggérer une fenêtre d’intervention dans les dix premières années de la ménopause.
Au terme d’interminables débats, de réanalyse des résultats, d’acquisition de nouvelles données épidémiologiques, il reste difficile de trancher. Le consensus actuel est que le THM ne peut être administré dans un unique but de protection cardiovasculaire.
Bénéfices et risques démontrés du THM
La fig. 2 recense les bénéfices et risques attribués au THM sur la base des données les plus récentes.5 Les bénéfices sur la qualité de vie et la santé osseuse sont largement démontrés et connus, mais ne sont pas détaillés ici.
Cinq risques décrits peuvent être modulés en fonction des modalités de traitement : cancer de l’endomètre en cas d’administration d’œstrogènes seuls, cancer du sein en cas d’utilisation de progestatifs de synthèse, maladie thrombo-embolique veineuse en cas d’utilisation d’œstrogènes oraux, AVC et infarctus du myocarde en cas d’utilisation trop tardive dans la ménopause ou chez des femmes à risque, et en fonction des molécules et voies d’administration.
Hyperplasie endométriale et cancer de l’endomètre
Les œstrogènes administrés par voie orale ou transcutanée exercent une action proliférative sur l’endomètre, pouvant aboutir à un état précancéreux (hyperplasie endométriale), voire cancéreux, se traduisant généralement par des saignements utérins, toujours anormaux après la ménopause. Il est donc indispensable d’associer un traitement progestatif aux œstrogènes chez les patientes non hystérectomisées afin de contrecarrer cette action proliférative, même si la patiente a subi une endométrectomie, car celle-ci n’est jamais complète. Ce progestatif peut être administré de façon continue ou séquentielle, sachant qu’un minimum de douze jours par mois est requis pour assurer une protection optimale de l’endomètre. Le choix revient à la patiente : en optant pour la prise continue du progestatif, elle n’aura pas de saignement tandis que la prise séquentielle est souvent accompagnée d’une hémorragie de privation au moment de l’arrêt du progestatif.
À noter que les œstrogènes utilisés par voie vaginale (ovule ou crème) n’exercent pas d’effet endométrial significatif et peuvent donc être administrés seuls.
Cancer du sein
Administrés pendant moins de dix ans, les œstrogènes seuls ne semblent pas augmenter le risque de cancer du sein chez les femmes ménopausées. Le sur-risque, quoique modeste, puisqu’il s’agit de 3 cas de cancer du sein supplémentaires pour 1 000 patientes au-delà de cinq ans d’utilisation, a été constaté aux États-Unis en cas de THM combiné utilisant l’acétate de médroxyprogestérone – un progestatif de synthèse non commercialisé en France. Un sur-risque a également été démontré avec les autres progestatifs de synthèse, actuellement inusités en post-ménopause en raison du risque de méningiome.
A contrario, les progestatifs généralement utilisés en France pour la ménopause, à savoir la progestérone naturelle ou son dérivé, la dydrogestérone, n’ont jusqu’à présent pas été associés à une augmentation du risque de cancer du sein. Toutefois, la plus grande prudence reste de mise : les œstrogènes exogènes sous toutes leurs formes sont formellement contre-indiqués en cas d’antécédent de cancer hormonodépendant (sein, ovaire, endomètre).
Maladie thrombo-embolique veineuse
Le risque de développer une maladie thrombo-embolique veineuse (MTEV) [thrombose veineuse profonde et embolie pulmonaire] est approximativement doublé avec un œstrogène pris par voie orale. Ce risque devient particulièrement important si la patiente a des facteurs prédisposants, à savoir une obésité, des antécédents personnels de MTEV ou une mutation génétique thrombophilique.
Aucune étude n’a démontré d’augmentation du risque de MTEV lorsque les œstrogènes sont administrés par voie transcutanée, même chez les patientes avec des facteurs de risque de MTEV. Les progestatifs utilisés en France n’augmentent pas non plus le risque, à l’inverse de l’acétate de médroxyprogestérone commercialisé aux États-Unis, ou autres progestatifs de synthèse.
Accident vasculaire cérébral
Les œstrogènes per os augmentent modérément mais significativement le risque d’accident vasculaire cérébral (AVC) de manière dose-dépendante. L’addition d’un progestatif ne modifie pas cet accroissement de risque, qui semble donc bien être lié exclusivement à l’œstrogène.
Administrés par voie transcutanée à faible dose, les œstrogènes ne sont, en revanche, pas associés à une augmentation du risque d’AVC.
Infarctus du myocarde
Le risque d’infarctus du myocarde (IDM) attribué au THM est celui qui fait le plus débat dans la littérature. Sur la base des connaissances actuelles, il semble raisonnable de noter que, lorsque le THM est débuté dans les dix premières années de la ménopause (généralement entre 50 et 59 ans), le risque d’IDM est identique, voire moindre, que celui de la population générale du même âge. À l’inverse, instaurer un THM lorsque la ménopause a débuté depuis plus de quinze ans expose la patiente à un risque accru d’IDM. En l’occurrence, ni la voie d’administration des œstrogènes ni l’adjonction d’un progestatif n’est protecteur.
Prise en charge symptomatique et préventive
Ne pas sous-estimer les mesures hygiénodiététiques
Les modifications d’hygiène de vie permettent de gérer à la fois certains symptômes de la ménopause et les risques osseux, cardiovasculaires et cancérigènes. Elles sont proposées à toute femme ménopausée, de façon adaptée à son état de santé, que la décision de traitement hormonal soit prise ou non.
Bouger…
Le premier volet concerne l’activité physique et consiste, non seulement à mettre en place une activité physique régulière, mais aussi à limiter la sédentarité. Ces deux composantes ont un impact sur la qualité de vie en général, sur le risque cardio- et cérébrovasculaire, cancérigène et osseux, et sur la composition corporelle.
Les recommandations internationales d’activité physique (AP) liées à l’âge comportent la pratique d’une AP régulière d’au moins 150 minutes par semaine d’intensité modérée ou 75 minutes d’AP de forte intensité et deux séances par semaine de renforcement musculaire.6
… pour minorer le risque de maladies cardiovasculaires
Comme l’indique le rapport de l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (Anses), il existe une relation inverse entre le niveau d’AP et la mortalité d’origine cardiovasculaire, principale cause de mortalité chez les femmes en post-ménopause.7 Un niveau élevé d’AP permet de réduire de 30 % le risque de décès. Un faible niveau d’AP (15 minutes d’AP d’intensité modérée par jour) permet de réduire de 20 % la mortalité d’origine cardiovasculaire, comparativement à celle de sujets très inactifs.
Au-delà de l’activité physique, la sédentarité a un impact négatif sur la santé cardiovasculaire. Le temps total quotidien passé en position assise est corrélé à l’incidence des maladies cardiovasculaires. Rester plus de sept heures par jour en position assise devant un écran de télévision augmente de 85 % la mortalité d’origine cardiovasculaire, comparativement à une heure par jour. Chez des sujets inactifs, le temps passé en position debout peut réduire jusqu’à 20 à 30 % le risque de décès d’origine cardiovasculaire. Seule la pratique d’une AP d’intensité élevée serait susceptible de minorer les effets de la sédentarité sur l’incidence des maladies cardiovasculaires.7
… pour améliorer le capital osseux
Concernant le risque de fracture, les exercices combinés associant exercices en charge avec impacts aléatoires et de forte intensité (course à pied, saut, danse, exercices sur plateforme de vibration, montée et descente des escaliers…), associés à du renforcement musculaire (3 sessions de 30 à 60 minutes par semaine) sont les plus efficaces pour préserver/augmenter la densité minérale osseuse au niveau du rachis, du col fémoral, du trochanter et de la hanche chez la femme ménopausée, tout en diminuant le risque de fractures.6
... pour améliorer la corpulence
Enfin, concernant l’impact sur la composition corporelle, une méta-analyse montre que l’augmentation de masse grasse totale observée entre les femmes non ménopausées et celles qui le sont est liée à l’âge, sans effet direct de la ménopause.8 En revanche, la ménopause induit des modifications de la répartition de la masse grasse, avec une augmentation de la masse grasse viscérale et une diminution de la masse grasse des jambes.
Avant de recommander une activité physique, certaines précautions doivent être respectées (progressivité, régularité, adaptation à chaque personne), la principale étant vis-à-vis du risque cardiovasculaire. En l’absence de pathologie connue, la marche ou le vélo d’intensité faible à modérée peuvent être débutés sans avis médical, à adapter en fonction de l’âge.
Hygiène alimentaire : réduire les sucres, privilégier les fibres
Sur le plan nutritionnel, les impacts principaux concernent le contrôle du poids et des facteurs de risque cardiovasculaires ainsi que la prévention de l’ostéoporose.9 Depuis 2001, les recommandations sont extraites du Programme national nutrition santé, régulièrement mis à jour. La prévention du surpoids passe surtout par une balance énergétique équilibrée grâce à une activité physique régulière et une lutte contre la sédentarité.
Les principes généraux reposent sur la modération des apports excessifs en aliments sucrés, le choix d’aliments à indice glycémique faible et riches en fibres (féculents complets, fruits frais et légumes secs) et un apport élevé en fruits et légumes (400 à 500 g/j), crus et cuits, en modérant les jus de fruits, à confectionner sans sucre à la maison. Les apports journaliers recommandés en calcium sont de 1 200 mg/j et les apports en vitamine D de 600 UI (ou 15 μg)/j.
Les régimes excessifs sont déconseillés, car sources de reprise de poids rapide, ainsi que les régimes exclusifs sans justification médicale (sans gluten, par exemple). Enfin, le sevrage tabagique et la limitation de la consommation alcoolique sont recommandés et, si besoin, accompagnés.
Traitements non hormonaux contre les symptômes vasomoteurs
En permettant une diminution moyenne de 80 % des bouffées de chaleur dans les trois mois qui suivent le début du traitement, le THM administré par voie systémique (orale ou transcutanée) est actuellement le traitement le plus efficace du syndrome climatérique.
Une seule molécule a l’AMM en France
Le véritable défi est en réalité de soulager les bouffées de chaleur des patientes chez qui les œstrogènes sont contre-indiqués, par exemple après un cancer du sein. Les traitements non hormonaux qui ont démontré une certaine efficacité sont notamment les antidépresseurs de type inhibiteur sélectif de la recapture de la sérotonine ou inhibiteur de la recapture de la sérotonine et de la noradrénaline, la gabapentine et l’oxybutynine.
En France, la bêta-alanine est le seul traitement non hormonal à avoir une autorisation de mise sur le marché (AMM) pour le traitement des bouffées de chaleur, mais son efficacité n’est pas démontrée.
Le tableau reprend les posologies couramment utilisées pour ces traitements non hormonaux.10 D’une manière générale, les doses les plus faibles sont associées à des effets indésirables moindres et doivent être utilisées en première intention.
Approches non pharmacologiques utiles
En parallèle, yoga, hypnose ou thérapie comportementale sont également efficaces pour diminuer la fréquence des bouffées de chaleur, avec un avantage non négligeable : l’absence d’effets indésirables et de contre-indications.10
Il serait certainement utile de comparer ces approches non pharmacologiques avec les traitements pharmacologiques.
De nouvelles molécules en perspective ?
La recherche a récemment mis en évidence un impact du système hypophysaire-kisspeptine dans l’origine des bouffées de chaleur. Cette découverte a conduit au développement de nouvelles molécules telles que les antagonistes du récepteur de la neurokinine 3. Ils ont déjà été testés avec succès chez les patientes ménopausées indemnes de cancer. Des études sont en cours chez les patientes guéries du cancer du sein sous hormonothérapie, dont les résultats semblent être prometteurs.
Traitement du syndrome génito-urinaire : d’abord local
Le traitement des symptômes génito-urinaires est local, avec, en première ligne, l’utilisation de lubrifiants ou d’hydratants d’application vulvovaginale. Les préparations contenant de l’acide hyaluronique s’avèrent utiles dans cette indication.
Si ces traitements non hormonaux ne suffisent pas, on peut y associer un traitement par œstradiol vaginal ou DHEA vaginale. Ces traitements hormonaux locaux ne sont pas recommandés chez les patientes ayant souffert d’un cancer du sein, mais aucune étude n’a démontré d’augmentation des récidives avec ces traitements ; en conséquence, plusieurs sociétés gynécologiques les autorisent désormais chez les patientes guéries.11
Préserver le capital osseux
La première étape de la prévention de l’ostéoporose repose sur un bon équilibre phosphocalcique. Une supplémentation orale en calcium peut être introduite si, après analyse alimentaire, il semble évident que la patiente consomme moins de 1 200 mg de calcium au quotidien. Un dosage sanguin de la vitamine D est recommandé lors du bilan de base et un apport oral régulier est souvent nécessaire afin de maintenir un taux satisfaisant.
Le THM est excellent pour restaurer la masse osseuse à la ménopause : après douze à dix-huit mois de traitement, la densité osseuse revient à des valeurs de pré-ménopause. Ceci se traduit cliniquement par une diminution d’environ 35 % du risque de fracture de vertèbres, du fémur et du poignet. Cette protection osseuse est telle que, chez une patiente souffrant par ailleurs de bouffées de chaleur invalidantes, le THM devrait être introduit en s’assurant, bien entendu, au préalable que ses bénéfices dépassent les risques. Dans le cas où le THM n’est pas indiqué, ou après arrêt de ce dernier, un suivi régulier de la densité osseuse s’impose (idéalement tous les cinq ans). En cas d’apparition d’anomalies, la patiente peut être dirigée vers un rhumatologue en fonction de ses antécédents de fracture éventuels et de son T score, afin d’évaluer l’intérêt d’un traitement ostéoprotecteur non hormonal.
Miser sur la médecine préventive
La prévention est un objectif ultime de la médecine et elle se décline de très nombreuses façons. Prendre en charge la ménopause plutôt que la traiter, dès lors qu’il ne s’agit pas d’une maladie, appartient à la médecine préventive, avec toutefois des spécificités et la possibilité de la personnaliser. L’art du clinicien est toujours d’appliquer aux patientes des recommandations (guidelines) établies sur une base de populations de patientes.
Perspectives
Les perspectives pour la prise en charge de la ménopause sont fondées, tout d’abord, sur une meilleure connaissance des moyens de prévention, des marqueurs prédictifs des risques qui grèvent l’espérance de vie des femmes, au premier rang desquels le risque cardiovasculaire. La définition des seuils des marqueurs actuellement connus est évolutive, et la connaissance de ces marqueurs chez les soignants doit être actualisée. De même, le niveau d’éducation des femmes concernant la prévention cardiovasculaire reste insuffisant : en témoigne la persistance d’un tabagisme non négligeable par exemple. Cette prévention se situe très longtemps en amont de la ménopause en théorie, ce qui la rend d’autant plus difficile à appliquer. Enfin, la définition du niveau de risque de chaque femme est encore incomplète, et ce type d’action bénéficiera à l’avenir des progrès de l’intelligence artificielle et des outils de diagnostic et de surveillance.
Les aspects neurocognitifs de la ménopause et leur prise en charge sont un autre vaste sujet de recherche.
Les stratégies non hormonales de prise en charge du syndrome génito-urinaire telles que la phytothérapie, la médecine chinoise et les méthodes physiques pourraient également élargir la palette d’outils à disposition du clinicien.
Les progrès thérapeutiques de prise en charge médicamenteuse des symptômes du climatère sont un autre axe de progrès, incluant les modulateurs du système kisspeptine-neurokinine-dynorphine précédemment évoqués.
Le développement d’œstrogènes potentiellement mieux tolérés sur le plan vasculaire et mammaire est également en cours, comme l’œstétrol, un œstrogène fœtal.
Enfin, la recherche en sciences humaines et sociales, permettant une meilleure compréhension du statut des femmes ménopausées, est un autre aspect important de l’avenir.
Que dire à vos patientes ?
La ménopause est un événement physiologique. Les femmes passent près de 40 % de leur vie en état de ménopause, et leur qualité de vie peut être très altérée par un cortège de symptômes et d’affections qui dépassent largement la seule sphère gynécologique.
La prise d’une contraception hormonale peut masquer la transition ménopausique. Pour affirmer le diagnostic de ménopause après une hystérectomie, une endométrectomie ou en cas de dispositif intra-utérin au lévonorgestrel, il convient de réaliser un dosage hormonal (œstradiol et FSH).
Certains risques sont spécifiques des femmes ménopausées, parmi lesquels l’ostéoporose, le risque de fracture associé et les maladies cardiovasculaires.
Les bénéfices d’un traitement hormonal sont largement démontrés et connus ; mais les risques associés (cancers de l’endomètre et du sein, maladie thromboembolique veineuse, accidents vasculaires cérébraux et infarctus du myocarde) peuvent être modulés en fonction des modalités de traitement.
2. Freeman EW, Sammel MD, Lin H, et al. Associations of hormones and menopausal status with depressed mood in women with no history of depression. Arch Gen Psychiatry 2006;63(4):375-82.
3. Tremollieres FA, Chabbert-Buffet N, Plu-Bureau G, et al. Management of postmenopausal women: College national des gynecologues et obstetriciens francais (CNGOF) and Groupe d’etude sur la menopause et le vieillissement (GEMVi) Clinical Practice Guidelines. Maturitas 2022;163:62-81.
4. Brauer CA, Coca-Perraillon M, Cutler DM, et al. Incidence and mortality of hip fractures in the United States. JAMA 2009;302(14):1573-9.
5. Martin KA. Menopausal hormone therapy: Benefits and risks: UpToDate in Waltham, MA; 2023.
6. Duclos M. Effects of physical activity and decreased sedentary behaviours in menopausal women. Postmenopausal women management: CNGOF and GEMVi clinical practice guidelines. Gynecol Obstet Fertil Senol 2021;49(5):335-48.
7. Anses. Avis de l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail relatif à l’actualisation des repères alimentaires du PNNS pour les femmes dès la ménopause et les hommes de plus de 65 ans. 2019.
8. Ambikairajah A, Walsh E, Tabatabaei-Jafari H, et al. Fat mass changes during menopause: a meta-analysis. Am J Obstet Gynecol 2019;221(5):393-409 e50.
9. Lecerf JM. Nutritional advices for postmenopausal woman. Postmenopausal women management: CNGOF and GEMVi clinical practice guidelines. Gynecol Obstet Fertil Senol 2021;49(5):349-57.
10. Raccah-Tebeka B, Boutet G, Plu-Bureau G. Non-hormonal alternatives for the management of menopausal hot flushes. Postmenopausal women management: CNGOF and GEMVi clinical practice guidelines. Gynecol Obstet Fertil Senol 2021;49(5):373-93.
11. ACOG Committee Opinion No. 659: The Use of Vaginal Estrogen in Women With a History of Estrogen-Dependent Breast Cancer. Obstet Gynecol 2016;127(3):e93-e6.

 Encadrés
Encadrés