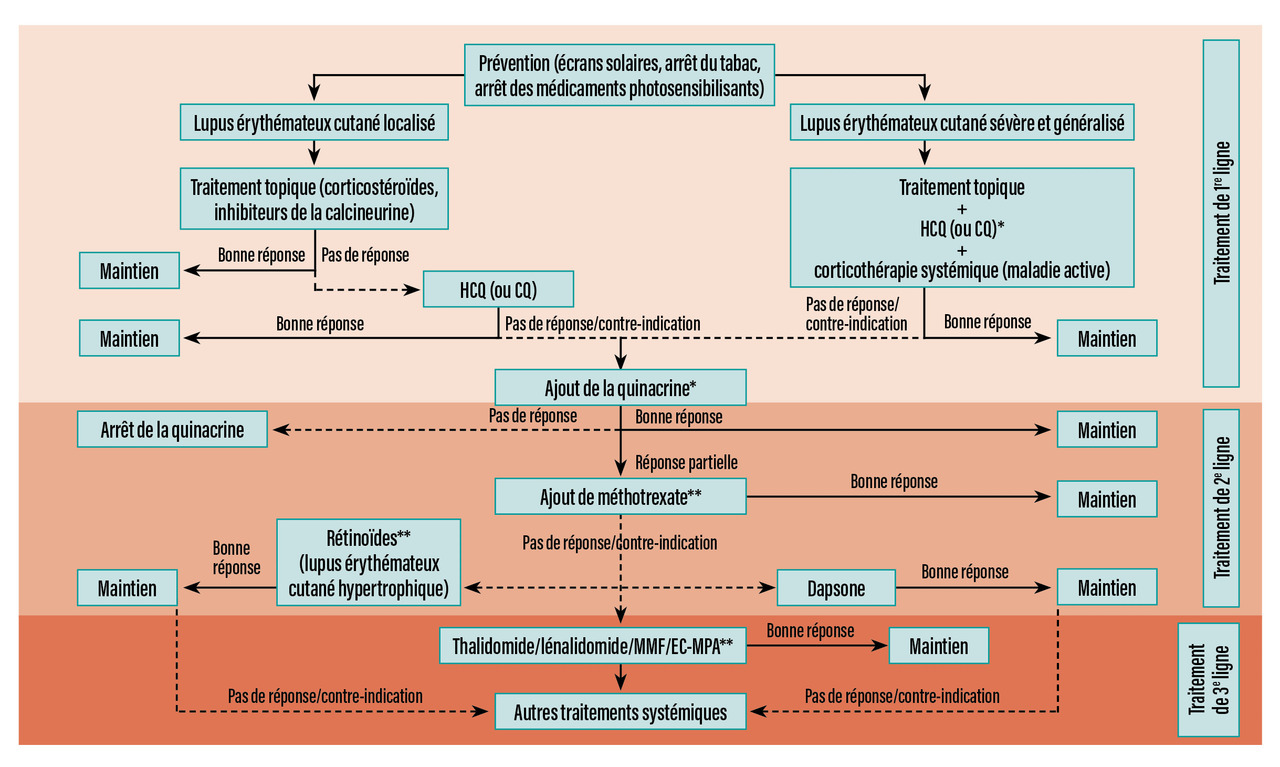
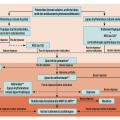
La prise en charge du lupus cutané selon un consensus d’experts européens est résumée dans la figure 1.1 Les molécules recommandées dans le protocole national de diagnostic et de soins (PNDS) du lupus systémique pour l’atteinte cutanée sont présentées dans le tableau 1. Les règles de prévention sont essentielles, en particulier la photoprotection et l’arrêt du tabac. Un médicament inducteur doit être suspecté en cas de lupus subaigu (jusqu’à 30 % des cas), en particulier chez le sujet âgé. Les traitements topiques comprennent les dermocorticoïdes et le tacrolimus – préféré pour le visage. Les antipaludéens de synthèse (APS), en particulier l’hydroxychloroquine (HCQ), sont efficaces dans environ 66 % des cas.2
Antipaludéens de synthèse, pierre angulaire du traitement
Les antipaludéens de synthèse, en particulier l’hydroxychloroquine, constituent la pierre angulaire du traitement du lupus cutané isolé ou du lupus systémique. L’hydroxychloroquine a une autorisation de mise sur le marché (AMM) dans ces deux indications. Les spécialités de chloroquine ne sont plus commercialisées depuis septembre 2022. Toutefois, il est possible de prescrire une préparation magistrale remboursable (PMR) : 2 gélules de 160 mg de phosphate de chloroquine (correspondant à 100 mg de chloroquine base). L’efficacité des APS est évaluée à trois mois environ. En cas d’inefficacité, le dosage sanguin d’HCQ permet d’évaluer la non-adhésion si la concentration est inférieure à 200 ng/mL. Par ailleurs, un dosage supérieur à 750 ng/mL est associé à une meilleure réponse thérapeutique.3 En cas d’échec d’une première ligne d’APS, le switch de l’HCQ vers la chloroquine (CQ) ou inversement permet une amélioration dans plus de 50 % des cas, mais elle est le plus souvent transitoire.4
Informer pour optimiser l’observance et limiter les effets indésirables
Le résumé des caractéristiques du produit (RCP) de l’HCQ a été modifié en 2019, avec en particulier l’ajout sur la boîte du pictogramme « grossesse = danger ». De plus, une communication de l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) a rapporté un risque de malformation pendant la grossesse sous HCQ et l’épidémie de Covid- 19 a rendu célèbre l’hydroxychloroquine. Tous ces éléments rendent l’information des patients avant la prescription encore plus importante qu’auparavant. Afin d’améliorer l’information, des fiches de synthèse ont été réalisées conjointement avec les Sociétés françaises de dermatologie (SFD), rhumatologie (SFR), médecine interne (SNFMI), sous l’égide de la filière de santé des maladies auto-immunes et inflammatoires rares (FAI2R). Ces recommandations ont été publiées fin 2021 et sont accessibles en français (http ://www.cri-net.com/fiches-pratiques-et-eSessions/dernieres-mises-a-jour/hydroxychloroquine).5
Le tableau 2 résume les modalités pratiques de prescription de l’HCQ. Les rétinopathies sont l’effet indésirable le plus important, car pouvant entraîner une cécité ; les recommandations de l’Association américaine d’ophtalmologie ont été mises à jour en 2021 et sont résumées dans le tableau 3.6 À l’initiation du traitement, il est vraiment essentiel d’expliquer au patient que les tests ophtalmologiques sont capables de dépister une maculopathie préclinique et qu’il n’y a aucun risque d’altération de la vision en cas de respect d’un suivi annuel après les cinq premières années de traitement.
Diminuer, voire arrêter, le traitement en cas de rémission cutanée ?
Les patients demandent souvent s’il est possible de diminuer la dose, voire d’arrêter l’HCQ en cas de rémission dans le lupus cutané. Deux études se sont récemment intéressées à ce sujet.
Dans une première étude, 56 patients avec un lupus cutané en rémission ont bénéficié d’une diminution de dose ou d’un arrêt complet avec un suivi supérieur à six mois. Parmi les 39 patients en arrêt complet, une rechute a été observée chez 56 % d’entre eux, avec une durée médiane de suivi de 3,6 ans. Néanmoins, 80 % des patients avaient toujours une dose diminuée ou un arrêt de traitement, suggérant que cette stratégie est possible. La stratégie saisonnière (diminution ou arrêt l’hiver) semblait associée à une diminution des rechutes même si ce résultat n’était pas significatif.7
Une large étude cas-témoins sur le lupus systémique incluant 1 460 patients ayant reçu de l’hydroxychloroquine a évalué le risque de poussée de lupus après la diminution ou l’arrêt. Le risque de poussée était augmenté de 20 % en cas de diminution de doses et de 56 % en cas d’arrêt. Un faible niveau socio-économique et la prise de corticoïdes par voie générale étaient également associés au risque de poussée. La plupart des causes d’arrêt ou de diminution de doses n’étaient pas liée à la rémission, ce qui a rendu difficile l’interprétation de cette étude. Cependant, des analyses en sous-groupes ont suggéré des résultats similaires chez les patients en rémission mais avec un nombre faible de malades. Ces résultats indiquent donc que cette stratégie de diminution de dose doit être réfléchie dans le lupus systémique au cas par cas, plutôt chez des lupus en rémission prolongée, en informant le patient du risque de rechute.
Lupus induits médicamenteux, des molécules variées en cause
Comme dans le lupus « classique », les lupus induits par des médicaments peuvent être divisés en lupus systémiques et lupus cutanés induits. Dans le lupus systémique induit, l’atteinte cutanée est classiquement non spécifique : éruptions maculo-papuleuses ou purpuras vasculaires. Seuls les anti-TNF (tumor necrosis factor) alpha sont associés au développement de lésions de lupus cutanés spécifiques subaiguës et parfois discoïdes.
En utilisant la base de pharmacovigilance de l’Organisation mondiale de la santé (VigiBase), en 2019, Arnaud et al. ont identifié 118 médicaments avec un signal de pharmacovigilance (IC025 ≥ 0) pour le lupus systémique dont 42 jamais décrits.8 Parmi ces médicaments, les anti-TNF alpha représentent la grande majorité des médicaments responsables. On note également des signaux pharmacologiques forts pour la minocycline, l’acébutolol, le labétolol, le propylthiouracile, la terbinafine, la sulfasalazine et la carbamazépine.
Dans une étude plus récente, le même groupe a utilisé la même méthode dans le lupus cutané et a relevé 94 médicaments avec un signal de pharmacovigilance.9 1 994 médicaments avec les signaux les plus forts et/ou le plus grand nombre de cas sont répertoriés (tableau 4) et on remarque qu’outre la terbinafine, bien connue pour être un inducteur de lupus subaigu, les anti-TNF et surtout les inhibiteurs de la pompe à protons (IPP) sont les médicaments les plus souvent associés au risque de lupus cutanés induits (fig. 2).
Formes réfractaires : quelles options thérapeutiques en pratique ?
Plusieurs paramètres influencent les choix thérapeutiques, qui restent aujourd’hui limités et reposent sur de faibles niveaux de preuve. Les facteurs à prendre en compte sont les suivants : association avec un lupus systémique et les organes atteints ; sous-type de lupus, en particulier le risque cicatriciel, qui peut être une urgence thérapeutique ; projet de grossesse et, bien sûr, choix du patient et adhésion thérapeutique.
Méthotrexate
Dans les lupus cutanés isolés sans haut risque cicatriciel, le méthotrexate est recommandé (hors AMM) comme traitement de seconde ligne préférentiel malgré un niveau de preuve très faible, limité à un essai contrôlé randomisé de très faible effectif contre chloroquine.10 Peuvent également se discuter les rétinoïdes ou la dapsone, en particulier en cas de désir de grossesse ou en cas de lupus bulleux neutrophilique.
Le mycophénolate mofétil (MMF) est volontiers utilisé aux États-Unis, moins en Europe en l’absence d’atteinte systémique, de même que l’azathioprine, qui peut être prescrite en cas de lupus systémique associé ou de désir de grossesse (rarement utilisée en France). Une étude européenne a évalué molécule par molécule le taux de réponse partielle à ces différents traitements11, les résultats sont résumés dans le tableau 5.
Thalidomide et lénalidomide
Le thalidomide est probablement le traitement le plus efficace dans le lupus cutané, avec un taux de réponse partielle d’environ 90 % quels que soient les sous-types. Néanmoins, son efficacité est contrebalancée par le risque d’effets indésirables, en particulier les neuropathies périphériques et les événements thromboemboliques.12 En France, il dispose d’une recommandation temporaire d’utilisation (RTU) depuis 2015. Comme le méthotrexate, il est recommandé dans le PNDS en deuxième ligne de traitement, surtout à haut risque cicatriciel. En pratique, une dose initiale de 50 mg/j plutôt que 100 mg/j semble associée à un meilleur rapport efficacité/tolérance. Dans la pratique, l’aspirine à visée antiagrégante plaquettaire pour la prévention des thromboses est ajoutée systématiquement sans efficacité démontrée. Après amélioration, il faut diminuer progressivement la dose jusqu’à 50 mg 2 ou 3 fois par semaine pour éviter les rechutes. À ces doses faibles, il ne semble pas y avoir de risque de neuropathie.
Le lénalidomide a montré d’excellents résultats dans des séries de cas à la dose de 5 mg/j, avec des taux de réponse proches de 90 %. Aucun cas d’apparition ou d’aggravation de neuropathie n’a été rapporté avec ce médicament à la dose de 5 mg/j.13 Cependant, le lénalidomide doit être initié par un hématologue ou un spécialiste des maladies du sang et ce traitement doit donc être discuté soigneusement en réunion de concertation pluridisciplinaire (RCP) lupus.
Le thalidomide, comme le lénalidomide, n’a aucune efficacité sur la part systémique du lupus en dehors de l’atteinte cutanée.
Bélimumab
Dans les lupus cutanés avec atteintes systémiques associées, le bélimumab (anticorps monoclonal anti-BAFF) a une AMM dans le lupus systémique depuis 2011. Son utilisation est réservée aux lupus systémiques actifs en échec de traitement. Dans les essais de phase III, des analyses post-hoc ont montré que le bélimumab était efficace sur les symptômes dermatologiques.14 Cependant, les sous-types de lupus n’étaient pas évalués et il n’y avait pas de données sur le lupus discoïde.
Une étude récente a rapporté l’efficacité du bélimumab sur 16 cas de lupus discoïdes sévères en échec d’au moins trois lignes de traitement.15
À six mois, 50 % des patients avaient une amélioration significative de l’atteinte cutanée dont 3 patients avec un lupus cutané isolé. Cependant, à la fin du suivi, 15 patients sur 16 avaient arrêté le bélimumab pour rechute ou persistance d’activité suggérant une efficacité modérée dans les formes de lupus discoïde sévère.
Une forme sous-cutanée est maintenant disponible, plus simple d’utilisation que la forme intraveineuse. Le bélimumab par voie sous-cutanée est prescrit à la dose de 200 mg par semaine, les deux premières injections étant administrées en hôpital de jour.
Ce traitement est très bien toléré et a montré son efficacité récemment dans la néphropathie lupique, ce qui peut être intéressant pour les patients ayant à la fois une atteinte cutanée et une atteinte rénale actives.16
Anifrolumab
Une autre biothérapie a obtenu une AMM dans le lupus systémique : il s’agit de l’anifrolumab, un anticorps monoclonal dirigé contre le récepteur des interférons de type I (interferon-α/β receptor 1 [IFNAR]). Les interférons de type I, en particulier l’interféron alpha, jouent un rôle majeur dans la physiopathologie du lupus et en particulier du lupus cutané.
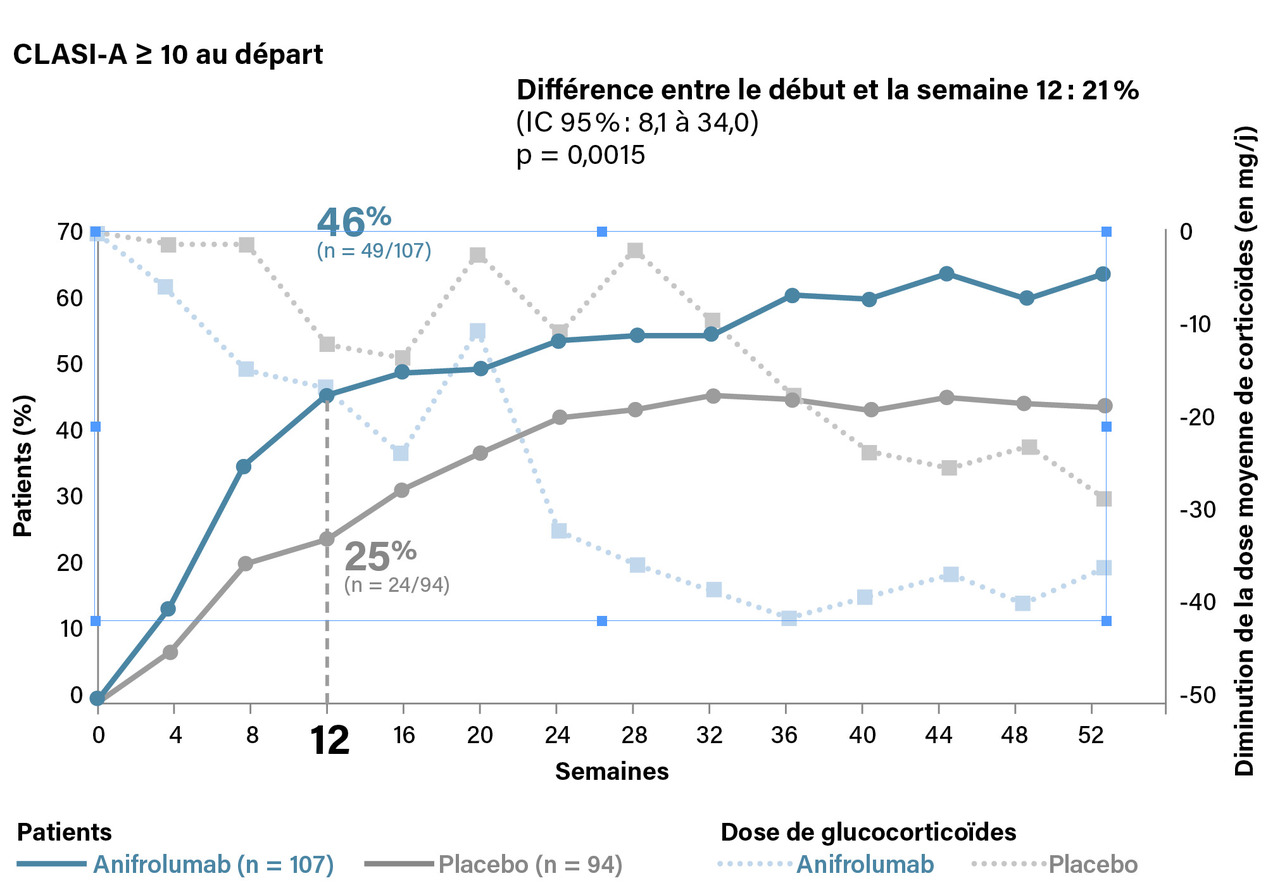
L’anifrolumab a été évalué dans deux essais de phase III, TULIP 1 et 2. TULIP 1 était une étude négative sur son critère de jugement principal, le SRI 4 (Systemic Lupus Erythematosus Responder Index : indice d’activité de la maladie) mais positive sur le BICLA (British Isles Lupus Assessment Group, une mesure globale validée de la réponse au traitement dans les essais cliniques sur le lupus érythémateux disséminé). Le BICLA est un critère évaluant l’amélioration partielle, contrairement au SRI, qui n’évalue que la réponse complète. Par ailleurs, TULIP 2 a montré des résultats positifs sur le BICLA, utilisé cette fois comme critère de jugement principal mais aussi sur le SRI 4.17 En ce qui concerne l’atteinte cutanée, l’amélioration de 50 % du CLASI (Cutaneous Lupus Erythematosus Disease Area and Severity Index) a été observée chez 25 % des patients dans le groupe placebo contre 49 % dans le groupe anifrolumab, chez les malades avec un CLASI ≥ 10 à baseline (fig. 3). Des analyses post-hoc ayant associé les résultats des deux études de phase III ont été publiées récemment, confirmant des données encourageantes, à la fois sur le BICLA et le SLEDAI (Systemic Lupus Erythematosus Disease Activity Index qui évalue l’activité lupique) concernant les atteintes cutanées et articulaires, en particulier en matière de rapidité sur l’amélioration des atteintes cutanées.
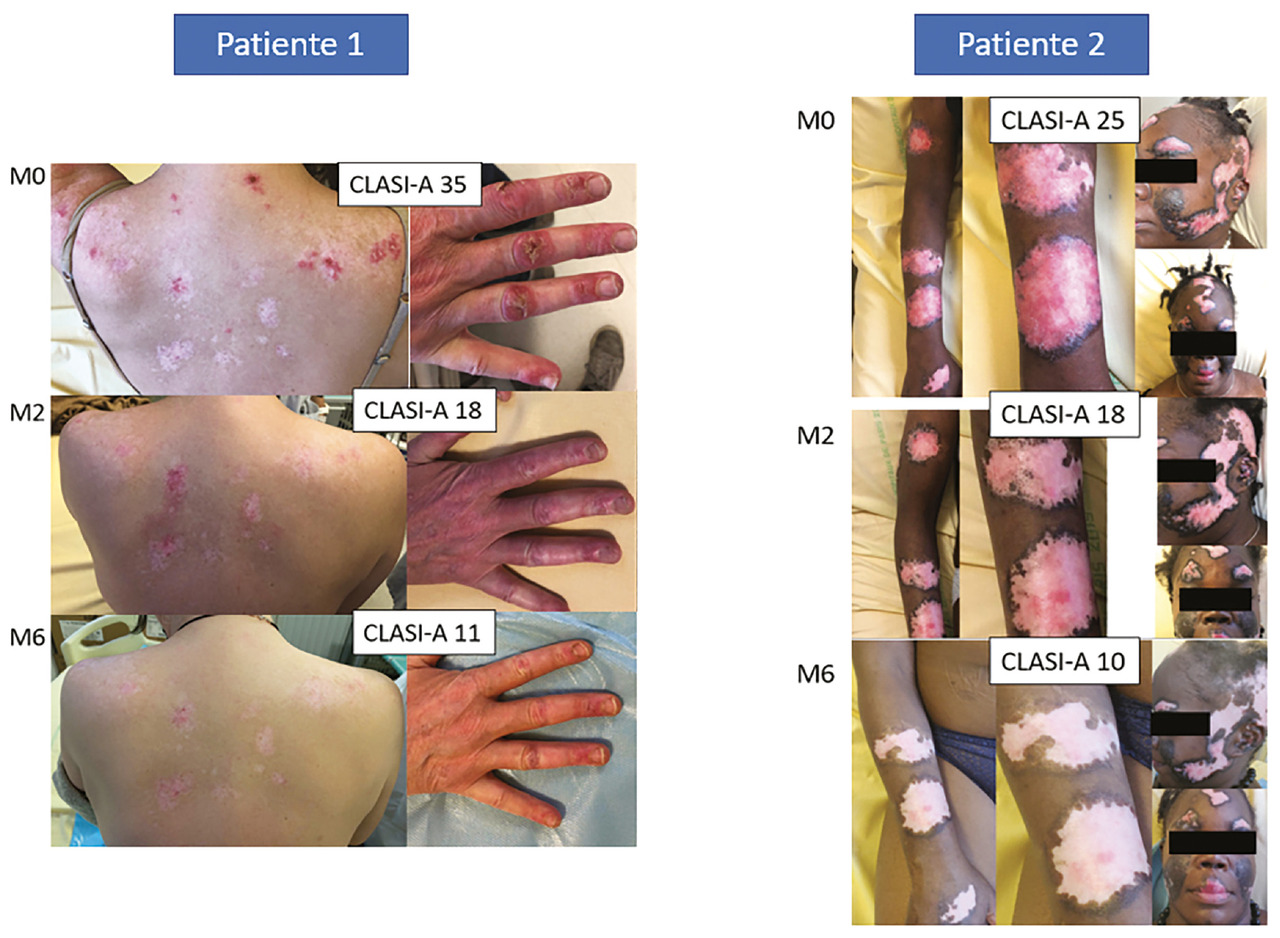
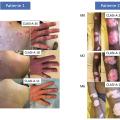
Une autorisation temporaire d’utilisation a été accordée à l’anifrolumab en France entre août 2021 et mai 2022 et a confirmé des résultats très encourageants sur l’atteinte cutanée réfractaire dans le lupus érythémateux systémique (fig. 4).18 Plusieurs autres séries de cas ont inclus un nombre limité de patients (de 7 à 10).19,20 L’anifrolumab a obtenu une AMM pour une utilisation par voie intraveineuse à la posologie de 300 mg mensuels ; il est réservé à l’usage hospitalier.
Les interférons de type I jouent un rôle majeur dans la réponse antivirale et, de façon attendue, il a été observé une augmentation du risque de zona et d’infection à SARS-CoV- 2 dans les études. Néanmoins, les données sont rassurantes après la vaccination anti-Covid et le risque de zona semble diminuer après un an de traitement.21 Le risque infectieux doit être surveillé et la mise à jour des vaccinations contre la grippe, le zona et le Covid- 19 doit être obligatoirement proposée.
Biothérapies et anti-JAK
En dehors du bélimumab, qui a une AMM dans le lupus systémique, de nombreuses biothérapies sont en cours d’évaluation dans le lupus cutané isolé ou systémique. Certaines molécules sont prometteuses ; d’autres, au contraire, ont donné récemment des résultats décevants.
Rituximab
Historiquement, la première biothérapie évaluée dans le lupus, le rituximab (anticorps monoclonal anti-CD20), n’a pas atteint les critères d’efficacité dans le lupus systémique ou dans la néphropathie lupique. Il reste souvent utilisé dans les atteintes hématologiques ou rénales réfractaires. Il peut être rarement utilisé dans les atteintes aiguës ou subaiguës mais n’a quasiment aucune efficacité dans les formes chroniques, en particulier le lupus discoïde.22
Ustékinumab
L’ustékinumab a une AMM dans le psoriasis, le rhumatisme psoriasique et les maladies inflammatoires chroniques de l’intestin. Cet anticorps monoclonal anti-IL- 12/23 a montré des résultats prometteurs en phase II, en particulier sur l’atteinte cutanée.23 Malheureusement, son développement a été arrêté après échec sur les critères de jugements intermédiaires en phase III.
Iberdomide
Une amélioration de la compréhension du mécanisme d’action du thalidomide et du lénalidomide a permis de mettre en évidence que ces molécules agissaient par le biais du complexe protéique Cereblon. Plus récemment, l’iberdomide (modulateur spécifique de Cereblon) a montré des résultats prometteurs dans le lupus systémique dans un essai de phase II. Les données de phase III seront nécessaires, en particulier pour valider son action sur l’atteinte cutanée.24
Baricitinib
Le baricitinib est un inhibiteur de JAK 1 et 2 qui a obtenu une AMM dans la polyarthrite rhumatoïde et la dermatite atopique. L’inhibition de JAK 1 et 2 bloque la signalisation des interférons de type I, de l’IL- 6 et de l’IL- 12/23, qui sont des cytokines clés dans le lupus systémique. Le baricitinib a montré des résultats encourageants dans l’atteinte cutanée et articulaire du lupus systémique dans un essai de phase II .25 Le développement du baricitinib a été arrêté dans le lupus systémique. En effet, le baricitinib a été évalué dans deux essais de phase III, SLE-BRAVE I et II, et seul l’un des deux essais a atteint son critère de jugement principal qui reposait sur le SRI 4.
Deucravacitinib
Le deucravacitinib inhibe spécifiquement la voie TYK 2 bien plus que les voies JAK 1, 2, 3. Il inhibe les interférons de type I et les cytokines IL- 12/23. Récemment, dans un essai de phase II ayant inclus 363 patients avec pour critère de jugement principal le SRI 4, le deucravacitinib aux doses de 3 mg deux fois par jour (58,2 %) et 6 mg deux fois par jour (49,5 %) a permis une amélioration supérieure au placebo (34,4 %). Les données sont également très prometteuses sur l’atteinte cutanée, avec une nette amélioration du CLASI par rapport au placebo.26 Un essai de phase III est lancé, et cette molécule est en cours d’évaluation dans le lupus cutané (phase II).
Litifilimab
Le litifilimab est un anticorps monoclonal anti-BDCA2 spécifique des cellules dendritiques plasmacytoïdes qui jouent un rôle important via la production d’interféron alpha dans le lupus. Dans une étude publiée en 2022,27 132 patients avec un lupus cutané, avec ou sans lupus systémique, ont reçu du litifilimab aux doses de 50, 150 et 450 mg par voie sous-cutanée tous les quinze jours. Le critère de jugement principal était la variation du score CLASI-A entre les différentes doses de litifilimab et le placebo à la semaine 16. Concernant le critère de jugement principal, à S16, il existait une amélioration de 14,5 % +/- 6,4 dans le groupe placebo. Par rapport au groupe placebo, il existait une amélioration de - 24,3 % (de - 43,7 à - 4,9) dans le groupe 50 mg de litifilimab, de - 33,4 % (de - 52,7 à - 14,1) dans le groupe 150 mg et de - 28 % (de - 44,6 à - 11,4) dans le groupe 450 mg. Ces résultats sont très prometteurs, et un essai de phase III débute ; les patients sont en cours d’inclusion.
Nombreuses molécules à l’étude
De nombreuses molécules sont en cours d’évaluation dans le traitement du lupus, avec des résultats prometteurs. Plusieurs médicaments sont actuellement évalués spécifiquement dans le lupus cutané avec plusieurs études en phase III (par exemple, l’anifrolumab spécifiquement pour le lupus cutané, anticorps monoclonal anti-BDCA2 qui inhibe les cellules dendritiques plasmacytoïdes). Le futur est donc prometteur.
À retenir
- Des recommandations françaises sur l’hydroxychloroquine ont été publiées en 2022. Le résumé de ces recommandations est accessible sur le site du Club rhumatismes et inflammations (CRI) : http ://www.cri-net.com/fiches-pratiques-et-eSessions/dernieres-mises-a-jour/hydroxychloroquine.
- En cas de rémission du lupus cutané, la diminution de la dose peut se discuter plutôt avec une stratégie saisonnière, voire un arrêt complet, mais une rechute s’observe dans environ 50 % des cas.
- Les anti-JAK avaient montré des résultats prometteurs dans le lupus systémique, en particulier sur l’atteinte cutanée. Néanmoins, le baricitinib a récemment donné des résultats décevants et son développement a été arrêté dans cette indication. D’autres molécules sont en cours de développement, avec des résultats encourageants (deucravacitinib, litifilimab, anifromumab).
- Une nouvelle biothérapie a obtenu une AMM en 2022 dans le lupus systémique après le bélimumab : il s’agit de l’anifrolumab, un anticorps monoclonal dirigé contre le récepteur des interférons de type I. Il a montré des résultats très prometteurs dans le lupus cutané associé à l’atteinte systémique.
2. Chasset F, Bouaziz JD, Costedoat-Chalumeau N, et al. Efficacy and comparison of antimalarials in cutaneous lupus erythematosus subtypes: A systematic review and meta-analysis. Br J Dermatol 2017;177(1):188-96.
3. Chasset F, Arnaud L, Costedoat-Chalumeau N, et al. The effect of increasing the dose of hydroxychloroquine (HCQ) in patients with refractory cutaneous lupus erythematosus (CLE): An open-label prospective pilot study. J Am Acad Dermatol 2016;74(4):693-699.e3.
4. Chasset F, Arnaud L, Jachiet M, et al. Changing antimalarial agents after inefficacy or intolerance in patients with cutaneous lupus erythematosus: A multicenter observational study. J Am Acad Dermatol 2018;78(1):107-114.e1.
5. Richez C, Cordel N, Maillard H, et al. Practical management of patients on hydroxychloroquine. Joint Bone Spine 2021;88(5 Suppl 1):105316.
6. Rosenbaum JT, Costenbader KH, Desmarais J, et al. American College of Rheumatology, American Academy of Dermatology, Rheumatologic Dermatology Society, and American Academy of Ophthalmology 2020 Joint Statement on Hydroxychloroquine use with respect to retinal toxicity. Arthritis Rheumatol Hoboken NJ 2021;73(6):908‑11.
7. Sonigo G, Jachiet M, Bessis D, et al. Hydroxychloroquine dose tapering or discontinuation in cutaneous lupus erythematosus after remission: A retrospective multicenter cohort study of 56 patients. J Am Acad Dermatol 2021;S0190-9622(21)02190-3.
8. Arnaud L, Mertz P, Gavand PE, et al. Drug-induced systemic lupus: Revisiting the ever-changing spectrum of the disease using the WHO pharmacovigilance database. Ann Rheum Dis 2019;78(4):504‑8.
9. Kawka L, Mertz P, Chasset F, et al. Characterization of drug-induced cutaneous lupus: Analysis of 1994 cases using the WHO pharmacovigilance database. Autoimmun Rev 2021;20(1):102705.
10. Islam MN, Hossain M, Haq SA, et al. Efficacy and safety of methotrexate in articular and cutaneous manifestations of systemic lupus erythematosus. Int J Rheum Dis 2012;15(1):62‑8.
11. Sigges J, Biazar C, Landmann A, et al. Therapeutic strategies evaluated by the European Society of Cutaneous Lupus Erythematosus (EUSCLE) Core Set Questionnaire in more than 1000 patients with cutaneous lupus erythematosus. Autoimmun Rev 2013;12(7):694‑702.
12. Chasset F, Tounsi T, Cesbron E, et al. Efficacy and tolerance profile of thalidomide in cutaneous lupus erythematosus: A systematic review and meta-analysis. J Am Acad Dermatol 2018;78(2):342-350.e4.
13. Aitmehdi R, Arnaud L, Frances C, et al. Long-term efficacy and safety outcomes of lenalidomide for cutaneous lupus erythematosus: A multicenter retrospective observational study of 40 patients. J Am Acad Dermatol 2021;84(4):1171-4.
14. Manzi S, Sánchez-Guerrero J, Merrill JT, et al. Effects of belimumab, a B lymphocyte stimulator-specific inhibitor, on disease activity across multiple organ domains in patients with systemic lupus erythematosus: Combined results from two phase III trials. Ann Rheum Dis 2012;71(11):1833‑8.
15. Salle R, Chasset F, Kottler D, et al. Belimumab for refractory manifestations of cutaneous lupus: A multicenter, retrospective observational study of 16 patients. J Am Acad Dermatol 2020;83(6):1816‑9.
16. Furie R, Rovin BH, Houssiau F, et al. Two-year, randomized, controlled trial of belimumab in lupus nephritis. N Engl J Med 2020;383(12):1117‑28.
17. Morand EF, Furie R, Tanaka Y, et al. Trial of anifrolumab in active systemic lupus erythematosus. N Engl J Med 2020;382(3):211‑21.
18. Chasset F, Jaume L, Mathian A, et al. Rapid efficacy of anifrolumab in refractory cutaneous lupus erythematosus. J Am Acad Dermatol 2023;S0190-9622(23)00354-7.
19. Carter LM, Wigston Z, Laws P, et al. Rapid efficacy of anifrolumab across multiple subtypes of recalcitrant cutaneous lupus erythematosus parallels changes in discrete subsets of blood transcriptomic and cellular biomarkers. Br J Dermatol 2023;ljad089.
20. Shaw K, Sanchez-Melendez S, Taylor D, et al. Assessment of clinical response to anifrolumab in patients with refractory discoid lupus erythematosus. JAMA Dermatol 2023;e230175.
21. Kalunian KC, Furie R, Morand EF, et al. A randomized, placebo-controlled phase III extension trial of the long-term safety and tolerability of anifrolumab in active systemic lupus erythematosus. Arthritis Rheumatol Hoboken NJ 2023;75(2):253‑65.
22. Vital EM, Wittmann M, Edward S, et al. Brief report: Responses to rituximab suggest B cell-independent inflammation in cutaneous systemic lupus erythematosus. Arthritis Rheumatol Hoboken NJ 2015;67(6):1586‑91.
23. van Vollenhoven RF, Hahn BH, Tsokos GC, et al. Efficacy and safety of ustekinumab, an IL-12 and IL-23 inhibitor, in patients with active systemic lupus erythematosus: Results of a multicentre, double-blind, phase 2, randomised, controlled study. Lancet Lond Engl 2018;392(10155):1330‑9.
24. Merrill JT, Werth VP, Furie R, et al. Phase 2 trial of iberdomide in systemic lupus erythematosus. N Engl J Med 2022;386(11):1034‑45.
25. Wallace DJ, Furie RA, Tanaka Y, et al. Baricitinib for systemic lupus erythematosus: A double-blind, randomised, placebo-controlled, phase 2 trial. Lancet Lond Engl 2018;392(10143):222‑31.
26. Morand E, Pike M, Merrill JT, et al. Deucravacitinib, a tyrosine kinase 2 inhibitor, in systemic lupus erythematosus: A phase II, randomized, double-blind, placebo-controlled trial. Arthritis Rheumatol Hoboken NJ 2023;75(2):242‑52.
27. Werth VP, Furie RA, Romero-Diaz J, et al. Trial of anti-BDCA2 antibody litifilimab for cutaneous lupus erythematosus. N Engl J Med 2022;387(4):321‑31.

 Encadrés
Encadrés