L’œsophagite à éosinophiles est une maladie inflammatoire chronique de l’œsophage caractérisée par l’infiltration de polynucléaires éosinophiles dans la muqueuse œsophagienne. Elle est aujourd’hui la première cause de dysphagie chez les patients de moins de 40 ans.
Sa prévalence est de l’ordre de 40 cas pour 100 000 habitants, ce qui en fait une maladie rare mais non exceptionnelle.1 Et son incidence est en constante augmentation.2 L’homme est deux fois plus souvent atteint que la femme. L’œsophagite à éosinophiles peut survenir à n’importe quel âge de la vie. Une exposition précoce à des allergènes alimentaires et possiblement aériens a été incriminée comme facteur de développement de l’œsophagite à éosinophiles.
La physiopathologie est multifactorielle
La physiopathologie exacte de l’œsophagite à éosinophiles est complexe, impliquant une combinaison de prédisposition génétique, dysrégulation immunitaire et composants environnementaux :3 la part génétique est étayée par les cas d’agrégation familiale d’œsophagite à éosinophiles, mais la transmission n’est pas monogénique. L’environnement joue également un rôle important, dès la période prénatale (prématurité, césarienne, traitements antibiotiques…).
L’infiltrat inflammatoire résulte d’une réponse immune de type Th2, comme dans l’asthme et la dermatite atopique. Bien souvent, on l’observe chez les patients avec un terrain d’atopie (50 à 60 % des cas) : asthme, rhinite allergique, dermatite atopique, allergie médiée par les immunoglobulines E (IgE).1
Les allergènes reconnus comme déclencheurs sont le lait, l’œuf, le blé et le soja. À noter qu’il ne s’agit pas d’allergies alimentaires proprement dites : les tests allergologiques ne sont d’ailleurs pas utiles pour le diagnostic et ne sont pas prédictifs de la réponse à un régime d’éviction. Cependant, le risque d’œsophagite à éosinophiles est majoré en cas d’allergies alimentaires.
Le reflux gastro-œsophagien (RGO) et la dysbiose œsophagienne jouent le rôle de facilitateurs, notamment en augmentant la perméabilité épithéliale et en favorisant le contact entre la muqueuse et les allergènes.4
La caractéristique histologique de l’œsophagite à éosinophiles est la présence d’un grand nombre d’éosinophiles dans la muqueuse œsophagienne. Les éosinophiles libèrent des protéines toxiques et des médiateurs inflammatoires qui peuvent endommager l’épithélium œsophagien, provoquant des symptômes. Une évolution vers la fibrose est possible.
Il n’existe aucun lien connu entre œsophagite à éosinophiles et survenue d’un cancer de l’œsophage.5
Signes cliniques
Chez l’adulte, le tableau clinique est généralement celui d’une dysphagie chronique (80 %)6 qui est intermittente et prédomine typiquement aux solides. Les patients peuvent s’être adaptés aux symptômes depuis des années, en mangeant plus lentement, en buvant pour faciliter la progression des aliments ; l’impaction alimentaire est alors le mode de diagnostic dans 30 % des cas.7 Cela explique aussi le délai diagnostique moyen, qui est de plusieurs années. Des symptômes plus atypiques peuvent exister, telles des épigastralgies, des douleurs thoraciques, une sensation de constriction dans la gorge. Un reflux gastro-œsiphagien (RGO) peut être associé. En cas de diagnostic tardif, il existe un risque plus important de sténose œsophagienne, pouvant également se manifester par une dysphagie ou une impaction alimentaire.
Chez le jeune enfant, les symptômes sont aspécifiques : RGO résistant au traitement, vomissements chroniques, difficultés alimentaires prolongées, infléchissement de la courbe staturopondérale.1 Chez l’enfant plus âgé et l’adolescent, le tableau est identique à celui des adultes.
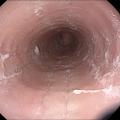
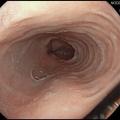
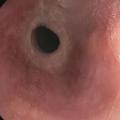
Aspect endoscopique : ne pas confondre avec la candidose œsophagienne !
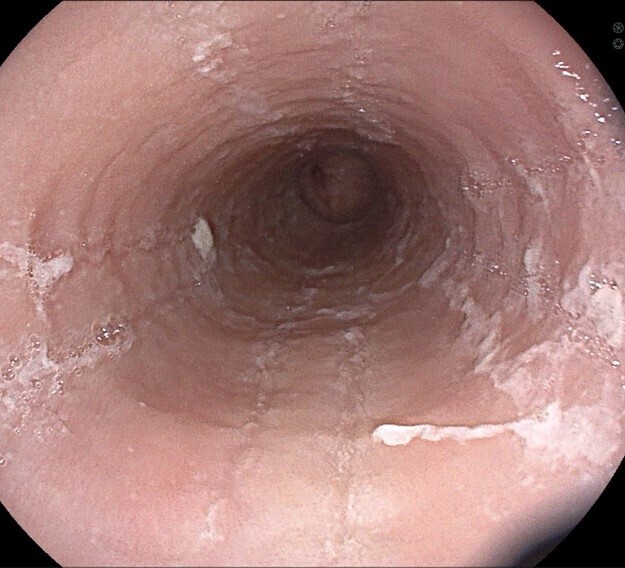
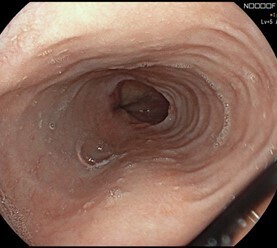
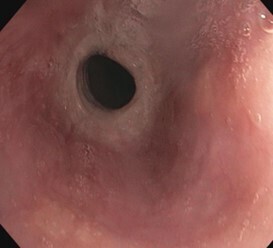
L’aspect endoscopique peut être normal ou subnormal (10 à 30 % des cas). Le plus souvent, des lésions élémentaires sont observées. Il s’agit de sillons longitudinaux, d’anneaux (aspect pseudotrachéal), d’œdème, d’exsudats, de sténoses.6 Les exsudats correspondent à des micro-abcès à éosinophiles et sont à distinguer d’une candidose œsophagienne (figures 1 à 3).
Démarche diagnostique
Des recommandations ont été publiées en 2024 par la Société nationale française de gastro-entérologie (SNFGE) concernant le diagnostic, la prise en charge et le suivi de l’œsophagite à éosinophiles chez l’adulte.7 Un protocole national de diagnostic et de soins (PDNS) a été publié en 2022 pour son diagnostic et sa prise en charge chez l’enfant.1
Indispensables biopsies œsophagiennes
Le diagnostic peut être évoqué lors d’une fibroscopie œso-gastro-duodénale (FOGD) programmée, pour l’exploration d’une dysphagie le plus souvent, ou lors d’une FOGD réalisée en urgence pour impaction alimentaire. Le diagnostic repose alors sur les biopsies œsophagiennes qui doivent montrer un nombre d’éosinophiles supérieur ou égal à 15 par champ à fort grossissement (ou ≥ 60/mm2), en l’absence d’autres causes d’éosinophilie œsophagienne, et doivent être associées à des symptômes de dysphagie et/ou d’impaction alimentaire. La distribution des éosinophiles le long de la paroi est inégale, il est donc recommandé de réaliser six biopsies, dans au moins deux sites différents de l’œsophage, en cas de suspicion. Les biopsies doivent être réalisées y compris en cas de muqueuse normale macroscopiquement. Les éosinophiles doivent dépasser le seuil diagnostique sur au moins une des biopsies pour pouvoir poser le diagnostic.
La sévérité des lésions endoscopiques peut être évaluée à l’aide du score endoscopique de référence (EREFS) décrit en 2013 (tableau 1), qui prend en considération les cinq anomalies endoscopiques les plus fréquentes dans l’œsophagite à éosinophiles, à savoir l’œdème, les anneaux, les exsudats, les sillons et les sténoses.8
Les inhibiteurs de la pompe à protons (IPP) pouvant négativer les biopsies, il est recommandé de les arrêter au moins trois semaines avant la réalisation de l’endoscopie.7
Recherche des diagnostics différentiels
En cas d’atypie, d’autres examens sont réalisés pour éliminer des diagnostics différentiels comme la gastroentérite à éosinophiles (avec biopsies gastriques et intestinales), le syndrome hyperéosinophilique (hyperéosinophilie sanguine avec douleurs abdominales, diarrhées et/ou ascite), l’achalasie (à rechercher par une manométrie œsophagienne en cas de dysphagie persistante malgré une normalisation des éosinophiles sous traitement), certaines connectivites, une réaction d’hypersensibilité à un médicament.6
La recherche d’IgE spécifiques d’allergènes alimentaires et la réalisation de prick-tests n’ont pas leur place dans la démarche diagnostique, sauf en cas de signes cliniques évocateurs d’allergies à certains aliments.6 Une consultation d’allergologie reste néanmoins recommandée en pédiatrie.1
Prise en charge : trois objectifs
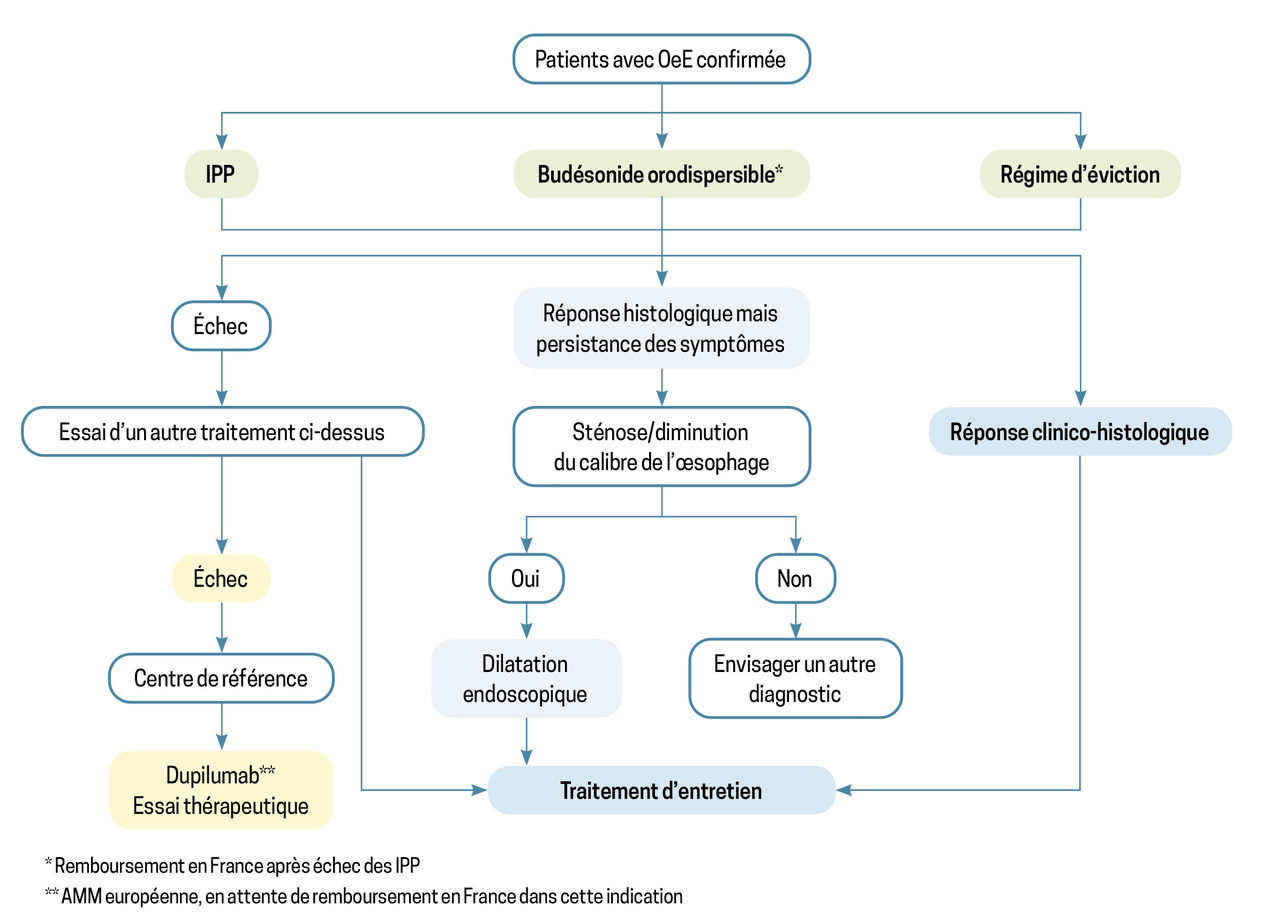
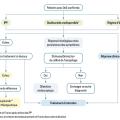
La prise en charge de l’œsophagite à éosinophiles a pour objectifs le soulagement symptomatique, la rémission histologique et la prévention des rechutes.7 Les traitements les plus utilisés sont les IPP, les corticoïdes locaux et le régime d’éviction.
Les différentes stratégies de traitement sont résumées dans un algorithme publié dans les recommandations françaises (fig. 4).7
La résolution de la dysphagie est obtenue par diminution de l’infiltrat inflammatoire, et parfois de la fibrose. La réponse au traitement doit être évaluée cliniquement et histologiquement, car on estime qu’une réponse clinique et non histologique ne prémunit pas du risque de sténose à long terme. Les recommandations préconisent donc la réalisation d’une endoscopie de contrôle, après six à douze semaines de traitement.
IPP puis corticoïdes
Les inhibiteurs de la pompe à protons (IPP) sont utilisés en première ligne, malgré l’absence d’autorisation de mise sur le marché (AMM) dans cette indication. Ils agissent par effet anti-inflammatoire, réduction de la perméabilité membranaire, réduction du RGO associé.7 L’efficacité symptomatique est de l’ordre de 70 %, la rémission histologique étant atteinte dans 50 % des cas environ.7 Il s’agit d’un traitement simple et bien toléré. Les recommandations suggèrent de débuter par une double dose d’IPP (tableau 2), avec une prise matin et soir. En cas de réponse clinique et histologique, la dose peut être diminuée jusqu’à obtenir la dose minimale efficace.
Les corticoïdes locaux constituent également un traitement de référence. Pendant de nombreuses années, il n’y avait pas de forme spécifique pour l’œsophagite à éosinophiles ; les galéniques inhalées développées pour l’asthme étaient conseillées aux patients, en expliquant la nécessité de déglutir le produit. Depuis 2022, le budésonide orodispersible a obtenu l’AMM en France pour le traitement d’induction et d’éradication dans l’œsophagite à éosinophiles après échec des IPP. La dose d’induction est de 1 mg matin et soir. Ce traitement permet une rémission clinique pour 60 % des patients et histologique pour près de 90 % d’entre eux à six semaines.7 La dose peut ensuite être diminuée à 0,5 mg matin et soir. Le traitement est globalement bien toléré, l’effet indésirable principal étant la survenue de candidoses, ne contre-indiquant pas la poursuite du traitement.
Place du régime d’éviction
Le régime d’éviction est une alternative au traitement médicamenteux. Plusieurs types de régime et de stratégie ont été proposés, de l’éviction d’un groupe d’aliments comme les produits laitiers (avec 40 % d’efficacité environ) à l’éviction de six groupes d’aliments (produits laitiers, blé, œufs, soja et légumineuses, fruits à coque, fruits de mer et poissons) [avec 80 % d’efficacité environ].7
Certaines approches proposent l’éviction initiale des six groupes, puis, en cas d’efficacité, la réintroduction progressive des aliments, deux groupes par deux groupes ; d’autres proposent l’éviction de deux groupes et, en cas d’inefficacité, l’éviction de deux groupes supplémentaires, etc.
Dans tous les cas, ces régimes nécessitent une motivation importante du patient, pour l’observance du régime, et des endoscopies à chaque étape afin de contrôler l’efficacité. Ils sont tout particulièrement indiqués chez les patients intolérants aux traitements médicamenteux ou inquiets de leurs effets indésirables.
L’aide d’un diététicien est conseillée pour la mise en place du régime d’éviction.
Les tests allergologiques ne sont pas recommandés pour le choix du régime d’éviction.7 En effet, plusieurs études ont montré que les dosages d’IgE spécifiques dans le sérum ou les prick-tests cutanés ne prédisent l’efficacité d’un régime d’exclusion que dans moins de 15 % des cas.7 Une étude récente9 s’est intéressée au rôle des IgG4 spécifiques de groupes alimentaires, dont le dosage semble prometteur à la fois sur le plan diagnostique et pour guider le régime d’éviction.
Cas de l’enfant
Pour les enfants, une prise en charge en centre expert est préconisée. Les trois mêmes traitements d’induction sont disponibles hors AMM.1 Comme pour l’adulte, des biopsies de contrôle sont nécessaires, et la dose minimale efficace est recherchée. Des contrôles annuels sont indiqués.1
Persistance des symptômes : que faire ?
En cas de dysphagie persistante sous traitement bien conduit et efficace sur le plan histologique, une sténose est à rechercher en endoscopie. Cependant, la fibrose seule, par diminution de la distensibilité œsophagienne, peut aussi être responsable d’un tel tableau. La réalisation d’un transit œso-gastro-duodénal (TOGD) et la mesure de distensibilité par impédance (EndoFlip) sont alors utiles.
En cas de fibrose et/ou de sténose occasionnant une dysphagie persistante, une dilatation endoscopique est recommandée.7
Biothérapies en dernier recours
En cas d’échec des traitements de première ligne, des biothérapies peuvent être envisagées dans le cadre d’essais cliniques. Le dupilumab (anti-IL- 4 et IL- 13) a une autorisation européenne dans cette indication.
Évolution : la rémission est possible
Il est actuellement recommandé de poursuivre au long cours le traitement ayant permis d’obtenir la rémission, à la dose minimale efficace.7 Cette recommandation repose sur un accord d’experts projetant d’éviter l’évolution vers une forme fibrosante dans la mesure où l’arrêt du traitement est quasi systématiquement suivi d’une rechute. Le caractère chronique de la pathologie, avec nécessité de traitement et de suivi réguliers, peut justifier une demande de prise en charge en affection longue durée (ALD) hors liste.
La rémission complète est définie par l’association de la disparition des symptômes cliniques, la normalisation des lésions endoscopiques et la régression de l’infiltrat à éosinophiles à moins de 15 par champ au fort grossissement (ou HPF [high-power field]).7 Dans certains essais et dans les recommandations pédiatriques, l’objectif est plus bas : moins de 5 éosinophiles par HPF.1
Après obtention de la rémission, un suivi clinique annuel est à mettre en place.7
Actuellement, aucun lien n’est établi entre le taux d’éosinophiles sous traitement et les risques évolutifs ultérieurs de rechute ou de complications.
Que dire à vos patients ?
L’œsophagite à éosinophiles est une maladie bénigne, rare, mais dont l’incidence augmente.
La présence d’une dysphagie, la survenue d’épisodes d’impaction alimentaire, même spontanément résolutifs, doivent faire rechercher ce diagnostic.
Un traitement est indiqué pour résoudre les symptômes et diminuer le risque d’évolution vers une sténose.
Il existe deux types de traitement médicamenteux principaux, IPP et corticoïdes locaux, bien tolérés et efficaces dans la plupart des cas. Un traitement non médicamenteux par régime d’éviction est également possible.
Un suivi spécialisé est recommandé.
Il existe une association de patients : l’Association pour l’information sur les maladies à éosinophiles (APIMEO).
2. Hahn JW, Lee K, Shin JI, et al. Global Incidence and Prevalence of Eosinophilic Esophagitis, 1976–2022: A Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol 2023;21(13):3270-3284.e77.
3. Underwood B, Troutman TD, Schwartz JT. Breaking down the complex pathophysiology of eosinophilic esophagitis. Ann Allergy, Asthma Immunol 2023;130(1):28‑39.
4. Benamouzig R, Roman S. Œsophagite à éosinophiles. Introduction. Hépato-Gastro et Oncologie Digestive 2023;30(3):350‑1.
5. Syed A, Maradey-Romero C, Fass R. The relationship between eosinophilic esophagitis and esophageal cancer. Dis Esophagus 2017;30(7):1‑5.
6. Roman S, Benamouzig R. Diagnostic de l’œsophagite à éosinophiles. Hépato-Gastro & Oncologie Digestive 2023;30(3):352‑8.
7. Zerbib F, Berger A, Hagège H, et al. Recommandations françaises pour le diagnostic et la prise en charge de l’œsophagite à éosinophiles chez l’adulte (SNFGE). Mars 2024. Disponible sur: https://www.snfge.org/bibliotheque-scientifique
8. Hirano I, Moy N, Heckman MG, et al. Endoscopic assessment of the oesophageal features of eosinophilic oesophagitis: validation of a novel classification and grading system. Gut 2013;62(4):489‑95.

 Encadrés
Encadrés