Le capital osseux évolue au cours de la vie : il augmente pendant l’enfance et l’adolescence et atteint un maximum entre 25 et 30 ans ; à cet âge, il existe déjà d’importantes différences entre les personnes pour des raisons génétiques, anthropométriques (taille, poids), nutritionnelles et hormonales. À partir de 50 ans, le capital osseux diminue, les travées osseuses deviennent plus fines, puis perforées, fragmentées, et la résistance osseuse diminue fortement. Chez les personnes ayant un capital osseux initialement faible, la perte osseuse provoque l’apparition d’une fragilité pathologique appelée ostéoporose. L’ostéoporose correspond donc à une fragilité osseuse anormale ; elle est multifactorielle, acquise, évolutive au fil des années et caractérisée par une diminution de la résistance osseuse des pièces squelettiques, avec pour conséquence une augmentation du risque de fracture non traumatique.
Entre 50 ans et la fin de leur vie, une femme sur deux et un homme sur cinq auront une ou plusieurs fractures ostéoporotiques. L’ostéoporose est ainsi responsable d’environ 400 000 fractures chaque année en France, dont 200 000 mènent à une hospitalisation. Les fractures ostéoporotiques sont associées à des douleurs, à une impotence fonctionnelle, à des institutionnalisations, à une augmentation du risque de nouvelle fracture et à une mortalité accrue : une femme sur six et un homme sur quatre décèdent dans l’année qui suit une fracture de hanche, soit une mortalité trois fois supérieure chez l’homme à celle observée chez des patients du même âge indemnes de fracture.
Le coût sociétal incluant soins ambulatoires, hospitalisations, rééducations, chirurgies et institutionnalisations est majeur et se chiffre à près de 7 milliards d’euros par an en France (2,6 % des dépenses de santé).
Ces chiffres montrent que l’ostéoporose est un enjeu de santé publique évident et une préoccupation clinique pour l’ensemble du corps médical, en particulier pour les médecins généralistes, les gériatres, les rhumatologues et les chirurgiens orthopédistes. En dépit de sa fréquence et de ses conséquences cliniques majeures, l’ostéoporose reste néanmoins une maladie sous-diagnostiquée et sous-traitée dans les deux sexes, mais davantage encore chez les hommes : 15 % des patients hospitalisés pour fracture ont un traitement antiostéoporotique dans l’année suivant la fracture, dont 5 % des hommes seulement.1 Pourtant, les traitements antiostéoporotiques sont très efficaces pour réduire le risque de fracture et de décès post-fracture, bien tolérés et sans interactions pharmacologiques. En tenant uniquement compte du vieillissement de la population, sans variation de l’incidence, le nombre de fractures dans les deux sexes augmentera en France de 25 % d’ici à 2035. À l’instar de ce qui est réalisé depuis 25 ans pour les maladies cardiovasculaires, le dépistage et le traitement de l’ostéoporose doivent devenir systématiques pour les patients ayant des facteurs de risque.
Quand penser à l’ostéoporose ?
Deux situations sont à distinguer, selon qu’il existe un antécédent de fracture par fragilité osseuse ou non.
Chez la femme et l’homme, après une fracture par fragilité osseuse
La fracture par fragilité osseuse est une fracture spontanée ou qui survient à la suite d’un traumatisme à basse cinétique (fracture survenant après une chute de sa hauteur à l’arrêt ou lors de la marche).
L’ostéoporose doit être évoquée :
- quel que soit le site de fracture, à l’exception du crâne, de la face, des vertèbres au-dessus de la T4, de l’avant-pied et de la main (fractures non associées à l’ostéoporose) ;
- quelle que soit la symptomatologie : certaines fractures vertébrales sont peu ou pas symptomatiques mais restent un facteur de risque majeur de la survenue d’autres fractures dans les deux à trois années qui suivent ;
- quel que soit l’âge du patient : la fracture du sujet de 60 ans est un marqueur de la gravité future de l’ostéoporose. Les fractures survenant chez les personnes âgées de plus de 80 ans sont associées à un haut risque de décès et de récidive fracturaire à court terme ;
- quelle que soit la sévérité de la fracture : les fractures sévères, associées à une augmentation de la mortalité, sont une priorité thérapeutique (extrémité supérieure du fémur, vertèbres, bassin [sacrum et cadre obturateur], extrémité supérieure de l’humérus, diaphyse fémorale, tibia proximal, trois côtes simultanées) ;
- les fractures non sévères (poignet, cheville, côte), non associées à une augmentation de la mortalité, ne doivent jamais être négligées car si la densité minérale osseuse est basse, elles annoncent la survenue ultérieure de fractures sévères.
Sans antécédent de fracture
Il convient de penser à l’ostéoporose chez la femme après 50 ans et chez l’homme de plus de 70 ans dès lors qu’il existe une ou plusieurs causes d’ostéoporose (tableau 1), même sans antécédent de fracture.
Après 50 ans, chez la femme
Chez les femmes, la cause principale de perte osseuse est la carence en œstrogènes (ménopause) dont l’effet est d’accélérer la résorption osseuse. Plus la ménopause survient tôt au cours de la vie, plus la perte osseuse débute précocement et plus le risque de fracture est élevé à moyen et long termes. D’autres facteurs de risque (tableau 1) peuvent s’associer à cette ostéoporose dite primitive ou post-ménopausique.
À partir de 70 ans chez l’homme et chez tout patient en cas de facteur de risque
Chez les hommes, les causes secondaires prédominent (encadré 1). Le médecin généraliste doit ainsi rechercher activement une ostéoporose non seulement chez la femme ménopausée mais aussi chez tout patient dans les situations suivantes : corticothérapie prolongée (plus de 3 mois),2 hormonothérapie des cancers du sein et de la prostate (analogue de la LH-RH, inhibiteur de l’aromatase…),3,4 insuffisances d’organe (insuffisance respiratoire chronique, insuffisance rénale chronique, insuffisance hépatocellulaire), maladie alcoolique, transplantations d’organe, malabsorptions digestives (chirurgie bariatrique…), pathologies neurologiques chroniques, maladies inflammatoires chroniques, patients chuteurs multiples.
Il ne faut pas attendre la première fracture pour dépister l’ostéoporose, de la même façon que l’on n’attend pas la survenue d’un syndrome coronarien pour mesurer la glycémie, la pression artérielle ou le cholestérol LDL.
Comment rechercher une ostéoporose ?
Pour évaluer le risque de fracture et rechercher une ostéoporose, le médecin recueille les informations suivantes : antécédents personnels et familiaux de fracture, fractures visibles sur les radiographies du rachis, facteurs de risque cliniques (incluant le poids et la taille), capital osseux disponible (mesuré par la densitométrie), risque de chute.
Recueil des antécédents de fractures à basse cinétique
Le principal facteur de risque de fracture est l’antécédent personnel de fracture par fragilité osseuse.
La récidive fracturaire est souvent rapide : la moitié des nouvelles fractures surviennent dans les deux ans suivant la fracture initiale ; la prise en charge de l’ostéoporose doit être rapide, dans les trois mois après la première fracture.
Le risque de nouvelle fracture est d’autant plus important que la fracture initiale est une fracture sévère, que le sujet est âgé et que la densité minérale osseuse (DMO) est basse.
Un antécédent parental de fracture de hanche est aussi un facteur de risque de fracture à prendre en compte car 70 % du capital osseux est déterminé génétiquement.
Recueil des facteurs de risque
Les facteurs de risque en lien avec une masse osseuse basse et le risque de fractures sont détaillés dans le tableau 1. Parmi eux, on note en particulier la ménopause précoce, une corticothérapie, la prise d’antiœstrogènes ou d’antiandrogènes, l’alcoolisme, les chutes multiples, un handicap neurosensoriel...
Recueil des mensurations
Peser le patient n’est pas un geste à négliger : les personnes avec un indice de masse corporelle (IMC) inférieur à 19 kg/m2 (qui est une des conditions de remboursement de l’ostéodensitométrie chez la femme ménopausée) ont le plus souvent une DMO basse, avec des T-scores à - 2 ou - 2,5, voire plus bas. À l’inverse, les personnes obèses ont une DMO le plus souvent élevée. Une perte de poids évolutive (dénutrition, syndrome de malabsorption) s’associe à une diminution de DMO : - 10 % du poids corporel équivaut à - 1 % de DMO au col fémoral.
Mesurer le patient est tout aussi important : la taille actuelle est à comparer à la taille historique (taille rapportée à l’âge de 20 ans). Il convient de rechercher systématiquement une fracture vertébrale en cas de diminution de taille de 4 cm par rapport à la taille à l’âge de 20 ans, ou en cas de baisse de 2 cm par rapport à une taille récente.
Place de l’ostéodensitométrie osseuse
Il s’agit du seul examen capable de déterminer objectivement le capital osseux du patient, en prenant en compte le T-score de DMO disponible au rachis et à la hanche.
En l’absence de fracture, chez les sujets de plus de 50 ans, un T-score inférieur à - 3 est un facteur de risque majeur et doit faire proposer un traitement. À ce stade, si le patient est observant, le traitement est très efficace pour éviter la première fracture, et donc les fractures suivantes.
Documenter les fractures vertébrales par l’imagerie
La sémiologie de la fracture vertébrale est très variable d’un patient à l’autre : syndrome hyperalgique conduisant à l’hospitalisation, lombalgie mécanique banale ressemblant en tout point à une lombalgie commune, lombalgie fugace n’amenant pas le patient à consulter (fracture en compression d’apparition progressive sur plusieurs jours). L’interrogatoire n’est donc pas suffisant et peut même être trompeur pour le diagnostic des fractures vertébrales.
En pratique, la prescription de radiographies du rachis dorsal et lombaire – il faut toujours investiguer ces deux étages – est indispensable dans les situations suivantes :
- devant une ostéoporose confirmée par la densitométrie ou par l’existence d’une autre fracture majeure, avant la mise en route du traitement car la découverte de fractures vertébrales change les indications thérapeutiques ;
- devant une première fracture lombaire, pour rechercher une fracture dorsale (ou inversement) ;
- devant un antécédent rapporté de fracture vertébrale, ancienne, sans imagerie disponible ;
- devant une rachialgie aiguë, même transitoire et résolutive, après l’âge de 50 ans ;
- devant une perte de taille mesurée par le médecin (perte de 4 cm par rapport à la taille connue aux alentours de l’âge de 20 ans ou de 2 cm par rapport à la taille mesurée au cours des trois dernières années dans le même cabinet médical) ;
- si le patient est sous corticothérapie au long cours, facteur de risque majeur de fracture vertébrale ostéoporotique.
Évaluer le risque de chute
Plus le patient est chuteur, plus son risque de fracture augmente et plus le dépistage de l’ostéoporose est important.
Trois questions sont particulièrement utiles :
- « Êtes-vous tombé(e) dans la dernière année ; si oui, combien de fois, et avez-vous été blessé(e) ? » ;
- « Avez-vous peur de tomber ? » ;
- « Vous sentez-vous instable en marchant ou en vous levant ? ».
Utilité du bilan sanguin
Il n’est pas utile pour évaluer le risque de fracture mais reste indispensable (si DMO basse ou fracture) pour vérifier l’absence d’autres maladies osseuses (hyperparathyroïdie, ostéomalacie, myélome...) et rechercher des contre-indications relatives au traitement : hémogramme, électrophorèse des protéines sériques, dosage de la protéine C-réactive (CRP), calcémie, phosphatémie, créatininémie avec estimation de la clairance, dosage de la 25(OH)-vitamine D, dosage de la parathormone (PTH), bilan hépatique avec phosphatases alcalines.
Ce bilan biologique est normal en cas d’ostéoporose, excepté en cas d’insuffisance en vitamine D, situation très fréquente. La découverte d’une insuffisance rénale chronique modérée, voire sévère, fréquente chez le sujet âgé, n’est pas une contre-indication au traitement de fond, mais le choix de la molécule justifie le recours à un avis de rhumatologue expérimenté en pathologie osseuse (tableau 2).
Pour qui et quand prescrire une ostéodensitométrie ?
L’ostéodensitométrie (DXA) est un examen clé pour évaluer la fragilité osseuse en premier lieu, puis la réponse thérapeutique après deux à trois années de traitement. L’ostéodensitométrie est un examen accessible, peu coûteux, fiable et non invasif. La mesure est réalisée sur le rachis lombaire et l’extrémité supérieure du fémur.
Après 75 ans, la mesure lombaire n’est pas fiable en raison de l’arthrose lombaire qui majore la DMO et rassure, à tort, le praticien.
Une densité osseuse basse n’est pas synonyme d’ostéoporose, mais, après l’âge de 50 ans, il s’agit d’un facteur de risque majeur de fracture. Ce facteur de risque n’est pas toujours présent, mais plus la DMO est basse, plus le risque de fracture augmente : pour chaque diminution d’un écart type de DMO à la hanche, le risque de fracture de hanche est multiplié par 3 environ. Ainsi, en présence d’une fracture ostéoporotique typique (hanche, vertèbre, bassin, humérus), il n’est pas indispensable d’avoir une DMO basse pour débuter le traitement. Environ 50 % des fractures ostéoporotiques surviennent chez des sujets avec une DMO intermédiaire (T-scores compris entre - 1 et - 2,5). Ces patients sont sujets aux fractures car ils ont, en plus de cette DMO intermédiaire, des facteurs de risque additionnels : par exemple, un âge supérieur à 70 ans, une corticothérapie au long cours, des chutes multiples, un traitement antiœstrogène, une défaillance d’organe...
Après une fracture à basse cinétique
Une DXA est à réaliser après tout événement fracturaire à basse cinétique, pour disposer d’une mesure de DMO de référence qui servira de repère au cours du traitement : la stabilité ou, mieux, le gain de densité osseuse après trois ans de traitement est un critère d’observance et d’efficacité thérapeutique.
Indispensable en cas de corticothérapie au long cours
Une DXA doit être réalisée chez les patients sous corticothérapie au long cours quel que soit leur âge : 50 % des patients soumis à une corticothérapie prolongée auront des fractures ostéoporotiques ; l’ostéoporose cortisonique peut survenir à tout âge, y compris chez les sujets jeunes.
À visée diagnostique, en cas de facteurs de risque
Hors contexte de fracture, une DXA devrait être réalisée, à visée diagnostique, chez tous les adultes qui ont un ou plusieurs facteurs de risque d’ostéoporose. Bien que cette indication ne corresponde pas aux conditions de remboursement actuelles de l’examen, la mesure de DMO devrait faire partie des examens indispensables en matière de prévention, comme la glycémie, l’exploration d’une anomalie lipidique, la mesure de la pression artérielle ou la mammographie.
Cas particulier des personnes très âgées
Chez les patients très âgés (souvent de plus de 85 ans), difficiles à déplacer, vivant en institution, la mesure de la DMO n’est pas indispensable : un traitement de fond peut être débuté après une fracture ostéoporotique typique, dès lors que le bilan biologique est rassurant. En effet, il ne faut jamais retarder le traitement de l’ostéoporose après une fracture ostéoporotique typique sous prétexte que la DXA est difficile à réaliser.
Prise en charge du patient ostéoporotique
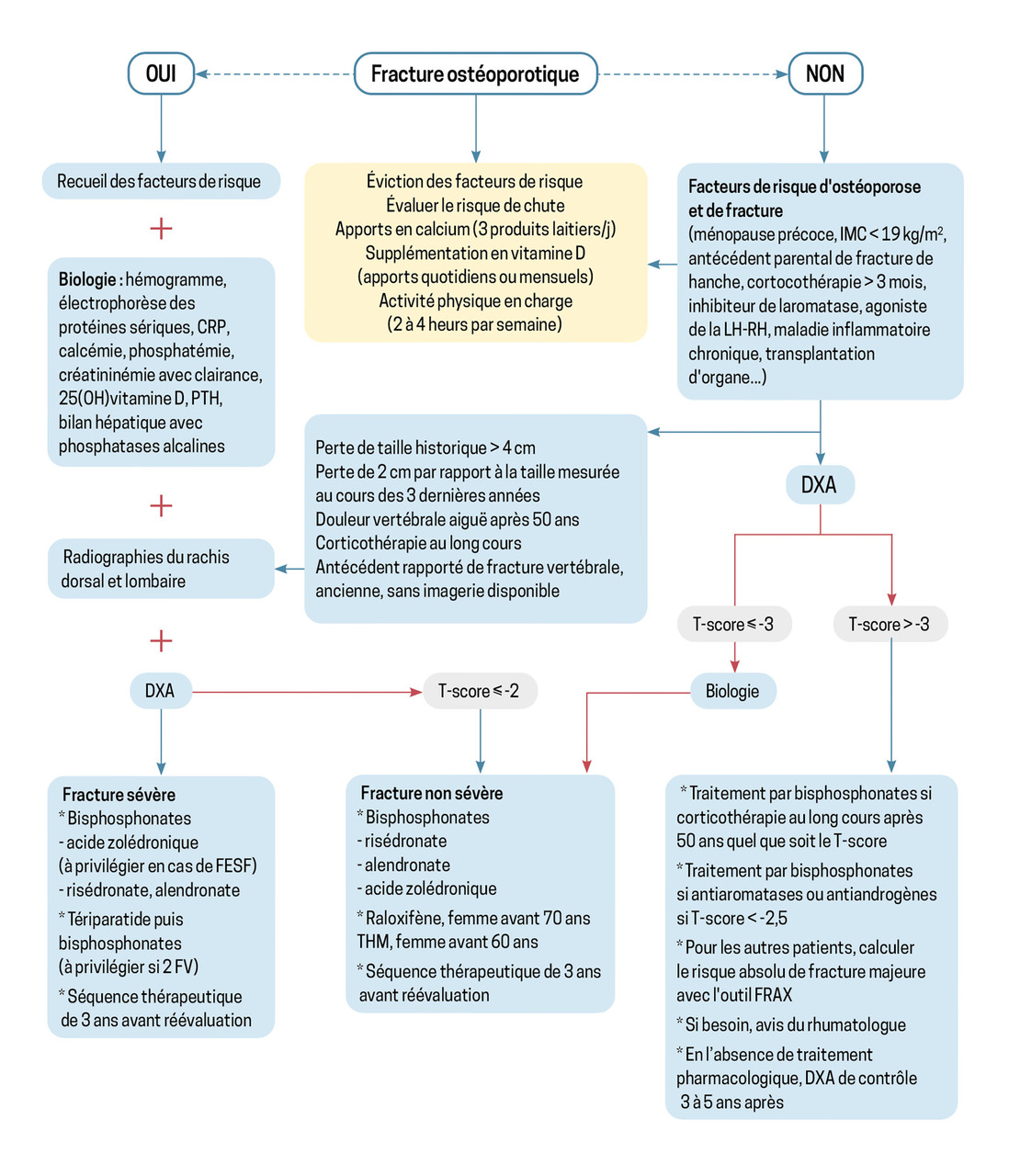
La prise en charge de l’ostéoporose est à la fois pharmacologique et non pharmacologique ; son objectif principal est de réduire le risque de fractures (figure). Le traitement mis en place est fonction de l’âge, des antécédents, du risque de fracture vertébrale et/ou périphérique, de la sévérité de la fracture, en tenant compte des contre-indications. Les mesures non pharmacologiques sont résumées dans le tableau 3 ; complémentaires et nécessaires, elles ne réduisent pas à elles seules le risque de fracture.
Indications du traitement
Le traitement pharmacologique est indispensable pour réduire le risque de fracture ostéoporotique, comme démontré dans plusieurs essais randomisés de très bonne qualité méthodologique.6 - 11 Les traitements antiostéoporotiques réduisent le risque de fractures vertébrales (réduction de 70 % de fractures vertébrales après trois années d’acide zolédronique versus placebo) et non vertébrales (réduction de 40 % de fractures non vertébrales après trois années d’acide zolédronique versus placebo) et augmentent la DMO. Pourtant, en France, moins de 15 % des patients avec fracture récente de faible traumatisme reçoivent un traitement antiostéoporotique alors que près de 60 % d’entre eux reçoivent une supplémentation en calcium et vitamine D, certes utile, mais qui n’a pas démontré, en prescription isolée, de bénéfice sur la réduction du risque de nouvelle fracture.
Après avoir vérifié le mécanisme à basse cinétique de la fracture, et à la suite des résultats du bilan biologique, il est recommandé d’instaurer un traitement antiostéoporotique :12
- en cas de fracture ostéoporotique sévère, quel que soit l’âge ;
- en cas de fracture ostéoporotique non sévère (poignet, cheville, une côte) si le T-score est inférieur ou égal à - 2 ;
- en l’absence de fracture ostéoporotique, chez un patient avec un T-score inférieur ou égal à - 3 et un âge supérieur à 50 ans et/ou plusieurs facteurs de risque cliniques.
En cas de doute sur l’indication, il convient d’orienter vers un spécialiste des pathologies osseuses (tableau 2).
Quel traitement privilégier selon le site fracturé ?
Le tableau 4 répertorie les différents traitements disponibles ; le tableau 5 recense ceux qui peuvent être initiés par le médecin traitant.
Les traitements ont montré une efficacité d’autant plus grande que les patients ont un apport calcique suffisant (3 produits laitiers/j) et une concentration sérique optimale en 25(OH)vitamine D (75 à 150 nmol/L).
Fracture de l’extrémité supérieure du fémur ou du bassin
L’acide zolédronique par voie intraveineuse est à considérer en première intention ; il s’agit, en effet, du seul traitement ayant démontré un effet antifracturaire et une réduction du risque de décès post-fracture.13 La perfusion est réalisée au domicile, sur au moins vingt minutes (privilégier 30 minutes), après vérification de la normalité de la calcémie, de la phosphorémie et de la fonction rénale. Une altération rénale préexistante (clairance inférieure à 45 mL/min) ou d’autres facteurs de risque comme un âge avancé, la prise concomitante de médicaments néphrotoxiques ou de diurétiques doivent conduire à prendre un avis spécialisé et à allonger la durée de la perfusion. Le principal effet indésirable, bénin, de ce traitement est la survenue d’un syndrome pseudogrippal chez 15 à 20 % des patients après la première perfusion mais qui peut être diminué par la coprescription de paracétamol 3 g/j et une bonne hydratation orale, pendant les quarante-huit heures suivant la perfusion. Dans l’immense majorité des cas, ce syndrome pseudogrippal ne récidive pas lors des perfusions ultérieures ou alors avec des symptômes minimes ; cette information doit être donnée au patient afin d’éviter une non-observance du traitement.
Deux fractures vertébrales ou plus
Le tériparatide, dans le respect des conditions de remboursement en France, est à privilégier en première intention en l’absence de contre-indication. L’injection (20 µg/80 µL) est sous-cutanée et journalière – de préférence le matin –, réalisée avec un stylo comprenant toutes les doses pour un mois.
En dépit de la contrainte de la voie sous-cutanée, l’observance est très bonne, meilleure que celle observée avec l’alendronate ou le risédronate per os.
Les effets indésirables sont rares et souvent transitoires. Le traitement n’a pas de rémanence osseuse et il est relayé après dix-huit mois par une séquence de bisphosphonates. Le tériparatide n’entraîne aucune conséquence dentaire et peut être débuté même si le patient a des extractions dentaires à réaliser.
Autres fractures sévères
Dans le respect des conditions de remboursement en France, trois traitements peuvent être prescrits en première intention en cas de fractures sévères :
- l’acide alendronique (alendronate) par voie orale à la dose de 70 mg hebdomadaire ;
- acide risédronique (risédronate) par voie orale à la dose de 35 mg hebdomadaire, ou à la dose de 75 mg 1 comprimé, deux jours consécutifs, une fois par mois ;
- acide zolédronique (zolédronate) à la dose de 5 mg par perfusion intraveineuse une fois par an ; ce traitement doit être privilégié car l’observance – et donc l’efficacité – est toujours supérieure à celle des bisphosphonates par voie orale.
Fractures non sévères
En cas de fractures non sévères, les traitements suivants peuvent être prescrits :
- acide alendronique (alendronate) ou acide risédronique (risédronate) ou acide zolédronique (zolédronate) 5 mg ;
- raloxifène (60 mg/j) per os chez les femmes de moins de 70 ans ayant une ostéoporose nécessitant un traitement ; le raloxifène est à considérer si le risque de fracture non vertébrale est faible (défini par l’absence des critères suivants : T-score inférieur à - 3 au niveau de la hanche, facteurs de risque de chute et antécédent de fracture non vertébrale). Le raloxifène diminue de 50 % le risque de cancer du sein hormonodépendant. Il est donc utile chez les femmes de moins de 70 ans, avec une densité osseuse basse, sans fracture sévère évidente, en l’absence d’antécédent personnel de phlébite ou d’embolie pulmonaire ;
- traitement hormonal de la ménopause (THM) chez les femmes ménopausées entre 40 et 60 ans, en présence de troubles du climatère ou en cas de ménopause précoce.
Cas particuliers en l’absence de fracture de faible cinétique
DMO basse (T-score ≤ - 3)
Les traitements préconisés en cas de fractures non sévères peuvent aussi être indiqués dans ce cas, dans le respect des conditions de remboursement.
Existence de facteurs de risque de fracture
En l’absence d’antécédent de fracture à faible cinétique mais en présence de facteurs de risque (corticothérapie au long cours, hormonothérapie), les traitements préconisés en situation de fractures non sévères peuvent aussi être indiqués, dans le respect des conditions de remboursement. Le calcul du risque de fracture sévère à dix ans en utilisant un outil d’évaluation du risque de fracture FRAX – lancé en 2008 par l’Organisation mondiale de la santé – peut aider à prendre une décision de traitement.
Le dénosumab, médicament antirésorbeur, doit être prescrit initialement par un rhumatologue. Il s’agit d’un traitement de deuxième intention en relais d’un traitement par bisphosphonates. Il réduit le risque de fracture de manière identique à l’acide zolédronique, mais l’augmentation continue de la DMO au cours du traitement est à souligner, en particulier pour les patients dont la DMO initiale est effondrée. Cependant, le rebond du remodelage osseux à l’arrêt du traitement et le risque de fracture qui s’ensuit (fractures vertébrales en cascade) nécessite une vigilance particulière quant à l’observance thérapeutique ; un relais par bisphosphonates à son arrêt est indispensable.
Le romosozumab est un anticorps monoclonal antisclérostine ; il a un double effet ostéoformateur et antirésorptif. En France, son indication est limitée aux femmes ménopausées âgées de moins de 75 ans avec un antécédent de fracture sévère et sans antécédent de coronaropathie. La prescription du romosozumab en France est limitée car non remboursée ; la seule possibilité d’obtenir le romosozumab à l’heure actuelle est de passer par une pharmacie hospitalière, sur demande hautement justifiée et en quantité limitée.
Quel suivi réaliser ?
Un suivi clinique annuel du patient permet d’évaluer l’observance et la tolérance du traitement, de recueillir les événements fracturaires, de mesurer la taille, de rechercher de nouveaux facteurs de risque et d'estimer le risque de chutes.
Effet rémanent du traitement
La durée de traitement, adaptée au cas par cas, comporte habituellement une séquence initiale de trois à cinq ans par acide zolédronique ou bisphosphonate per os ou tériparatide suivi de bisphosphonates (18 mois et 3 ans). Pour comprendre le fait que le traitement n’est pas continu mais se déroule par séquences, il suffit de se rappeler que les bisphosphonates per os ou par voie intraveineuse ont un important effet rémanent : la résorption osseuse reste freinée dix-huit mois après l’arrêt du risédronate, vingt-quatre à trente-six mois mois après l’arrêt de l’alendronate ou de l’acide zolédronique. Chez un grand nombre de patients, il est donc possible de suspendre le traitement, après une première séquence, en profitant de cet effet rémanent. De plus, cette attitude permet d’éviter l’accumulation des bisphosphonates et donc les effets indésirables tardifs : ostéonécrose de la mâchoire (encadré 2) et fracture atypique du fémur.
À l’issue de cette première séquence, une évaluation de l’efficacité du traitement est indispensable, en s’aidant d’une nouvelle mesure de la densité osseuse et d’une réévaluation du risque de fracture.
Statuer sur la poursuite de la prise en charge
À l’issue de cette évaluation, différentes décisions thérapeutiques peuvent être prises :
- suspension du traitement et programmation d’un nouveau bilan deux ans plus tard lorsque le patient réunit les trois conditions suivantes : absence de nouvelle fracture non traumatique au-delà de la première année de traitement ; absence de nouveaux facteurs de risque majeurs d’ostéoporose ; maintien ou gain de densité osseuse ;
- maintien du traitement pour deux ou trois années complémentaires, avec l’idée d’obtenir un gain de densité osseuse supplémentaire, sans dépasser cinq ans de traitement continu par un bisphosphonate ;
- rotation thérapeutique devant un échec évident du traitement : introduction du tériparatide devant la survenue de nouvelles fractures vertébrales sous bisphosphonates, introduction de l’acide zolédronique après mauvaise observance d’un bisphosphonate oral. Si le T-score reste très bas, la prescription de dénosumab est à discuter.
Ainsi, après trois années de bisphosphonates ou dix-huit mois de tériparatide suivis d’une à trois années de bisphosphonates, le traitement peut être interrompu en l’absence de nouvelle fracture ou de nouveau facteur de risque avec une réévaluation clinique et mesure de DMO tous les deux à trois ans.
Le raloxifène peut être poursuivi pendant cinq à dix ans s’il est bien toléré et efficace ; il est relayé après l’âge de 70 ans par un bisphosphonate.
Prévention de l’ostéoporose : que proposer ?
Il est essentiel de se préoccuper de l’ostéoporose chez les femmes dès la ménopause et dans les deux sexes en présence de facteurs de risque, grâce :
- au recueil des facteurs de risque et leur éviction si possible ;
- à la réalisation d’une densitométrie osseuse ;
- à la prévention des chutes ;
- aux mesures hygiénodiététiques classiques (apports suffisants en calcium, en protéines et en vitamine D si nécessaire et réalisation d’une activité physique en charge régulièrement).
1. Spécificités de l’ostéoporose chez l’homme
L’ostéoporose est plus rare chez l’homme que chez la femme, pour trois raisons principales :
- le pic de masse osseuse est plus élevé chez l’homme ;
- il n’y a pas d’équivalent hormonal chez l’homme ;
- l’espérance de vie de l’homme est plus faible.
Cependant, 25 % des fractures de fragilité osseuse surviennent chez les hommes et un homme sur cinq de plus de 50 ans aura une fracture ostéoporotique. Par ailleurs, les conséquences des fractures sont plus graves chez les hommes que chez les femmes (risque de décès post-fracture majoré de 50 à 70 %). L’incidence des fractures devient exponentielle après l’âge de 70 ans.
La perte osseuse chez l’homme est liée avant tout à une diminution de la formation osseuse entraînant l’amincissement des travées osseuses.
L'ostéoporose masculine est le plus souvent secondaire : les causes les plus fréquentes sont les maladies inflammatoires avec corticothérapie prolongée, l’hypogonadisme spontané ou iatrogène, la maladie alcoolique, la bronchopneumopathie chronique obstructive.
Malgré sa fréquence et ses conséquences, l’ostéoporose reste une maladie sous-diagnostiquée et sous-traitée chez les hommes. Dans l’étude française FRACTOS, seuls 4,6 % des hommes hospitalisés pour fracture ostéoporotique ont eu au moins une délivrance de traitement spécifique de l’ostéoporose dans les douze mois suivant la fracture index contre 20,8 % des femmes.1
La prescription d’un traitement antiostéoporotique en France après fracture de hanche est en baisse et est inférieure à celle de la plupart des autres pays. Ainsi, la survenue d’une fracture, complication évidente de la fragilité osseuse, modifie peu la prise en charge de l’ostéoporose de ces patients. Les fractures sont considérées le plus souvent comme accidentelles chez les hommes, sans nécessité de réaliser un bilan de fragilité osseuse, ni de proposer un traitement anti-ostéoporotique spécifique.
Les traitements anti-ostéoporotiques ayant l’autorisation de mise sur le marché chez l’homme en France sont le tériparatide 20 µg, en injection sous-cutanée quotidienne, l’acide zolédronique 5 mg en perfusion unique annuelle, le risédronate 35 mg en administration per os hebdomadaire. Le dénosumab a une indication dans le traitement de l’ostéoporose chez l’homme, mais il n’est pas remboursé.
La testostérone n’est pas un traitement de l’ostéoporose masculine et ne doit pas être prescrite au titre de cette indication chez les hommes hypogonadiques à haut risque de fracture.
Les indications thérapeutiques chez les hommes sont semblables à celles des femmes :
- en cas de fracture ostéoporotique sévère quel que soit l’âge ;
- en cas de fracture ostéoporotique non sévère (poignet et autres sites) si le T-score de DMO est inférieur ou égal à - 2 ;
- en l’absence de fracture de faible traumatisme, chez un patient avec un T-score inférieure ou égal - 3.14
2. Traitement de l’ostéoporose et soins dentaires
Bien que très rare dans l’ostéoporose, l’ostéonécrose de la mâchoire induite par les antirésorbeurs (bisphophonates, dénosumab) est un événement indésirable qui peut constituer un frein à la prescription et à l’observance du traitement.
L’ostéonécrose se définit par une exposition intra-orale de l’os maxillaire de plus de huit semaines chez un patient traité par bisphosphonates ou dénosumab et n’ayant pas d’antécédent de radiothérapie locale, ni de maladie métastatique des maxillaires. Cette lésion osseuse peut survenir spontanément ou être, plus souvent, induite par un traumatisme tel qu’une avulsion dentaire.Le risque d’ostéonécrose de la mâchoire sous bisphosphonates ou dénosumab utilisés pour une ostéoporose est proche de celui en population générale avec une incidence comprise entre 0,02 % (2 patients pour 10 000, risque identique aux groupes placebo) et 0,05 %.15 Ce risque est très différent du risque d’ostéonécrose de la mâchoire observé en cancérologie qui est de 1 à 15 % patients-année, car la posologie utilisée dans ces indications tumorales est 5 à 10 fois supérieure (acide zolédronique 12 à 48 mg/an, dénosumab 1 440 mg/an).
Le risque d’ostéonécrose de la mâchoire dépend de la dose cumulée, de la durée de traitement (durée > 5 ans ; survient parfois à distance), des comorbidités (corticothérapie, immunosuppresseurs, tabagisme, diabète) et de la santé orale préexistante (foyers infectieux, prothèse amovible inadaptée, parodontite, péri-implantite).
Les soins dentaires ne doivent pas différer la mise sous traitement antiostéoporotique dès lors que le patient a des antécédents de fracture car le risque de refracture est bien supérieur à celui de développer une ostéonécrose de la mâchoire.
Il n’y a pas d’intérêt à interrompre le traitement par bisphosphonates avant un soin dentaire.
Des consultations régulières chez le dentiste comme en population générale et l’autosurveillance des symptômes (douleurs dentaires, mobilité dentaire de survenue rapide, retard de cicatrisation osseuse) sont le moyen le plus efficace de prévenir l’apparition d’une ostéonécrose de la mâchoire.
Que dire à vos patients ?
L’ostéoporose est une maladie osseuse chronique entraînant une fragilité osseuse et un risque de fracture en tombant de sa hauteur.
Chaque fracture ostéoporotique augmente le risque de survenue d’une nouvelle fracture avec des conséquences fonctionnelles de plus en plus graves, d’où l’importance de suivre le traitement prescrit.
À titre préventif, l’activité physique régulière, telle que la marche à pied, est nécessaire, à raison de deux à quatre heures par semaine. Manger des produits laitiers est essentiel pour une bonne santé osseuse et n’augmente pas le risque cardiovasculaire ni le risque de cancer.
à titre curatif, un traitement médicamenteux est indispensable, très bien toléré et très efficace pour diminuer l’incidence de nouvelles fractures.
2. Briot K, Cortet B, Roux C, et al. Actualisation 2014 des recommandations sur la prévention et le traitement de l’ostéoporose cortico-induite. Re Rhum 2014;81(5):385-94.
3. Bouvard B, Confavreux CB, Briot K, et al. French recommendations on strategies for preventing and treating osteoporosis induced by adjuvant breast cancer therapies. Joint Bone Spine 2019;86(5):542-53.
4. Briot K, Paccou J, Beuzeboc P, et al. French recommendations for osteoporosis prevention and treatment in patients with prostate cancer treated by androgen deprivation. Joint Bone Spine 2019;86(1):21-8.
5. Biver E, Herrou J, Larid G, et al. Recommandations alimentaires dans le cadre de la prévention et du traitement de l'ostéoporose. Rev Rhum 2023;90(4):405-25.
6. Black DM, Delmas PD, Eastell R, et al. Once-yearly zoledronic acid for treatment of postmenopausal osteoporosis. N Engl J Med 2007;356(18):1809-22.
7. Neer RM, Arnaud CD, Zanchetta JR, et al. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med 2001;344:1434-41.
8. Black DM, Cummings SR, Karpf DB, et al. Randomised trial of effect of alendronate on risk of fracture in women with existing vertebral fractures. Fracture Intervention Trial Research Group. Lancet 1996;348:1535-41.
9. Harris ST, Watts NB, Genant HK, et al. Effects of risedronate treatment on vertebral and nonvertebral fractures in women with postmenopausal osteoporosis: A randomized controlled trial. Vertebral Efficacy With Risedronate Therapy (VERT) Study Group. JAMA 1999;282:1344-52.
10. Ettinger B, Black DM, Mitlak BH, et al. Reduction of vertebral fracture risk in postmenopausal women with osteoporosis treated with raloxifene: Results from a 3-year randomized clinical trial. Multiple Outcomes of Raloxifene Evaluation (MORE) Investigators JAMA 1999;282:637-45.
11. Cummings SR, San Martin J, McClung MR, et al. Denosumab for prevention of fractures in postmenopausal women with osteoporosis. N Engl J Med 2009;361:756-65.
12. Briot K, Roux C, Thomas T, et al. Actualisation 2018 des recommandations françaises du traitement de l’ostéoporose post-ménopausique. Rev Rhum 2018;85:428-40.
13. Lyles KW, Colón-Emeric CS, Magaziner JS, et al. Zoledronic Acid and Clinical Fractures and Mortality after Hip Fracture. N Engl J Med 2007;357:1799-809.
14. Bouvard B, Briot K, Legrand E, et al. Recommandations françaises de la prise en charge et du traitement de l’ostéoporose masculine. Rev Rhum 2021;88:173-82.
15. Ruggiero SL, Dodson TB, Aghaloo T, et al. American Association of Oral and Maxillofacial Surgeons’ Position Paper on Medication-Related Osteonecrosis of the Jaws-2022 Update. J Oral Maxillofac Surg 2022;80:920-43.

 Encadrés
Encadrés