En France, environ 18 000 patients sont hospitalisés chaque année pour la prise en charge d’une pancréatite aiguë (PA).1 L’incidence dans le monde est estimée à 34 pour 100 000 personnes.2 La mortalité globale, toutes formes confondues, est de 1 % mais peut atteindre plus de 30 % en cas de PA nécrosante. Il est donc recommandé d’hospitaliser de manière systématique toute personne atteinte de pancréatite afin d’évaluer la sévérité potentielle, même si 80 % sont bénignes. La consommation chronique d’alcool et l’origine biliaire en sont les deux principales causes.
Diagnostic positif de pancréatite aiguë
La douleur pancréatique typique est épigastrique, transfixiante, intense, permanente avec une cinétique rapidement progressive et exacerbée par la prise alimentaire. La position antalgique est en chien de fusil. Dans la moitié des cas, des vomissements sont associés avec, dans 30 % des cas, un iléus réflexe.
Le diagnostic positif repose sur l’association de deux des trois critères suivants :3
- douleur typique ;
- élévation de la lipasémie à plus de trois fois la norme supérieure. En cas de prise en charge retardée (plus de quarante-huit heures après le début des douleurs), la lipasémie peut s’être normalisée. Le diagnostic ne doit pas être remis en cause en cas de douleur typique pancréatique, 10 % des pancréatites aiguës n’étant pas associées à une élévation de la lipasémie ;
- anomalies morphologiques radiologiques typiques.
Évaluation de la gravité
Les PA sont classées en trois catégories (classification d’Atlanta 2012)4 selon leur niveau de gravité :
- bénigne (80 % des cas) sans défaillance d’organes ni complications locales ;
- modérément sévère avec une défaillance d’organes transitoire durant moins de quarante-huit heures ou avec présence de complications locales ;
- sévère avec défaillance d’organes simple ou multiple pendant plus de quarante-huit heures.
Avant tout fondée sur la clinique
L’évaluation de la gravité d’une pancréatite aiguë est avant tout clinique. Les facteurs de risque de PA sévère sont :
- un âge supérieur à 70 ans ;
- l’obésité (indice de masse corporelle [IMC] supérieur à 30 kg/m2) ;
- l’insuffisance d’organes préexistante, notamment l’insuffisance rénale chronique ;
- la dénutrition ;
- l’immunodépression.
Les signes généraux indiquent une défaillance hémodynamique (pression artérielle moyenne [PAM] inférieure à 65 mmHg), pulmonaire (polypnée supérieure à 22 cycles/min, pression partielle en oxygène dans le sang artériel [PaO2] inférieure à 60 mmHg, saturation en oxygène inférieure à 92 %), neurologique (score de Glasgow < 13) ou rénale (oligo-anurie).
Il faut rechercher la présence d’un syndrome de réponse inflammatoire systémique (SIRS), soit deux critères parmi les suivants :
- une température inférieure à 36 °C ou supérieure à 38 °C ;
- une fréquence cardiaque supérieure à 90 batt/min ;
- une fréquence respiratoire supérieure à 20 cycles/min ou une PaCO2 inférieure à 32 mmHg ;
- une leucocytose supérieure à 12 000/mm3 ou inférieure à 4 000/mm3.
Le dosage de la protéine C réactive (CRP) à quarante-huit heures peut avoir une valeur prédictive de sévérité. En cas de taux inférieur à 150 mg/L, la valeur prédictive négative est de 94 %. Une concentration supérieure à 300 mg/L n’influence pas le pronostic mais doit faire rechercher une complication locale.4
Score modifié de sévérité scanographique
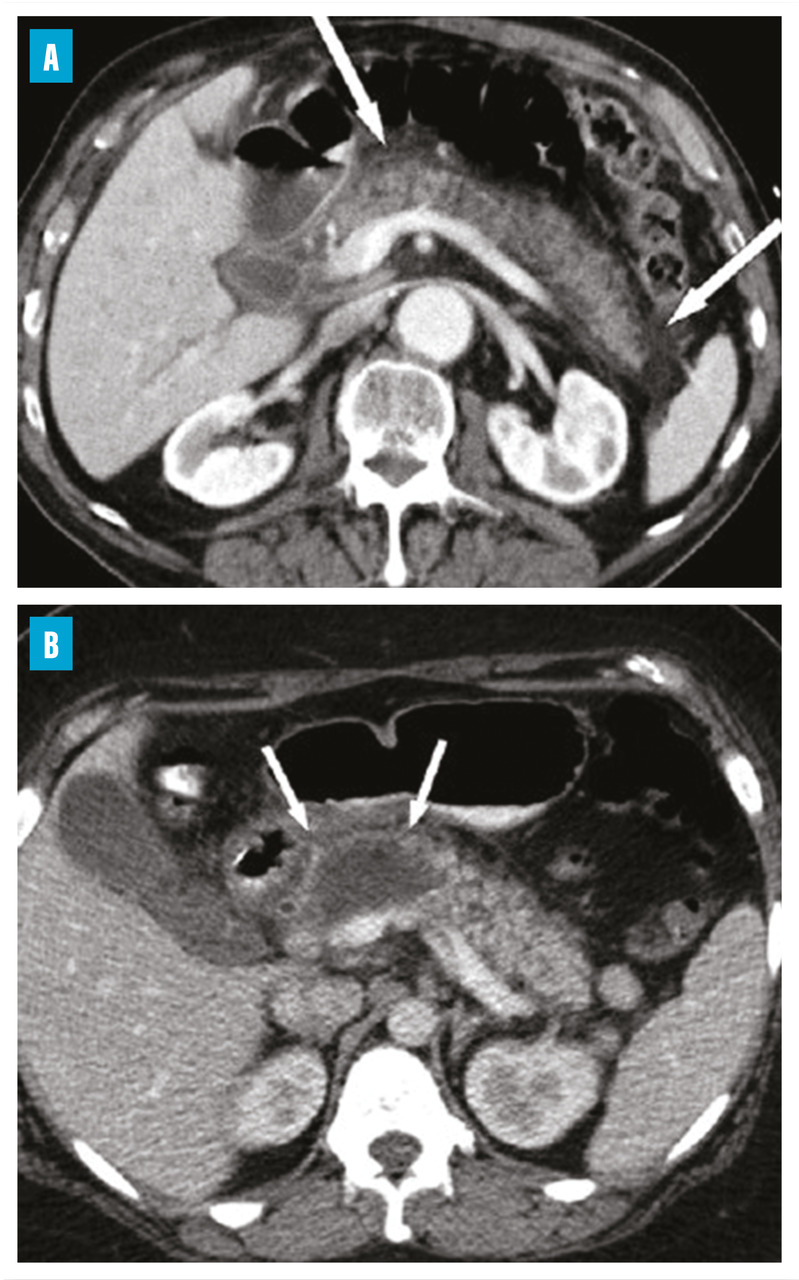
La scanographie (sans et avec injection de produit de contraste) est l’examen de référence dans l’évaluation morphologique de la gravité avec l’évaluation de l’inflammation et de la nécrose de la glande (figure). Elle ne doit être réalisée que soixante-douze heures après le début des symptômes pour ne pas sous-évaluer les lésions (tableau).5
Bilan étiologique
Les causes de PA sont dominées par l’intoxication alcoolique (40 %) et l’origine biliaire (40 %). La recherche de la cause dépend de la présence de lésions préexistantes de pancréatite chronique (PC), de l’âge et du terrain du patient, de ses antécédents personnels et familiaux.
Origine alcoolique
Une origine alcoolique peut être retenue en cas d’intoxication prolongée (depuis plus de dix ans) et importante (en moyenne supérieure à 50 g/j).
Il faut savoir ne pas conclure trop rapidement à une origine alcoolique, notamment dans les situations suivantes :
- tableau atypique avec consommation inférieure à 50 g/j (soit 5 unités d’alcool/j) et/ou depuis moins de dix ans ;
- PA sur pancréatite chronique alcoolique ancienne asymptomatique depuis de nombreuses années. Il faut alors chercher une cause surajoutée, notamment une tumeur ;
- survenue tardive d’une première PA au cours d’une intoxication alcoolique ancienne toujours asymptomatique. Il faut alors chercher une origine tumorale ;
- PA précoce au cours d’une intoxication alcoolique chronique récente. Il faut chercher des facteurs favorisants associés (génétiques, tabagisme actif important, variation anatomique, tumeur…).
Maladie lithiasique
Une origine biliaire doit être évoquée systématiquement et doit toujours être écartée avant de chercher une cause plus rare. Des tests hépatiques (ASAT, ALAT, GGT, PAL et bilirubinémie) doivent être pratiqués dès l’admission, ainsi qu’une échographie des voies biliaires et de la vésicule biliaire. La présence d’une cytolyse dans les quarante-huit heures après le début des douleurs doit faire évoquer la cause biliaire jusqu’à preuve du contraire. En cas de récidive de pancréatite aiguë biliaire après cholécystectomie, a fortiori dans un contexte familial, il faut évoquer le syndrome LPAC (low-phospholipid associated cholelithiasis syndrome).
Tumeur pancréatique maligne ou bénigne, solide ou kystique
Une origine tumorale doit être traquée, notamment chez les patients âgés de plus de 40 ans, si la cause biliaire ou alcoolique n’est pas retenue. Ainsi, 10 % des adénocarcinomes du pancréas se révèlent par une PA dans les deux ans précédant le diagnostic de cancer. Il faut répéter les examens d’imagerie à distance des phénomènes inflammatoires (tomodensitométrie [TDM]/imagerie par résonance magnétique [IRM]/échoendoscopie) à un mois.6
Causes rares de PA
Les causes non alcoolique, non biliaire et non tumorale de PA peuvent relever de processus inflammatoires chroniques d’origines diverses : auto-immune (maladie à IgG4), dysmétabolique (hypercalcémie et hypertriglycéridémie), obstructive canalaire sur malformation, génétique, d’origine biliaire secondaire à une bile lithogène (syndrome LPAC), toxique médicamenteuse, notamment immuno-induite, iatrogène post-cholangiopancréatographie rétrograde endoscopique (CPRE), ou encore en lien avec une dysfonction du sphincter d’Oddi.
Ces causes sont à évoquer selon l’âge du patient, le terrain, les antécédents personnels et familiaux.
Un bilan d’imagerie complet par TDM, IRM et échoendoscopie permet d’éliminer une large partie de ces diagnostics.
Prise en charge adaptée à la gravité et à la cause
Initiale, selon la gravité
Les PA bénignes constituent 80 % des cas. Il n’y a pas de critères de gravité. La prise en charge est simple et consiste en :
- la mise à jeun tant que les douleurs persistent, puis la reprise progressive de l’alimentation dès que possible, dès l’arrêt des douleurs, sauf en cas de pancréatite aiguë biliaire (voir plus loin) ;
- une hydratation standard pour couvrir les besoins liés au jeûne. De nombreux essais randomisés7 ont confirmé l’absence de bénéfice clinique d’une hyperhydratation agressive en cas de PA bénigne ; cela ne permet pas de diminuer la mortalité (déjà quasi nulle) ou les complications loco-régionales ;
- une antalgie adaptée aux douleurs, des paliers 1 à 3 ;
- une anticoagulation préventive.
Il n’y a aucun intérêt à contrôler la lipasémie. Il n’y a pas d’intérêt à maintenir un régime sans graisses.
Les PA modérément sévères ou sévères regroupent 20 % des cas. Par définition, le patient présente une défaillance d’organes transitoire ou permanente, ce qui requiert une hospitalisation en unité de soins continus, voire en réanimation, selon la gravité. Il faut instaurer une hydratation dite agressive dès les premières heures pour lutter contre l’hypovolémie en privilégiant la solution de lactate de Ringer. Le débit est adapté selon les paramètres hémodynamiques du patient. Les objectifs cliniques sont une pression artérielle moyenne supérieure à 65 mmHg et un taux de lactate sérique inférieur à 2 mmol/L. Il faut également instaurer une anticoagulation préventive ou curative en cas de mise en évidence d’une thrombose vasculaire.
Un apport nutritionnel doit être mis en place dès le premier jour de la prise en charge pour lutter contre la dénutrition et la translocation bactérienne, source d’infection de nécrose survenant deux à trois semaines après le début des douleurs. L’apport nutritionnel doit se faire de façon exclusive par le tube digestif, soit per os si l’état clinique du patient le permet et si l’objectif calorique est atteint, soit par la pose d’une sonde de nutrition entérale en site gastrique.8
Il n’y a aucune indication à une antibiothérapie prophylactique pour limiter le risque de surinfection ou de nécrose à distance. De même, il n’y a aucune indication à l’usage de probiotiques à visée prophylactique.9,10
En fonction de la cause
PA biliaire
Toutes les recommandations d’experts préconisent la réalisation d’une cholécystectomie au cours de la même hospitalisation, ce geste ne doit en aucun cas être différé. L’essai PONCHO a clairement démontré le risque de récidive de complication biliaire ou de mortalité supérieure à 17 % dans les quatre semaines qui suivent la réalimentation si l’intervention n’a pas été effectuée.11
Il n’y a aucune indication à une sphinctérotomie d’urgence en cas de PA biliaire afin de limiter le risque de morbidité ou mortalité à distance. La seule indication à une sphinctérotomie en urgence est une angiocholite confirmée sur calcul enclavé dans les voies biliaires.12,13
PA alcoolique
Une évaluation addictologique est nécessaire dans le but d’obtenir un sevrage complet en alcool ET en tabac, cofacteur, afin de prévenir au maximum le risque de récidive et d’évolution en pancréatite chronique.
PA sur hypertriglycéridémie
Il faut s’assurer de la normalisation du taux sérique. Pour accélérer le retour à la norme, il a été suggéré soit une héparinothérapie, soit une bithérapie (glucose et insulinothérapie). Ces deux attitudes ne sont pas validées et restent débattues. Il n’existe pas de recommandations d’experts. Dans les formes graves, les échanges plasmatiques montreraient un bénéfice clinique en cas de taux de triglycérides sériques toujours supérieurs à 5 mmol/L après quarante-huit à soixante-douze heures.14
Complications de court ou moyen terme et suivi
Dans le cadre des pancréatites sévères, 40 à 60 % des décès surviennent au cours de la première semaine et sont dus à l’intensité de la réaction inflammatoire et des défaillances d’organes (syndrome de détresse respiratoire aiguë, insuffisance rénale).
Après la deuxième semaine, les complications sont surtout en lien avec l’infection de la nécrose pancréatique par translocation bactérienne. Les complications infectieuses concernent 20 à 40 % des pancréatites aiguës nécrosantes, qui sont responsables de 50 à 80 % des décès. Il existe un rare risque de complication hémorragique, avec ruptures de pseudo-anévrismes.
À plus long terme, il existe un surrisque d’insuffisance pancréatique exocrine (de 5 à 50 % selon la gravité) et endocrine avec un risque de diabète plus important après pancréatite aiguë nécrosante (de 10 à 20 %) qu’il convient de dépister.15
Pancréatite aiguë récidivante
La première cause à éliminer en cas de pancréatite aiguë récidivante est une tumeur.
Dans un contexte éthylotabagique, il faut chercher une pancréatopathie chronique sous-jacente.
En cas de pancréatite aiguë biliaire récidivante après cholécystectomie, il faut rechercher un syndrome LPAC.
Chez les enfants ou jeunes adultes, après avoir éliminé la prise de toxiques, les deux causes principales à évoquer sont :
- une pancréatite auto-immune de type 1 (maladie à IgG4) ou de type 2 (associée à une maladie inflammatoire chronique de l’intestin [MICI] dans plus de 30 % des cas) ;
- une origine génétique.
2. Petrov MS, Yadav D. Global epidemiology and holistic prevention of pancreatitis. Nat Rev Gastroenterol Hepatol 2019;16(3):175‑84.
3. Working Group IAP/APA Acute Pancreatitis Guidelines. IAP/APA evidence-based guidelines for the management of acute pancreatitis. Pancreatol Off J Int Assoc Pancreatol IAP Al 2013;13(4 Suppl 2):e1-15.
4. Banks PA, Bollen TL, Dervenis C, et al. Classification of acute pancreatitis--2012: Revision of the Atlanta classification and definitions by international consensus. Gut 2013;62(1):102‑11.
5. Mortele KJ, Wiesner W, Intriere L, et al. A modified CT severity index for evaluating acute pancreatitis: Improved correlation with patient outcome. AJR Am J Roentgenol 2004;183(5):1261‑5.
6. Ma DM, Dong XW, Han X, et al. Pancreatitis and pancreatic cancer risk. Technol Cancer Res Treat 2023;22:15330338231164875.
7. de-Madaria E, Buxbaum JL, Maisonneuve P, et al. Aggressive or moderate fluid resuscitation in acute pancreatitis. N Engl J Med 2022;387(11):989‑1000.
8. Eatock FC, Chong P, Menezes N, et al. A randomized study of early nasogastric versus nasojejunal feeding in severe acute pancreatitis. Am J Gastroenterol 2005;100(2):432‑9.
9. Villatoro E, Mulla M, Larvin M. Antibiotic therapy for prophylaxis against infection of pancreatic necrosis in acute pancreatitis. Cochrane Database Syst Rev 2010;2010(5):CD002941.
10. Besselink MG, van Santvoort HC, Buskens E, et al. Probiotic prophylaxis in predicted severe acute pancreatitis: A randomised, double-blind, placebo-controlled trial. Lancet Lond Engl 2008;371(9613):651‑9.
11. da Costa DW, Bouwense SA, Schepers NJ, et al. Same-admission versus interval cholecystectomy for mild gallstone pancreatitis (PONCHO): A multicentre randomised controlled trial. Lancet Lond Engl 2015;386(10000):1261‑8.
12. Schepers N, Hallensleben N, Besselink M, et al. Urgent endoscopic retrograde cholangiopancreatography with sphincterotomy versus conservative treatment in predicted severe acute gallstone pancreatitis (APEC): A multicentre randomised controlled trial. Lancet UK 2020;396(10245):167‑76.
13. Hallensleben ND, Stassen PMC, Schepers NJ, et al. Patient selection for urgent endoscopic retrograde cholangio-pancreatography by endoscopic ultrasound in predicted severe acute biliary pancreatitis (APEC-2): A multicentre prospective study. Gut 2023;72(8):1534‑42.
14. Click B, Ketchum AM, Turner R, et al. The role of apheresis in hypertriglyceridemia-induced acute pancreatitis: A systematic review. Pancreatol Off J Int Assoc Pancreatol IAP Al 2015;15(4):313‑20.
15. Lankisch PG, Apte M, Banks PA. Acute pancreatitis. The Lancet 2015;386(9988):85‑96.

 Encadrés
Encadrés