On estime que 1 à 5 % des couples sont concernés par des fausses couches spontanées à répétition (FCSR). Cependant, la définition diffère selon les sociétés savantes, et les causes et facteurs de risque ne sont pas tous clairement établis. Ainsi, leur prise en charge n’est pas consensuelle, ce qui peut induire de la frustration chez les couples et les soignants. L’objectif, ici, est de faire le point sur les différentes définitions et les facteurs pouvant induire une perte répétée de grossesses, sur les explorations qu’il est possible de proposer ainsi que sur la prise en charge de première intention.
Plusieurs définitions possibles
Une perte de grossesse, appelée couramment fausse couche, est définie selon la Société européenne de reproduction humaine et d’embryologie (ESHRE) comme une interruption spontanée de la grossesse avant 24 semaines d’aménorrhée (SA), qui correspond au terme de viabilité fœtale.1 La définition de pertes de grossesse à répétition n’est pas consensuelle et varie selon les sociétés savantes et les pays.
Le Collège royal des gynécologues obstétriciens de langue française de Belgique a retenu, en 2011, la définition suivante : survenue de trois fausses couches successives au premier trimestre de la grossesse.
En 2014, le Collège national des gynécologues et obstétriciens français (CNGOF) a défini les FCSR comme l’expulsion spontanée d’au moins trois grossesses intra-utérines avant 14 SA. Cependant, cette définition exclut les grossesses arrêtées nécessitant une intervention médicale ou chirurgicale pour l’expulsion, ainsi que les pertes de grossesses tardives.
En 2017, l’International Committee for Monitoring Assisted Reproductive Technologies (ICMART) parle, quant à lui, de deux pertes fœtales avant 22 SA. Cependant, devant un nombre insuffisant de données épidémiologiques robustes justifiant cette définition, l’ESHRE a proposé en 2023 qu’un diagnostic de perte de grossesse à répétition pourrait être considéré après la perte d’au moins deux grossesses avant 24 SA.1
Ces différentes définitions conditionnent les recommandations concernant l’exploration et la prise en charge des fausses couches spontanées à répétition.
Nombreux sont les facteurs de risque et les causes
De nombreux facteurs de risque sont clairement identifiés dans les fausses couches spontanées (FCS) isolées, mais leur imputabilité est rarement étudiée pour les FCSR. De plus, les consensus d’experts ne sont pas unanimes quant à leur implication et prise en charge, et la prévalence de ces différentes causes est mal connue. Si l’âge maternel est le principal facteur de risque de pertes de grossesse, l’âge paternel, le nombre de FCS antérieures, le mode de vie et l’environnement sont également des facteurs de risque identifiés. Le tableau 1 résume les principaux facteurs de risque retrouvés dans la littérature.
Âge maternel, facteur de risque majeur
L’âge maternel est le facteur de risque majeur de perte de grossesse et de pertes de grossesses à répétition. En effet, la qualité ovocytaire diminue avec l’âge, induisant une augmentation du risque d’anomalies chromosomiques embryonnaires et, par conséquent, de FCS. Une étude prospective publiée en 2019, menée sur 421 201 grossesses, a mis en évidence que le taux de FCS (défini par une perte de grossesse avant 20 SA) chez les femmes de 25 à 29 ans est d’environ 10 % et qu’il augmente rapidement après 30 ans, pour atteindre 53 % chez les femmes âgées de plus de 45 ans.2 Dans une étude de cohorte prospective réalisée chez des patientes ayant des antécédents de FCSR, les auteurs ont montré que le pronostic dépendait essentiellement de l’âge maternel, mais aussi du nombre de pertes de grossesse antérieures.3 L’impact du nombre de FCS antérieures sur le risque de fausse couche spontanée lors de la grossesse suivante a été confirmé par différentes études, dont celles de Magnus et al. qui ont montré que le risque de FCS est significativement plus important chez les femmes qui ont eu des fausses couches antérieures (tableau 2).3
Âge paternel : un facteur de risque controversé
L’impact de l’âge paternel sur le risque de perte de grossesse est plus controversé. En effet, une méta-analyse publiée en 2020 a montré qu’un âge paternel élevé était associé à un risque augmenté de fausse couche.4 Cependant, à l’heure actuelle, il n’y a pas d’étude visant à comprendre le lien entre âge paternel et FCSR.1
Rôle possible de l’environnement
Le mode de vie et l’environnement dans lequel évolue le couple a également une incidence sur les chances de naissance vivante et le risque de FCS.5
Le tabac est fortement associé à des issues obstétricales et néonatales défavorables (grossesse extra-utérine, mort fœtale in utero, placenta praevia, prématurité, petit poids de naissance, malformations congénitales…). Ainsi, un sevrage tabagique est recommandé pour toutes les femmes enceintes. L’effet du tabac ou du sevrage tabagique reste également discuté chez les patientes ayant des pertes de grossesse à répétition, bien qu’une étude finlandaise récente réalisée chez des couples avec antécédent de FCSR ait montré que la consommation maternelle de tabac apparaissait comme un facteur de mauvais pronostic sur les taux de naissances vivantes.5
La consommation d’alcool est un facteur de risque de perte de grossesse et un facteur de risque prouvé d’anomalies congénitales (syndrome d’alcoolisation fœtale).6 Cependant, il est difficile de déterminer la quantité d’alcool potentiellement à risque d’induire des FCS. Il doit donc être conseillé au couple d’en limiter la consommation dès le projet de grossesse.
D’autres facteurs de risque liés à l’environnement, tels que le stress maternel ou la consommation de caféine, pourraient avoir un impact sur l’issue de la grossesse, mais aucune donnée de haut niveau de preuve n’a à ce jour mis en évidence d’effet délétère direct concernant les pertes de grossesse.
Variations extrêmes de poids, péjoratives chez l’homme comme chez la femme
Les variations pondérales extrêmes, chez l’homme comme chez la femme, ont également un impact significatif sur la fertilité et les risques de FCS.
Chez la femme, un indice de masse corporelle (IMC) augmenté, au-dessus de 30 kg/m2, est associé non seulement aux pertes de grossesses mais aussi aux complications obstétricales.
Un rôle péjoratif de l’obésité paternelle sur les naissances vivantes chez des couples ayant des antécédents de FCSR a également été rapporté.5
Causes génétiques, anatomiques et métaboliques
Les autres facteurs de risque peuvent être classés en causes génétiques, anatomiques, endocrinologiques ou thrombophiliques.1
Anomalies chromosomiques
Les aneuploïdies embryonnaires, ou anomalies du nombre de chromosomes, sont des facteurs de risque majeurs de FCS. Si elles sont majoritairement liées à l’âge maternel, des anomalies chromosomiques parentales, comme des translocations, peuvent également être à l’origine de déséquilibres chromosomiques embryonnaires.
Causes anatomiques
Les anomalies utérines congénitales (utérus cloisonné, utérus unicorne ou bicorne) mais aussi les anomalies acquises comme les myomes intra-cavitaires (FIGO type 0, 1 ou 2) et les polypes sont également des facteurs de risque de FCS. L’impact de l’adénomyose et de l’endométrite chronique sur le risque de FCSR est en cours d’évauation.
Causes endocrinologiques
Les pathologies thyroïdiennes, et surtout l’hypothyroïdie ou la présence d’auto-anticorps, sont des facteurs de risque reconnus. Les études concernant les autres pathologies endocriniennes, comme l’hyperprolactinémie sans trouble du cycle, le syndrome des ovaires polykystiques et l’insulinorésistance, la carence en vitamine D, B9, B12 ou l’hyper-homo-cystéinémie n’ont pas permis de mettre en évidence une vraie association avec le risque de FCSR.
Thrombophilies
Le syndrome des antiphospholipides est une cause connue de FCSR. En revanche, il existe une faible association entre thrombophilie héréditaire (mutation du facteur V, du facteur II, déficit en protéines C, S ou antithrombine) et risque de perte de grossesse.
Quand proposer un bilan ?
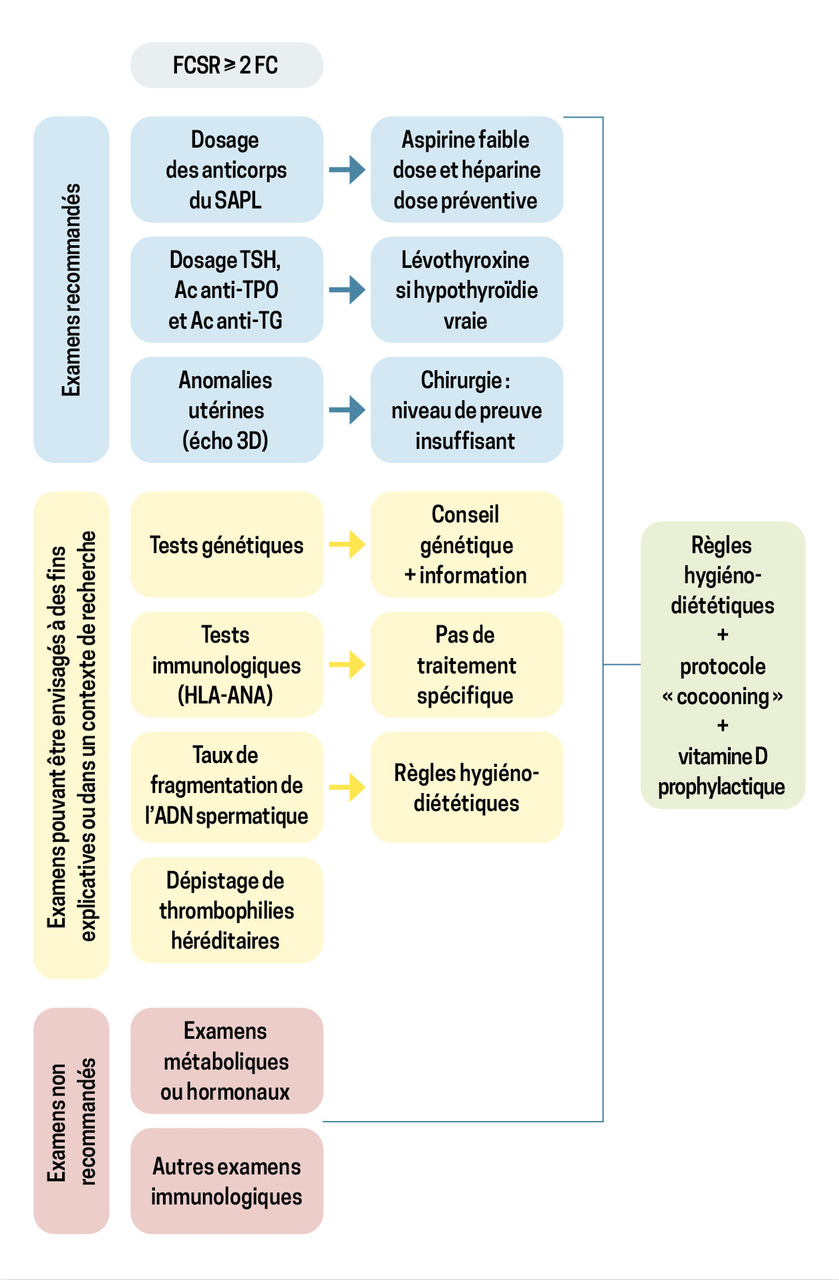
En se fondant sur les définitions émises par les différentes sociétés savantes concernant les FCSR, il semble légitime de proposer un bilan complémentaire à toute patiente ayant un antécédent d’au moins deux pertes de grossesse. Ce bilan vient en complément d’un interrogatoire complet, centré notamment sur le mode de vie des couples. Il vise à dépister les facteurs potentiellement impliqués dans les pertes de grossesse afin, d’une part, d’apporter une information aux couples et, d’autre part, de mettre en place un traitement adapté. Cependant, dans un grand nombre de cas, le bilan complémentaire ne met pas en évidence d’anomalie particulière.
Consensus sur le bilan de première intention
Comme pour les définitions, le bilan recommandé par les différentes sociétés savantes n’est pas consensuel, hormis le bilan de première intention, à réaliser systématiquement pour dépister des situations pour lesquelles le traitement a prouvé son intérêt dans la diminution du risque de fausse couche ultérieure :
- TSH, anticorps antithyropéroxidase (anticorps anti-TPO), anticorps antithyroglobuline (anti-corps anti-TG) ;
- recherche d’un syndrome des antiphospholipides (recherche des anticorps anti-B2GP1, anticorps anticardiolipine [ACL], anticorps anticoagulant circulant de type lupique [ACC]) ;
- réalisation d’une échographie pelvienne avec reconstruction en trois dimensions de l’utérus, à la recherche d’une malformation, qu’elle soit congénitale ou acquise. Une hystérosonographie peut également être effectuée dans le même temps, ou une hystéroscopie diagnostique peut être proposée pour analyser la cavité utérine.
Compléter le bilan en fonction de la situation
Selon les différentes recommandations, d’autres explorations peuvent être proposées. Celles-ci doivent être adaptées à des situations particulières ou être réalisées dans le cadre d’un protocole de recherche.
D’autres bilans simples sont recommandés par certaines sociétés savantes alors que la prise en charge n’a pas fait la preuve de son efficacité pour diminuer les risques de FCR ultérieure. Cependant, cela peut permettre d’identifier une cause possible de FCSR, et donc de rassurer les couples. Parmi ces bilans, on retrouve :
- la recherche d’une thrombophilie héréditaire, qui ne doit pas être réalisée systématiquement mais proposée en cas d’antécédents personnels ou familiaux évocateurs ;
- la recherche du taux de fragmentation de l’ADN spermatique chez le conjoint (non remboursée) ;
- la réalisation du caryotype des deux membres du couple ;
- d’autres analyses immunologiques ;
- le contrôle de la glycémie à jeun, voire de l’HbA1c ;
- un dosage de la prolactinémie ainsi que des vitamines B9, B12 et de l’homocystéinémie.
L’analyse du produit de fausse couche n’est pas réalisée en routine.
La figure résume les bilans proposés, recommandés ou non, d’après les directives de l’ESHRE de 2023.1
Où réaliser ces bilans ?
Le premier bilan systématique peut être réalisé en ville sur prescription du médecin traitant, dès la perte de deux grossesses. Lorsqu’il y a plus de deux pertes de grossesse, les femmes doivent être adressées systématiquement à des médecins spécialisés.
Compte tenu de l’impact physique, sociologique et économique des fausses couches spontanées à répétition, plusieurs services spécialisés dans la prise en charge globale et multidisciplinaire de ces pertes de grossesse à répétition ont récemment vu le jour. Le bilan et la prise en charge peuvent se faire au sein de ces centres.
Il est important de rappeler qu’après réalisation d’un bilan exhaustif, la survenue des FCSR reste considérée comme idiopathique dans plus de 50 % des cas.6
Rôles du médecin généraliste
D’abord, rappeler les règles hygiénodiététiques
Il est primordial de souligner que la prise en charge hygiénodiététique est un axe clé pour les couples ayant des FCSR.1 Une information et une éducation sur le mode de vie, les habitudes alimentaires et la consommation alcoolo-tabagique est fondamentale. Les couples doivent être informés que le tabac peut avoir un impact négatif sur leurs chances de naissances vivantes et qu’un sevrage tabagique complet est par conséquent recommandé pour les deux membres du couple.
De même, une limitation de la consommation d’alcool est préconisée.
Une supplémentation prophylactique en vitamine D peut également être proposée systématiquement.
Le médecin traitant joue un rôle majeur tant dans le dépistage que dans l’éducation thérapeutique et la prise en charge des patients sur ces aspects.
Soutenir et rassurer
Le médecin traitant doit également rassurer les patientes sur leurs chances de grossesses futures menées à terme.3 Il doit soutenir les couples le vécu de plusieurs grossesses arrêtées pouvant avoir un impact majeur sur leur santé mentale.
Dans une étude menée au Danemark, 13 couples avec antécédent de fausses couches spontanées à répétition ont été interviewés ;7 ils expliquent souhaiter une reconnaissance de la part du corps médical concernant l’impact émotionnel qu’entraînent les fausses couches, et que la prise en charge proposée prenne en compte l’aspect psychologique.
Orienter à bon escient
Concernant les thérapeutiques à mettre en place, qu’elles soient liées aux résultats du bilan complémentaire ou empiriques, il est probablement raisonnable qu’elles soient prescrites et suivies par des médecins spécialisés.
Cependant, lorsqu’une anomalie a été mise en évidence sur le bilan de première intention, une thérapeutique adaptée peut être initiée par le médecin traitant, comme une supplémentation en cas d’hypothyroïdie.
En cas d’anomalie sur le bilan immunitaire ou d’anomalie utérine, les patientes doivent être adressées à des médecins spécialistes de la reproduction pour une prise en charge optimale.
Bilan sans anomalie : toujours supplémenter en progestérone ?
Lorsque le bilan ne montre aucune anomalie, certaines équipes proposent une supplémentation systématique par progestérone dès le début de la grossesse et jusqu’à 12 SA chez toutes les patientes ayant eu des FCSR.
Si les données publiées sont contradictoires quant à l’intérêt d’une telle supplémentation par voie vaginale, une étude récente a montré un bénéfice à son utilisation (400 mg deux fois par jour) en cas d’antécédent de trois fausses couches spontanées précoces ou de saignement lors du premier trimestre par rapport à un groupe placebo (différence significative sur le taux de naissances vivantes, avec 72 % dans le groupe progestérone contre 57 % dans le groupe placebo ; p = 0,004).8 Compte tenu de la balance bénéfice/risque, cette supplémentation peut être prescrite dans ce contexte et fait partie des nouvelles recommandations de l’ESHRE.1
Il existe par ailleurs de nombreux autres traitements qui ont été testés ou sont en cours d’étude. Ils peuvent être proposés dans un cadre hospitalier ou de protocoles de recherche. On peut citer, par exemple, l’aspirine, les héparines de bas poids moléculaire (HBPM), les corticoïdes, les immunothérapies... Cependant, ces derniers n’ont pas fait la preuve de leur efficacité et il n’est donc pas recommandé de les prescrire en routine. Il existe certaines dérogations à leur prescription, exceptionnelles et validées en réunions de concertation pluridisciplinaire.
En l’absence de cause identifiée, un suivi particulier
L’absence de cause identifiée dans la majorité des situations et le vécu traumatisant et répétitif de la grossesse arrêtée peuvent avoir un impact majeur sur le quotidien des couples ainsi que sur leur santé mentale. Il est donc primordial de proposer un accompagnement psychologique adapté.
Lors d’une nouvelle grossesse, un protocole dit de « cocooning » ou « tender loving care » peut être proposé au couple. Il s’agit d’un suivi clinique régulier alternant avec des échographies rapprochées, une semaine sur deux par exemple, permettant une écoute, une réassurance et un accompagnement. En effet, il est très difficile pour ces couples de supporter les premières semaines de grossesse étant donné leur passé douloureux. Ce suivi renforcé peut être réalisé par une sage-femme, un gynécologue ou un médecin généraliste ayant le diplôme d’échographie gynécologique.
Que dire à vos patients ?
Un suivi renforcé, appelé protocole « cocooning », peut être mis en place lors d’une prochaine grossesse pendant le premier trimestre.
Il convient de souligner l’importance des règles hygiénodiététiques.
Proposer un accompagnement psychologique (prise en charge par un psychologue, associations de patients) est indispensable.
Deux associations de patients existent :
- l’association Agapa accompagne et soutient les personnes confrontées à un deuil périnatal ou à une interruption de grossesse. Elle propose des séances de groupe de parole aussi bien en distanciel qu’en présentiel dans certaines villes. Il peut en effet être bénéfique de pouvoir écouter d’autres personnes ayant vécu des histoires similaires et de pouvoir s’exprimer sans crainte de jugement ;
- le collectif BAMP est une association de patients et d’ex-patients de l’assistance médicale à la procréation, de personnes infertiles ou stériles ayant recours aux techniques d’assistance médicale à la procréation. Elle s’adresse aux patientes en parcours d’infertilité faisant des fausses couches à répétition et partage des podcasts ainsi que des témoignages.
2. Magnus MC, Wilcox AJ, Morken NH, et al. Role of maternal age and pregnancy history in risk of miscarriage: prospective register-based study. BMJ 2019;364:l869.
3. Brigham SA, Conlon C, Farquharson RG. A longitudinal study of pregnancy outcome following idiopathic recurrent miscarriage. Hum Reprod Oxf Engl 1999;14(11):2868‑71.
4. Du Fossé NA, van der Hoorn MLP, van Lith JMM, et al. Advanced paternal age is associated with an increased risk of spontaneous miscarriage: A systematic review and meta-analysis. Hum Reprod Update 2020;26(5):650‑69.
5. Peuranpää PL, Gissler M, Peltopuro P, et al. The effect of paternal and maternal factors on the prognosis of live birth in couples with recurrent pregnancy loss. Acta Obstet Gynecol Scand 2022;101(12):1374‑85.
6. Morita K, Ono Y, Takeshita T, et al. Risk Factors and Outcomes of Recurrent Pregnancy Loss in Japan. J Obstet Gynaecol Res 2019;45(10):1997‑2006.
7. Koert E, Malling GMH, Sylvest R, et al. Recurrent pregnancy loss: couples’ perspectives on their need for treatment, support and follow up. Hum Reprod Oxf Engl 2019;34(2):291‑6.
8. Coomarasamy A, Harb HM, Devall AJ, et al. Progesterone to prevent miscarriage in women with early pregnancy bleeding: The PRISM RCT. Health Technol Assess Winch Engl 2020;24(33):1‑70.

 Encadrés
Encadrés