L’importance de la nutrition au cours des maladies rénales est connue depuis plus de cent cinquante ans. En effet, chez l’adulte, il n’y a pas de possibilités de stockage des protéines, contrairement aux glucides et lipides provenant de l’alimentation. Les protéines sont métabolisées pour le renouvellement tissulaire – notamment les fibres musculaires – et leur excès est transformé en urée, éliminée par les reins. En cas de maladie rénale, l’urée s’accumule dans le sang, selon le degré de fonction rénale et la quantité d’apports alimentaires. Ainsi, pour une même réduction de la fonction rénale, l’urée plasmatique dépend exclusivement de l’apport en protéines. Dans les sociétés occidentales, nous consommons beaucoup plus de protéines que nos besoins ne le nécessitent. Il est légitime de réduire cet apport afin de limiter l’intoxication urémique chez les patients atteints de maladie rénale.
Le rein est l’organe qui élimine la plupart des produits de dégradation issus de l’alimentation. De nombreuses études expérimentales et cliniques ont montré l’effet d’un repas riche en protéines sur l’augmentation de la filtration glomérulaire. Cette hyperfiltration transitoire peut s’apparenter à celle de l’hyperglycémie du diabète, et finit par entraîner des lésions glomérulaires et une fibrose interstitielle rénale lorsque les apports protéiques sont élevés de façon continue durant plusieurs années.
Reins et métabolisme des protéines
Rôle des acides aminés
Il existe vingt acides aminés. Certains peuvent être fabriqués directement par l’organisme à partir de métabolites endogènes (glucose et lipides à travers le cycle de Krebs) et d’autres ne peuvent provenir que de l’alimentation et sont dits essentiels. Le rein a une importance capitale dans le métabolisme des acides aminés : il les recapte lorsqu’ils sont filtrés par le glomérule puis les transforme pour la régulation acido-basique ; il peut également produire du glucose en cas d’insuffisance hépatique. Les acides aminés aromatiques sont dégradés en toxines par le microbiote intestinal. La tyrosine et le tryptophane sont à l’origine de la production d’indole et de crésol, substances transformées par le foie en conjugués toxiques qui ne peuvent pas être éliminés par un rein défaillant. La taurine et la choline sont à l’origine de la production de triméthylamine N-oxide (TMAO), composé très oxydant associé à une surmortalité cardiovasculaire.
Effets hémodynamiques et métaboliques sur les reins
On sait depuis plus de cinquante ans qu’un apport alimentaire ou intraveineux d’acides aminés augmente la filtration glomérulaire par vasodilatation de l’artériole afférente glomérulaire. Cette hyperfiltration entraîne un passage forcé de molécules (exemple de l’albumine : d’abord en petite quantité [microalbuminurie], puis en grande quantité [macroalbuminurie]). Il en résulte une surcharge tubulaire d’aval et une fibrose interstitielle rénale progressive. Ainsi, toutes les sections du néphron sont soumises au stress protéique, occasionnant un risque de maladie rénale sévère.
Régimes pauvre et très pauvre en protéines
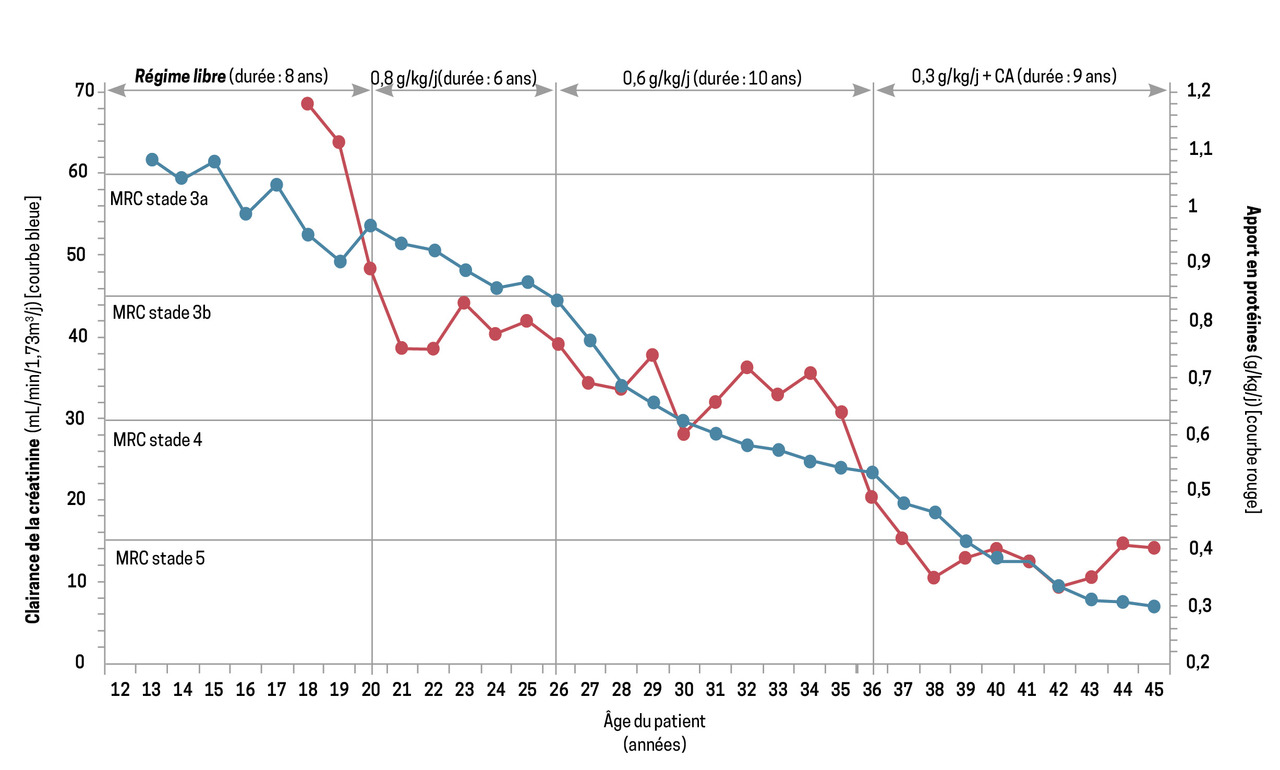
Les études métaboliques ont bien montré, autant chez l’adulte sain que chez le patient atteint de maladie rénale chronique (MRC), que les apports protéiques peuvent être diminués pour éviter le risque de surproduction de toxines et de surcharge hémodynamique rénale (fig. 1).1 Chez l’adulte, à titre individuel, il est possible de réduire ces apports jusqu’à 0,55 - 0,60 g de protéines par kg de poids et par jour : il s’agit du régime pauvre en protéines (RPP). Le fait de proposer 0,8 g de protéines/kg/j, valeur que l’on retrouve dans certains documents, est expliqué par l’ajout de deux écarts types, permettant de couvrir l’ensemble de la population sans surveillance particulière. Mais cette recommandation ne s’applique pas aux patients atteints de MRC qui sont suivis individuellement et n’ont pas besoin de cette augmentation de sécurité, qui risque de générer une production de toxines en plus grande quantité. Des études métaboliques précises, anciennes et récentes, ont confirmé que le métabolisme protéique est équilibré avec ces apports sans risque de dénutrition chez les patients atteints de MRC de stades 4 et 5.2
Les effets homéostasiques étant assez bien ressentis par les patients (meilleure digestion, meilleur sommeil, baisse de l’urée plasmatique), il est possible de diminuer encore l’apport protéique jusqu’à atteindre 0,3 à 0,4 g de protéines/kg/j : c’est le régime très pauvre en protéines (RTPP). Il est nécessaire de supplémenter ces apports très réduits par des céto-analogues – association d’acides aminés – essentiels (en moyenne, 5 à 15 comprimés/j). Ils permettent d’atteindre les 0,55 à 0,60 g de protéines/kg/j précédemment mentionnés sans apporter d’azote, abaissant donc la production endogène d’urée. Ainsi, la balance protéique optimale est maintenue tout en observant une baisse supplémentaire de l’urée plasmatique et des autres toxines non mesurées.
Il est important de rappeler que le métabolisme protéique est très sensible à la ration énergétique. Ces deux interventions diététiques (RPP et RTPP) doivent toujours s’accompagner d’un apport calorique suffisant, soit 25 à 35 kcal/kg/j. Un déficit d’apport calorique, quel que soit l’apport protéique, est l’élément décisif responsable de l’apparition d’une dénutrition. Une méta-analyse récente réalisée sur plus de 500 patients a confirmé l’absence de dénutrition au cours des RPP et RTPP.3
Une approche diététique doit être proposée à tous les patients porteurs de MRC de stade 3a et plus. En effet, les anomalies métaboliques commencent dès ce stade bien qu’elles soient peu symptomatiques (ostéo-dystrophie rénale) [encadré 1].
En général, deux patients sur trois poursuivent un RPP à 0,6 g de protéines/kg/j. Les effets bénéfiques observés convainquent un patient sur trois de poursuivre un RTPP à 0,3 - 0,4 g de protéines/kg/j.4
Le diététicien a la charge de cette orientation, sous supervision nutritionnelle (enquêtes, analyse de l’urée urinaire des 24 heures, recherche d’un déficit calorique) et médicale (absence de perte de poids, d’anorexie, de dépression, d’indication à la dialyse).
Protéines animales ou végétales ?
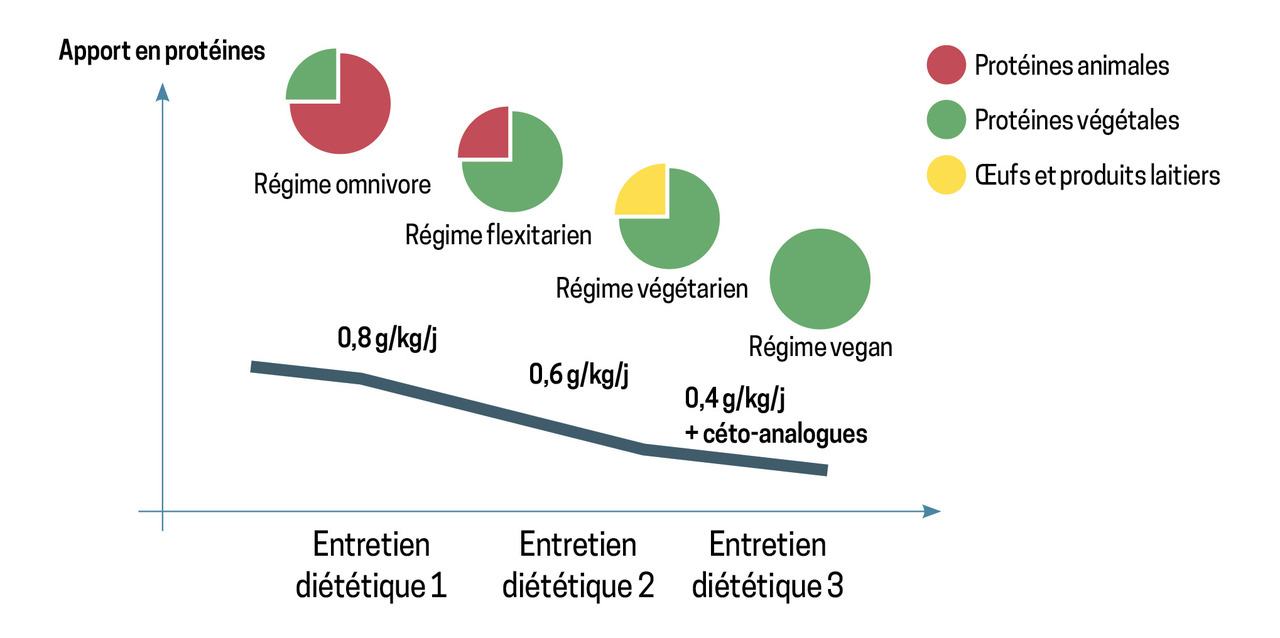
Les protéines d’origine animale donnent lieu à la production de toxines (exemple du TMAO) et représentent la principale source de phosphore alimentaire. De plus, elles n’apportent pas de fibres, ce qui induit une absorption rapide et importante du phosphore et du potassium. Elles sont associées à davantage de constipation qui, en ralentissant le transit intestinal, augmente la réabsorption des métabolites, notamment le potassium. Les protéines animales ont longtemps été considérées comme étant la meilleure source d’acides aminés, mais les progrès agroalimentaires et le développement de nouveaux végétaux de meilleure qualité nutritionnelle (quinoa par exemple) rendent aujourd’hui l’intérêt des protéines animales moins essentiel. Ainsi, on préfère désormais orienter les patients atteints de MRC vers une alimentation végétarienne progressive (régime flexitarien), puis exclusive. Des études à grande échelle sont en cours pour préciser ses actions bénéfiques dans la MRC.
Maladie rénale chronique et microbiote intestinal
Il existe une relation étroite entre la fonction rénale et la composition du microbiote intestinal. Des souches microbiennes apparaissent et d’autres disparaissent en fonction de la progression de la MRC ; cette transformation se fait vers un microbiote plus pathogène et pro-inflammatoire. Mais certaines questions ne sont pas résolues : ces modifications sont-elles dues à la MRC ? La composition du microbiote influence-t-elle la progression de la MRC ? Les régimes réduits en protéines peuvent-ils améliorer le microbiote des patients ayant une MRC ? Des études cliniques sont en cours pour y répondre, notamment l’étude française CKD-Rein.
Autres nutriments à adapter au cours de la MRC
Sodium
Le chlorure de sodium (NaCl), sous sa forme alimentaire, doit être limité en raison de ses effets hypertensifs et de rétention d’eau, deux problèmes généralement rencontrés au cours de la MRC. Il augmente également la protéinurie, facteur d’aggravation de la MRC. Il est conseillé de réduire les apports en sel (NaCl) à 5 g/j, soit 2 g de sodium. Le contrôle du sel permet également une meilleure néphroprotection par potentialisation des inhibiteurs du système rénine-angiotensine, un meilleur contrôle de la pression artérielle et une diminution de la protéinurie. L’observance du régime désodé peut être vérifiée par la mesure de la natriurèse des 24 heures : 5 g de sel alimentaire correspondent à 85 mmol de sodium dans les urines de 24 heures. Une prescription de bicarbonate de sodium pour lutter contre l’acidose reste possible car il apporte relativement peu de sodium par rapport au NaCl.
Potassium
Contrairement aux idées reçues, les apports alimentaires en potassium sont peu responsables d’hyperkaliémie, sauf en cas d’ingestion massive de fruits à certaines périodes de l’année (cerises, fraises, bananes) ou d’erreurs alimentaires manifestes (excès de jus de fruits et de chocolat). En effet, les fruits et légumes apportent des fibres alimentaires souhaitables pour le transit intestinal, qui ralentissent l’absorption digestive du potassium. Par ailleurs, le sucre apporté par les fruits entraîne une sécrétion d’insuline hypokaliémiante. Il ne faut pas limiter les apports en potassium, qui doivent être de 1 à 3 g/j. En revanche, l’acidose doit être corrigée (la réserve alcaline doit être supérieure à 23 mmol/L) par un supplément en bicarbonate de sodium, qui permet de lutter contre l’hyperkaliémie (encadré 2).5
Phosphore
Le phosphore (sous forme de phosphates dans l’alimentation) est une toxine métabolique majeure au cours de la MRC. Lorsque la maladie s’aggrave, les reins ne peuvent plus l’éliminer, entraînant ainsi une élévation réactionnelle et pathogène du fibroblast growth factor 23 puis de l’hormone parathyroïdienne. Il en résulte une pathologie minérale et osseuse fragilisante et des calcifications vasculaires. Le phosphore est contenu dans toutes les protéines (en moyenne 13 mg/g de protéines). Les apports en phosphore ne doivent pas dépasser 800 mg/j. Un régime végétarien apportant des fibres permet de réduire l’absorption digestive des phosphates, qui est alors d’environ 40 %.6 Enfin, il faut à tout prix limiter les apports en produits ultratransformés, qui contiennent un excès de phosphore inorganique absorbé à 100 %.
L’entretien diététique est ainsi essentiel pour appréhender la problématique de la restriction en phosphore au cours de la MRC.
Boissons
La quantité de boisson doit être de l’ordre de 1 L/j en hiver et de 1,5 L/j en été, à augmenter en cas d’épisodes de forte chaleur ou d’efforts physiques soutenus. Il faut éviter des apports inférieurs, notamment chez les personnes âgées, qui perdent la sensation de soif et risquent des épisodes d’insuffisance rénale aiguë fonctionnelle, avec urémie de surcroît. Les boissons sucrées doivent être évitées en raison d’une insulinorésistance fréquente au cours de la MRC, même sans diabète avéré.
Défis de mise en œuvre
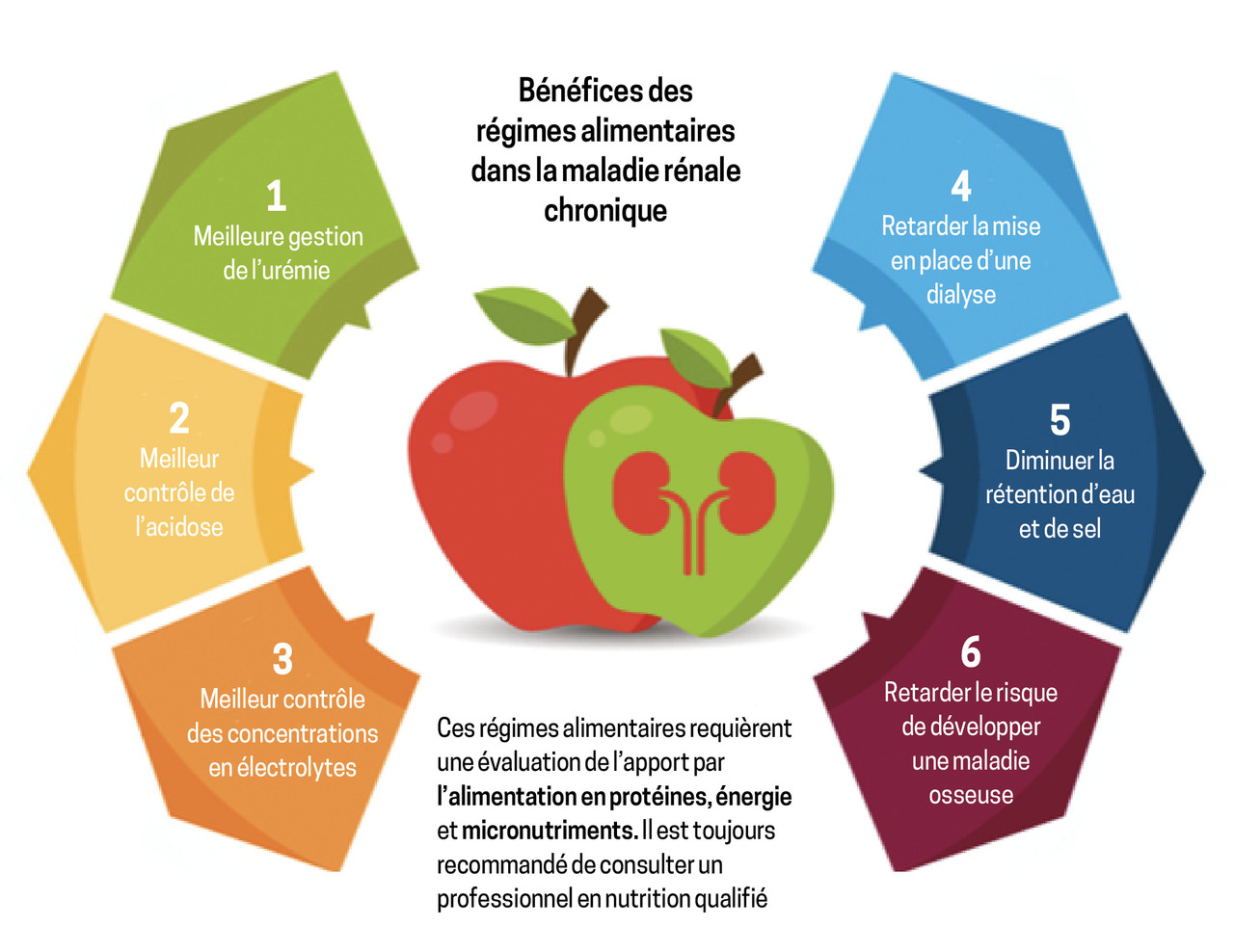
Si la nécessité de mettre en place des mesures diététiques pour les personnes atteintes de maladie rénale chronique ne fait pas débat du fait de ses nombreux bénéfices (fig. 2), leur mise en place reste délicate.
Habitudes individuelles, familiales et sociales
Il est difficile de modifier des décennies d’habitudes alimentaires. Cela implique des changements comportementaux familiaux de cuisine et des aliments à choisir : moins de sel, moins de produits industriels cuisinés, moins de viande et de fromages, davantage de pâtes et de féculents, de fruits et de légumes.
Le diététicien doit veiller à limiter les sources de phosphate inorganique (ajoutés par l’industrie agro-alimentaire comme agents de sapidité, colorants et conservateurs). Le régime ne doit pas être vu comme restrictif mais « adapté à la maladie rénale ».
On peut conseiller un jour de diététique libre durant la semaine, ce qui n’entraîne pas de production significative de toxines et permet des sorties régulières et des repas au restaurant.
L’alimentation progressivement végétarienne peut être également appréciée par l’entourage, car elle est plus saine et plus digeste.
Accès aux professionnels de santé
La prise en charge nutritionnelle est inscrite dans le parcours de soins de la MRC aux stades 4 et 5. À ces stades, le patient doit rencontrer un diététicien au moins une fois par an. En réalité, il est souhaitable de débuter ce suivi dès que la fonction rénale est inférieure à 45 mL/min (stade 3b). La faible disponibilité et le manque de diététiciens spécialisés peuvent cependant représenter un obstacle à cette prise en charge.
Étiquetage alimentaire et difficultés d’accès à la nourriture
Seules des indications sur la composition en sodium et en calories sont aujourd’hui obligatoires sur l’étiquetage des produits. Il n’est généralement pas possible de connaître le contenu en potassium, en phosphates inorganiques ni le contenu acide/alcalin des aliments. Enfin, lorsque l’accès à la nourriture est réduit et/ou les moyens financiers restreints, les patients ont tendance à se tourner vers des produits gras et sucrés, moins coûteux mais peu adaptés à la MRC.
L’éducation nutritionnelle pour améliorer l’adhésion
Il n’est pas facile de modifier des habitudes diététiques, et les patients atteints de MRC peuvent rencontrer des difficultés à opérer ces changements. Le soutien diététique est primordial dans les trois à six mois d’installation. L’éducation thérapeutique des patients comporte un volet nutritionnel : c’est une phase clé qui permet la réussite du programme diététique. Le diététicien doit veiller à sélectionner le niveau de réduction le plus adapté au patient et à son entourage, ainsi qu’en matière de produits à cuisiner, goût, répartition des aliments durant la journée et durant la semaine. Il est conseillé d’effectuer une réduction progressive sur plusieurs mois, avec des paliers à 0,8 puis 0,6 puis éventuellement 0,3 g de protéines/kg/j (fig. 3). Le patient qui y adhère baisse progressivement ses apports en protéines, apprend à les identifier en faisant ses courses, les choisit végétariennes. Il réduit également sa consommation en sel et en phosphates. La baisse de l’urée sanguine, rapidement observée, soutient alors ses efforts au quotidien.
L’observance peut être facilitée par la communication au patient de ses résultats biologiques sanguins sur une base trimestrielle puis bimestrielle : ils montrent une baisse de l’urée, du phosphore, un meilleur contrôle de l’acidose, de la PTH, de l’anémie et de la protéinurie. Il est possible de maintenir un ionogramme sanguin proche de la normale jusqu’au stade 5 de la maladie rénale. L’éloignement du début des dialyses est un argument important à mettre en avant pour renforcer la motivation des patients.
Que dire à vos patients ?
Une alimentation non contrôlée peut entraîner l’accumulation de toxines dans le corps, des substances que les reins, qui ne fonctionnent plus pleinement, ne peuvent pas éliminer.
Il est conseillé de limiter la consommation de protéines, de sel et de phosphates.
Il est utile de disposer d’une série de consultations diététiques pour rechercher les choix alimentaires qui conviennent le mieux.
Ce travail sur l’alimentation est un effort à long terme, mais il peut être adapté pour être le moins contraignant possible et s’intégrer dans une routine quotidienne.
Les bénéfices d’une alimentation adaptée sont nombreux : elle peut réduire le besoin en médicaments et ralentir la dégradation de la fonction rénale.
1. À quelles recommandations se vouer ?
Plusieurs recommandations ont été publiées dès 2000,7 puis environ tous les sept ans. En 2020, les KDOQI (Kidney Disease Outcomes Quality Initiative)8-ADA (American Diabetes Association) ont été mises à jour par le collectif de nutritionnistes de la Société internationale de nutrition des maladies rénales (ISRNM). Elles insistent sur les dernières publications de haut niveau de preuve et statuent sur les niveaux d’apports protéiques optimaux.
Pour le patient non diabétique atteint de MRC de stade 3 à 5 non dialysé :
- 0,55 à 0,60 g de protéines/kg/j ;
- 0,28 à 0,43 g de protéines/kg/j avec supplément par des céto-analogues ;
- 25 à 35 kcal/kg/j.
Pour le patient diabétique atteint de MRC de stade 3 à 5 non dialysé :
- 0,60 à 0,80 g protéines/kg/j ;
- 25 à 35 kcal/kg/j.
Ces recommandations ont également précisé quels bilans nutritionnels réaliser pour dépister la dénutrition et la traiter.
En 2021, les recommandations des KDIGO (Kidney Disease Improving Global Outcomes) ont opté pour une approche plus conservatrice (apports de protéines à 0,8 g/kg/j)9, mais elles n’étaient pas centrées sur la nutrition et il n’y avait pas d’experts spécialisés, à la différence des KDOQI.
2. Comment contrôler l’hyperkaliémie au cours de la MRC ?
Augmenter l’excrétion urinaire de potassium (diurétiques, inhibiteurs du SGLT2)
Combattre la constipation (fibres diététiques, laxatifs)
Contrôler l’acidose par du bicarbonate de sodium
Utiliser des chélateurs digestifs du potassium (résines)
Restreindre les apports alimentaires en potassium
2. Garibotto G, Sofia A, Parodi EL, et al. Effects of Low-Protein, and Supplemented Very Low-Protein Diets, on Muscle Protein Turnover in Patients With CKD. Kidney Int Rep 2018;3(3):701-10.
3.Hahn D, Hodson EM, Fouque D. Low protein diets for non-diabetic adults with chronic kidney disease. Cochrane Database Syst Rev 2020;10:CD001892.
4. Mennini FS, Russo S, Marcellusi A, et al. Economic effects of treatment of chronic kidney disease with low-protein diet. J Ren Nutr 2014;24:313-21.
5. De Brito-Ashurst I, Varagunam M, Raftery MJ, et al. Bicarbonate supplementation slows progression of CKD and improves nutritional status. J Am Soc Nephrol 2009;20:2075-84.
6. Fouque D, Horne R, Cozzolino M, et al. Balancing Nutrition and Serum Phosphorus in Maintenance Dialysis. Am J Kidney Dis 2014;64:143-50.
7. Hand RK, Steiber A, Burrowes J. Renal dietitians lack time and resources to follow the NKF KDOQI guidelines for frequency and method of diet assessment: results of a survey. J Ren Nutr 2013;23:445-9.
8. Ikizler TA, Burrowes JD, Byham-Gray LD, et al. KDOQI Clinical Practice Guideline for Nutrition in CKD: 2020 Update. Am J Kidney Dis 2020;76(3S1):S1-S107.
9. KDIGO 2024 Clinical Practice Guidelines for the Evaluation and Management of Chronic Kidney Disease. Kidney Int 2024;105(Suppl 4S):S117-S314.
10. Bellizzi V, Fouque D. Single-patient trial of dietary protein restriction in kidney disease: A patient-centred opportunity. Clin Kidney J 2024;17(4):sfae070.
11. Kalantar-Zadeh K, Fouque D. Nutritional management of chronic kidney disease. N Engl J Med 2017;377:1765-76.
12. Wang AY, Kalantar-Zadeh K, Fouque D, et al. Precision Medicine for Nutritional Management in End-Stage Kidney Disease and Transition to Dialysis. Semin Nephrol 2018;38:383-96.
11. Kalantar-Zadeh K, Fouque D. Nutritional management of chronic kidney disease. N Engl J Med 2017;377:1765-1776.
12. Wang AY, Kalantar-Zadeh K, Fouque D, et al. Precision Medicine for Nutritional Management in End-Stage Kidney Disease and Transition to Dialysis. Semin Nephrol 2018;38:383-396.

 Encadrés
Encadrés