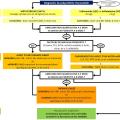
Diagnostic : au moins une arthrite clinique
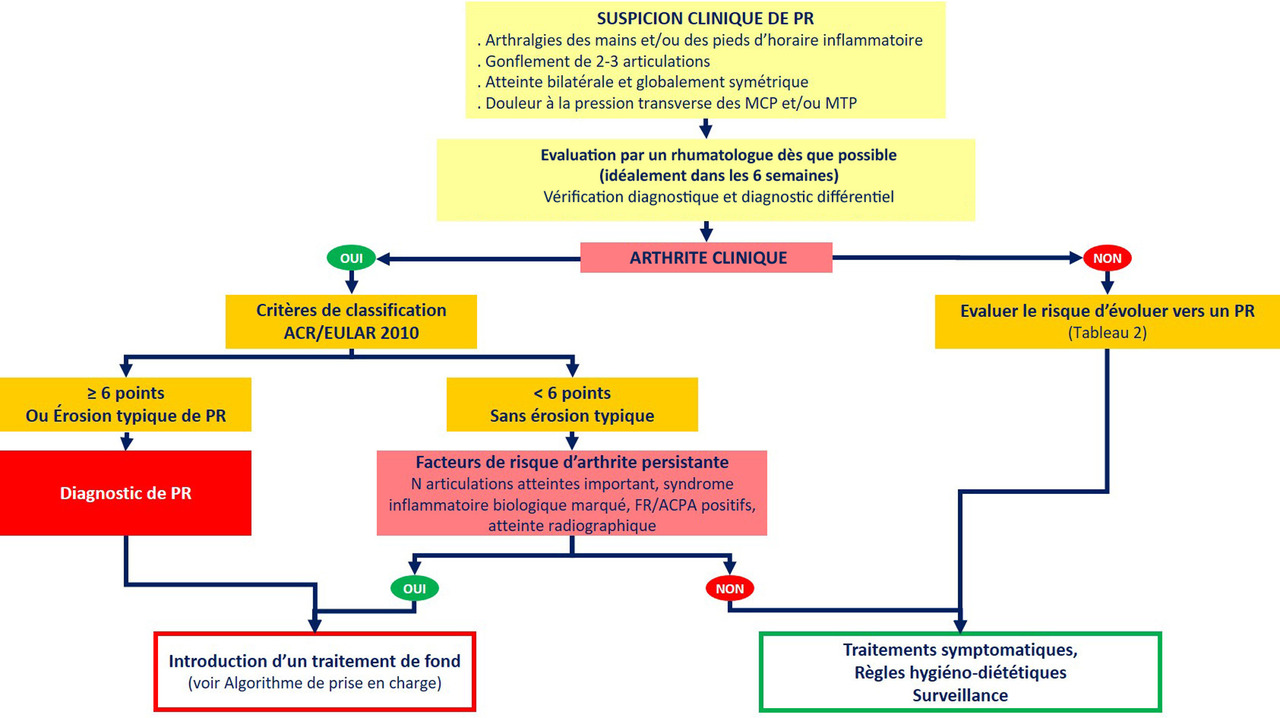
L’algorithme avec la démarche diagnostique est rapporté en figure 1. En cas de suspicion de PR, un bilan minimal est recommandé (tableau 1). Les auteurs des recos insistent sur le fait que le diagnostic de PR nécessite la présence d’au moins une arthrite clinique et doit être confirmé le plus tôt possible par le rhumatologue.
Sujets à risque de PR
Par rapport aux recommandations antérieures, le groupe de travail a intégré dans cette mise à jour la notion de sujet à risque d’évoluer vers une PR, du fait d’une histoire familiale de PR ou de la présence d’auto-anticorps, en l’absence d’arthrite clinique. L’évaluation du risque d’évoluer vers une PR chez une personne ayant des arthralgies cliniquement suspectes repose sur la notion d’expositions environnementales, ainsi que sur des critères cliniques, immunologiques et d’imagerie. Ces éléments sont listés dans le tableau 2.
Les facteurs de risque environnementaux modifiables méritent d’être recherchés et corrigés : tabagisme, obésité, régime déséquilibré, sédentarité… Parmi les causes professionnelles, l’exposition à la silice minérale est la mieux documentée (métiers du bâtiment, taille de la pierre, céramique, dentiste, etc.) : elle est associée à un doublement du risque de PR. D’autres expositions aériennes professionnelles semblent associées à un sur-risque (insecticides, fongicides, fumées de soudure, toluène, poussières inorganiques, etc.) avec un effet dose et un effet synergique avec le tabagisme et les prédispositions génétiques. Quant au lien causal entre parodontite et risque de développer une PR, les données actuelles ne sont pas assez solides ; en effet, si la plupart des études retrouvent un sur-risque de PR en présence de parodontite, il existe des facteurs de risque à la fois génétiques et environnementaux communs à ces deux pathologies.
Très important : les données récentes montrent que, en l’absence d’arthrite, la présence d’anticorps anti-peptide citrullinés (ACPA) ne doit pas être assimilée à une PR préclinique, à un stade débutant.
En effet, parmi les sujets ACPA positifs – même ceux ayant des forts taux d’anticorps avec arthralgies cliniquement suspectes et/ou des inflammations à l’IRM – 44 à 68 % ne développeront pas d’arthrite. Par ailleurs, la persistance et la variation des taux d’auto-anticorps ne permettent pas de discriminer ceux qui vont évoluer vers une PR de ceux qui n’évolueront pas. Leur dosage au cours du temps n’a pas d’intérêt.
Quand traiter ?
Dès que le diagnostic de PR est posé, un traitement de fond doit être débuté. Chez les patients ayant une arthrite mais ne satisfaisant pas les critères de classification ACR/EULAR 2010 (absence d’érosion radiographique typique et moins de 6 points), un traitement de fond doit être initié si un ou plusieurs facteurs de risque d’arthrite persistante sont présents (fig. 1).
En revanche, chez les personnes sans arthrite clinique, n’ayant pas d’élément en faveur d’un diagnostic différentiel, et ayant plusieurs facteurs de risque d’évoluer vers une PR (ACPA ± arthralgies cliniquement suspectes ± inflammation à l’IRM), il n’est pas recommandé d’introduire un traitement de fond pour prévenir la survenue d’une PR. Cette recommandation est fondée sur les résultats de 8 essais randomisés contrôlés, montrant que :
- les glucocorticoïdes, l’hydroxychloroquine, le méthotrexate et les statines n’ont eu aucun effet sur le risque d’évoluer vers une PR ;
- le rituximab et l’abatacept n’ont eu qu’un effet suspensif pendant la période de traitement, retardant plutôt que prévenant l’apparition de la PR.
Ainsi, aucun de ces traitements ne permet de prévenir l’évolution vers une PR et il n’y a pas de preuve à ce jour pour un effet symptomatique.
De ce fait, chez ces patients, on recommande des traitements symptomatiques, la correction des facteurs de risque par des règles hygiénodiététiques et la surveillance. La surveillance du risque de PR est recommandée sur 1 à 3 ans (période la plus à risque d’évoluer vers une PR), à un rythme adapté sur le niveau de risque évalué (initialement entre 3 et 12 mois) et repose avant tout sur la clinique. Elle pourra ensuite être espacée. Il est important d’apprendre à ces patients à reconnaître les signes justifiant une consultation plus rapide et en particulier l’apparition de gonflement articulaire.
Prise en charge thérapeutique
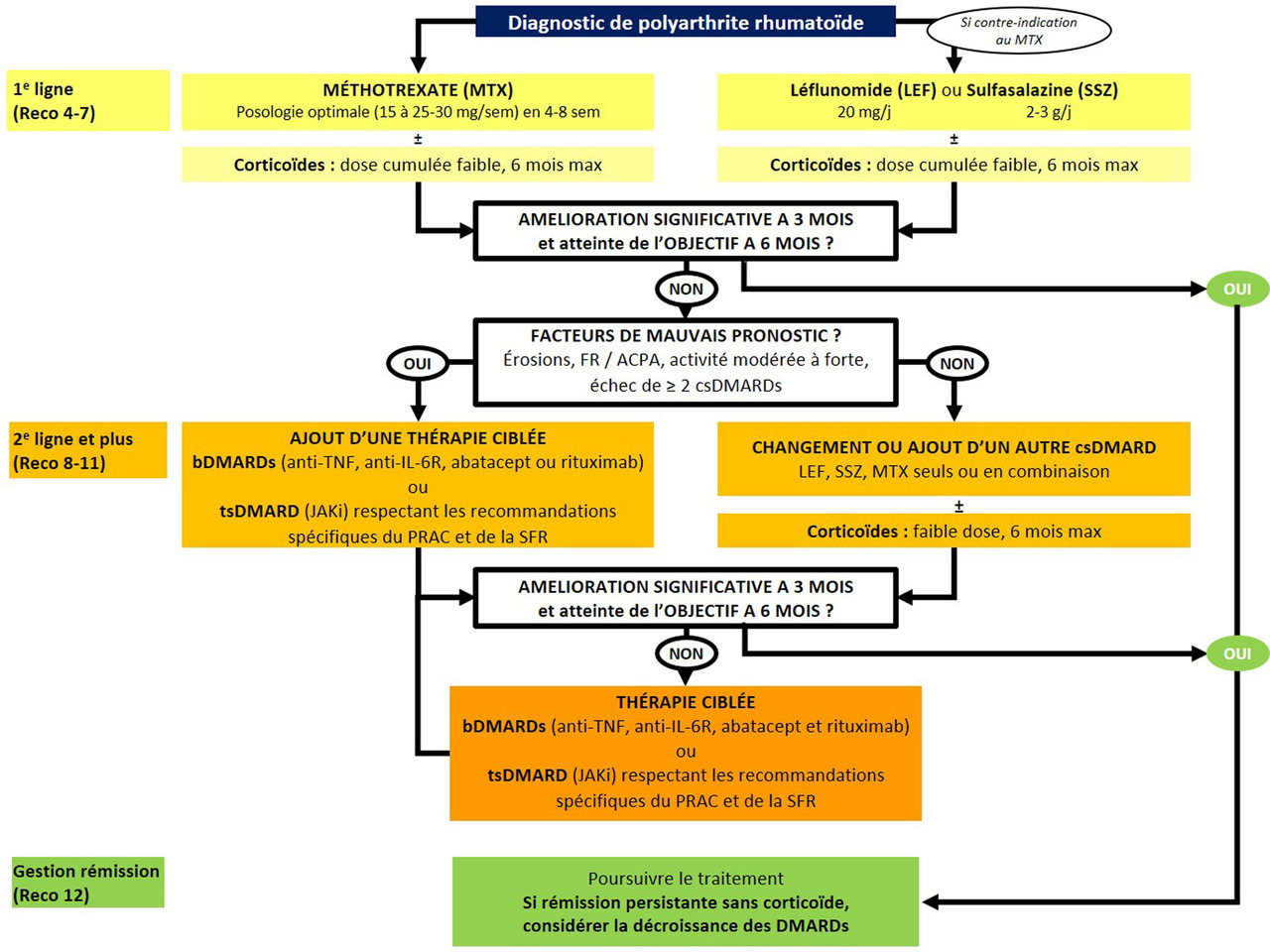
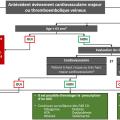
L’algorithme avec la stratégie thérapeutique est indiqué en figure 2.
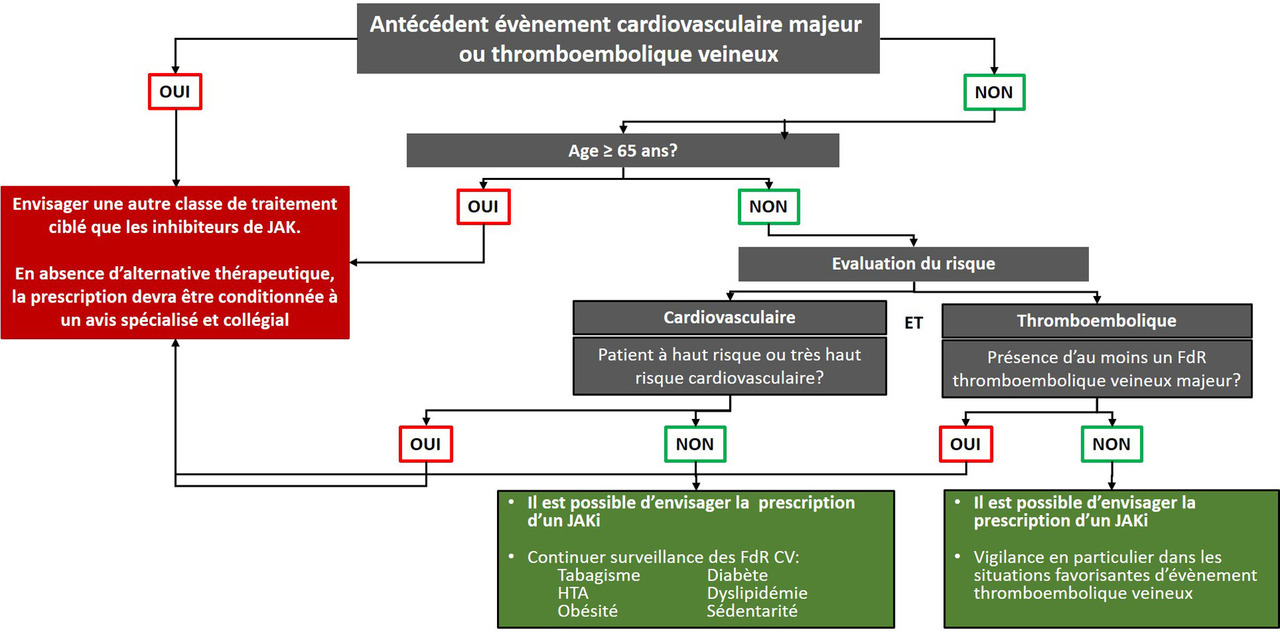
Les recommandations intègrent les données récentes sur le profil de risque cardiovasculaire et néoplasique des inhibiteurs de Janus kinase. En effet, l’essai ORAL Surveillance a montré un sur-risque d’infections sévères (dose de 10 mg × 2/j) et herpétiques (toutes doses), de néoplasies et de carcinomes cutanés (toutes doses) sous inhibiteurs de JAK. Ceci a conduit les agences américaine et européenne du médicament à émettre une alerte sur la sécurité d’utilisation de ces molécules , aboutissant à des restrictions d’utilisation chez des populations à risque. Plusieurs études observationnelles utilisant des données de registres ou bases de données d’assurances ont apporté des éléments rassurants, sans cependant annuler l’alerte.
Ainsi, en présence de facteurs de risque cardiovasculaire ou néoplasiques marqués, les recommandations du PRAC et du consensus de la SFR (figure 3) devront être respectées et les inhibiteurs de JAK n’être envisagés qu’en l’absence d’alternative thérapeutique.
Suivi et prise en charge en MG
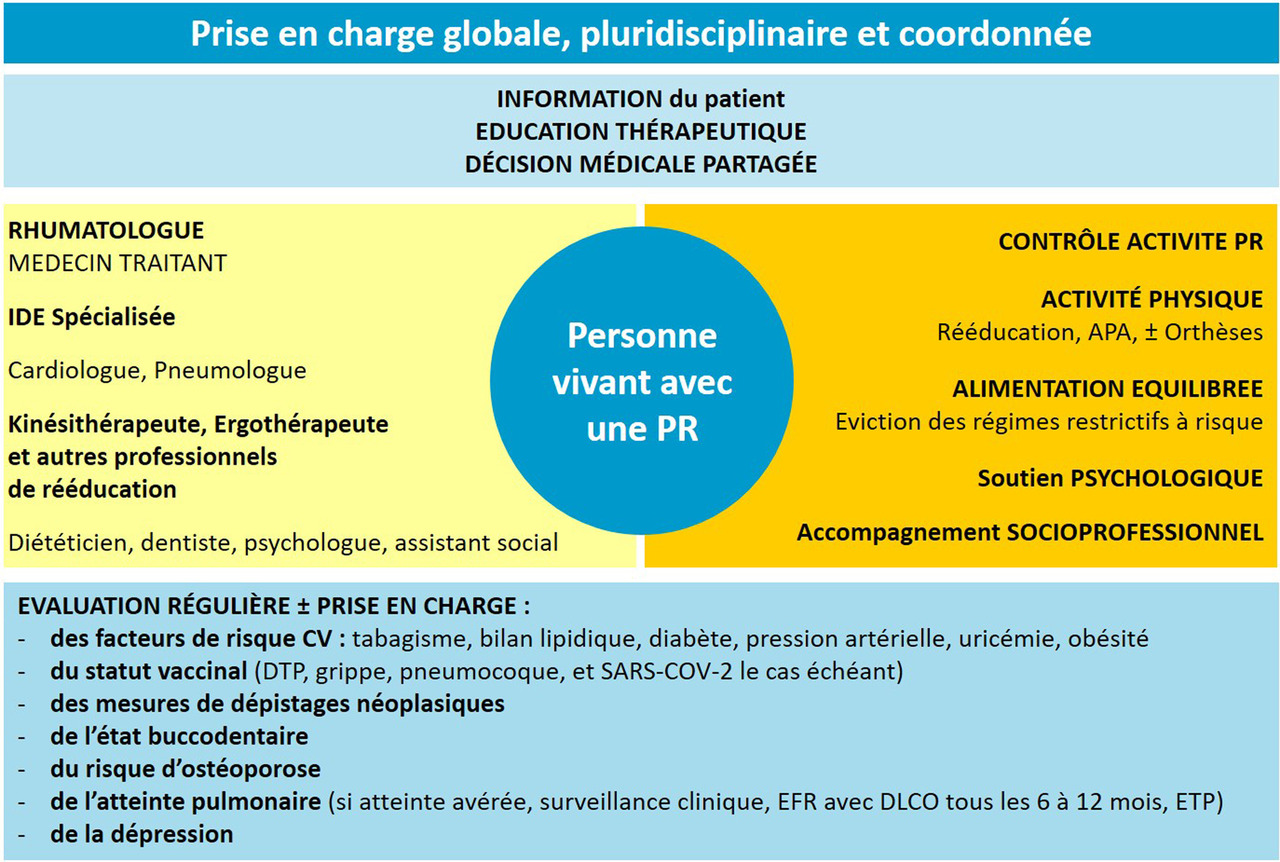
Un dépistage et une évaluation périodique des comorbidités et de leurs facteurs de risque doivent être réalisés, et leur prise en charge organisée de manière coordonnée avec les spécialistes (schéma récapitulatif en figure 4).
La prise en charge doit être associée à des conseils d’hygiène de vie (activité physique régulière, arrêt du tabac, alimentation équilibrée, etc.) et la mise à jour des vaccinations.
Comme proposé par l’EULAR, l’évaluation du risque cardiovasculaire devra au minimum être faite tous les 5 ans. Des recommandations spécifiques sur l’alimentation ont été éditées par la SFR (cf. notre interview des Pr Sellam et Daïen à ce sujet : Quel régime alimentaire en cas de rhumatisme inflammatoire chronique).
Nobile C. Entretien avec le Pr Claire Daien. Polyarthrite rhumatoïde : de nouvelles données bousculent les pratiques. Rev Prat (en ligne) 30 avril 2024.