À partir des années 1990, la douleur n’est heureusement plus un fait social obligatoire ni une fatalité individuelle, mais elle devient une priorité de soin, relayée par les pouvoirs publics.
Évolutions contemporaines
Pendant une vingtaine d’années, trois plans nationaux se sont succédés,1 aboutissant à l’inscription dans la loi du droit au soulagement de chacun, à la création du Centre national de ressources de lutte contre la douleur (CNRD) et à d’autres avancées.
Faire de la douleur un enjeu de santé publique a favorisé la recherche tant fondamentale que clinique, avec de nombreuses publications dans tous les domaines s’y rattachant. La communauté des urgentistes, guidée par la Société française d’anesthésie et de réanimation (SFAR) en 1999, puis en 2010,2 a émis des premières recommandations centrées sur la lutte contre « l’oligoanalgésie ». En favorisant l’auto-évaluation de l’intensité de la douleur, et en rendant plus accessible la morphine intraveineuse pour le patient douloureux sévère, la médecine d’urgence a adapté le modèle des salles post-interventionnelles en garantissant la sécurité des malades. La sélection des paliers antalgiques, instaurée par l’Organisation mondiale de la santé (OMS) en 1986 pour la douleur cancéreuse et postopératoire en fonction de l’intensité douloureuse, a été étendue et standardisée. L’objectif était de faire reculer la sous-évaluation, le sous-traitement et l’oligomorphine décrite en médecine d’urgence.
Mais le contexte scientifique a évolué depuis ce dogme initial, jusqu’à la définition de la douleur publiée par l’International Association for the Study of Pain (IASP) en juillet 2020 : une expérience sensorielle et émotionnelle désagréable associée à, ou ressemblant à celle associée à, une lésion tissulaire réelle ou potentielle.3 Celle-ci reflète aujourd’hui pleinement l’intégration des mécanismes de modulation de la douleur, y compris de longue durée, et ne met plus l’accent sur la capacité d’expression des patients de leur ressenti.
Sur le plan épidémiologique, les données disponibles concernant le volume de patients douloureux aux urgences sont probablement devenues elles aussi obsolètes. La dernière étude épidémiologique d’envergure, l’étude PALIERS,4 date d’il y a quinze ans. Ses principaux résultats concernaient la prévalence de la douleur aiguë aux urgences (au moins 70 % des consultants) et le taux de soulagement à l’issue de leur passage (seulement 30 %). Ces données sont rares car la traçabilité de ce qui est réalisé aux urgences reste un problème constant, malgré l’informatisation. À la sous-évaluation de la douleur s’ajoute donc ce manque de traçabilité qui biaise les données épidémiologiques rétrospectives.
Il n’existe pas de nouvelle étude descriptive multicentrique et en temps réel de la prise en charge de la douleur aux urgences en France ces quinze dernières années, mais certaines autres réalités épidémiologiques indiquent des changements que l’on ne peut négliger. Les rapports de la Direction de la recherche, des études, de l’évaluation et des statistiques (Drees)5 objectivent que la fréquentation des urgences a augmenté en moyenne de 2 % par an depuis quinze ans, et elle est donc 30 % plus importante qu’alors. La population y est plus âgée, plus polypathologique et, si la part de traumatologie reste stable, les affections médicales sont plus complexes. Dans le même temps, les moyens des services, notamment humains et en lits d’aval, n’ont pas augmenté dans les proportions adéquates, d’où un phénomène d’intensification du travail et d’engorgement des urgences. Parallèlement, les exigences en matière de qualité de prise en charge n’ont pas diminué, et l’insuffisance de traitement de la douleur reste un sujet de préoccupation, comme son délai optimal. Les populations les plus à risque de sous-traitement sont maintenant connues : les femmes, les patients âgés, les allophones, les patients traumatisés sévères.
Il faut donc, aujourd’hui, soulager mieux plus de patients qu’avant, et en moins de temps. Le parcours clinique s’étant également allongé (exigences diagnostiques, allers-retours en imagerie, attente avant hospitalisation, etc.), il faut aussi désormais assurer cette antalgie plus durablement que les seules quatre premières heures dans bien des situations. Par ailleurs, 30 % des patients qui consultent aux urgences présentent une douleur aiguë en rapport avec une douleur chronique, et les douleurs neuropathiques sont devenues une part non négligeable des typologies douloureuses rencontrées, ce qui nécessite une connaissance plus approfondie des antalgiques par les praticiens des urgences.
D’autres modifications de contexte sont intervenues durant ces quinze dernières années.
L’implantation des postes d’accueil et d’orientation à l’entrée des urgences s’est généralisée (63 % des structures en 2010, 95 % en 2023)6, avec un premier dépistage de la douleur et la possibilité de protocoliser la gestion précoce de la douleur, même avant toute hypothèse diagnostique.
Par ailleurs, les moyens pharmacologiques antalgiques ont changé : retrait du marché des spécialités contenant du dextropropoxyphène en 2011, commercialisation du méthoxyflurane faible dose en dispositif médical individuel en 2016, étude de la kétamine faible dose et diversification des galéniques avec le référencement de formes transmuqueuses (orales ou nasales) ou inhalées, qui élargissent les possibilités de traitement.
Les perspectives sur l’antalgie post-urgence ont aussi changé. Au-delà de l’impératif éthique et moral qui la motive et du caractère délétère de la douleur dès la fonction d’alerte passée, il a été montré que la prise en charge d’une douleur aiguë conditionnait en grande partie sa chronicisation. La prise en charge de la douleur aiguë est donc devenue une priorité thérapeutique au même titre qu’une antibiothérapie ou une chirurgie d’urgence. La médecine d’urgence est, de plus, devenue une spécialité médicale, les publications concernant cette spécialité sont très nombreuses, et la prise en charge de la douleur aiguë en médecine d’urgence est désormais un sujet d’expertise à part entière des urgentistes.
Enfin, l’« opioïd crisis » en Amérique du Nord, si elle a des tenants et des aboutissants propres à cette région du monde, recentre les débats autour des mésusages et des pratiques addictologiques, même en France, après une lutte difficile contre la morphinophobie des soignants et des patients pendant vingt-cinq ans. La Haute Autorité de santé (HAS) a dû émettre des recommandations en 2022 sur la prévention du mésusage des opioïdes,7 incluant la prise en charge de la douleur aiguë.
Principes actuels de prise en charge
La démarche « évaluation-traitement aigu-réévaluation-relais » reste la base de la gestion de la douleur aiguë aux urgences, mais les outils thérapeutiques et la prise en charge ne suivent plus les mêmes règles qu’en 2010. La Société française de médecine d’urgence (SFMU) a émis de nouvelles recommandations pour l’adulte en 2024,8 intégrant l’ensemble des nouveaux éléments contextuels.
Fin des paliers universels, vers un diagnostic typologique
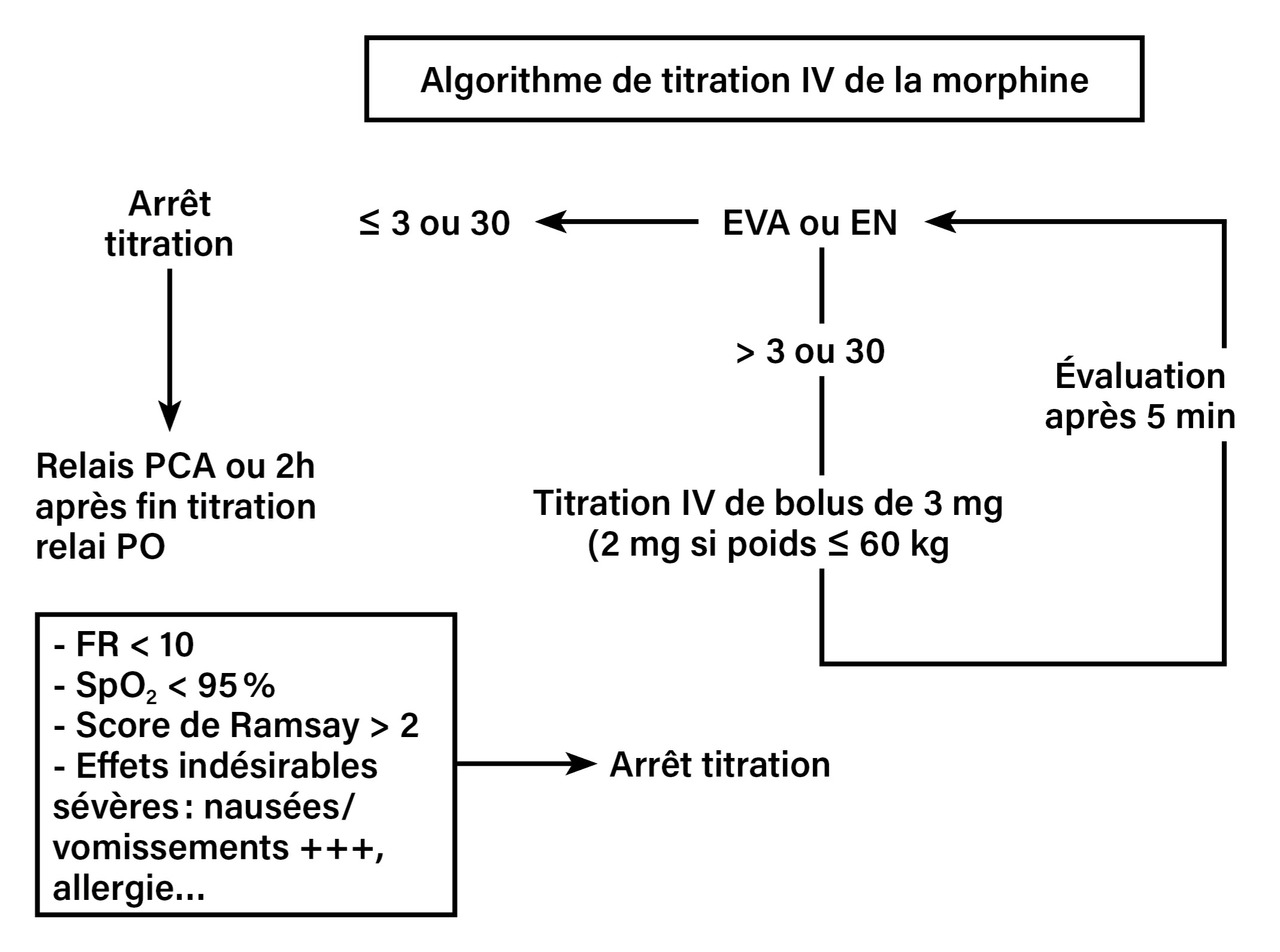
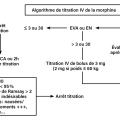
Les précédentes recommandations2 proposaient une prise en charge gradée selon l’intensité initiale de la douleur : par cette démarche universelle et pragmatique, l’objectif était de traiter le maximum de situations douloureuses aux urgences, en réaffirmant la place de la morphine intraveineuse pour toute douleur sévère et les modalités de sa titration (fig. 1) pour une utilisation sécurisée.
Compte tenu des connaissances actuelles, la démarche centrée sur l’auto-évaluation de l’intensité douloureuse à l’arrivée aux urgences est devenue trop simpliste, d’autant plus qu’elle s’est révélée moins efficiente que prévue (des travaux montrent moins de 10 % de titrations morphiniques réalisées en cas de dépistage de douleur sévère)9 et que le contournement des opioïdes forts par les opioïdes dits « faibles » est probable, bien que non mesuré directement. La codéine, qui n’existe en France qu’en association au paracétamol, semble avoir un mésusage plus limité que le tramadol, qui est aujourd’hui au cœur de toutes les attentions. La France se situe au troisième rang européen de la consommation globale d’opioïdes faibles, mais le tramadol y est largement majoritaire, comme en Allemagne, en Italie, en Espagne et au Danemark.10
Si la gradation en douleur légère, modérée et sévère garde sa place pour évaluer la réponse thérapeutique, ce classement en trois paliers est devenu inadéquat à plusieurs titres : il ne différencie pas les usages en douleur aiguë et chronique, n’intègre pas les traitements des douleurs neuropathiques et il est trop restrictif sur le plan moléculaire. De plus, la distinction entre opioïdes forts et faibles est devenue caduque comme la proposition d’un modèle plaçant la morphine au sommet d’une classification opiacée compte tenu de l’avènement d’opioïdes plus puissants (fentanyl, sufentanil). Enfin, une « exclusivité » qui nie l’efficacité antinociceptive d’autres molécules n’est définitivement plus valable, le néfopam n’étant plus le seul à ne pas vraiment trouver sa place dans ce modèle historique. Aujourd’hui, traiter la douleur aux urgences demande d’avoir plus de cordes à son arc que trois paliers.
Par ailleurs, la notion de progressivité thérapeutique n’est pas fondée sur les mêmes objectifs. Les antalgiques dits de « palier 1 » ou de « palier 3 » peuvent chacun être de premier recours, comme de troisième recours, ou cohabiter dans le même temps de traitement.
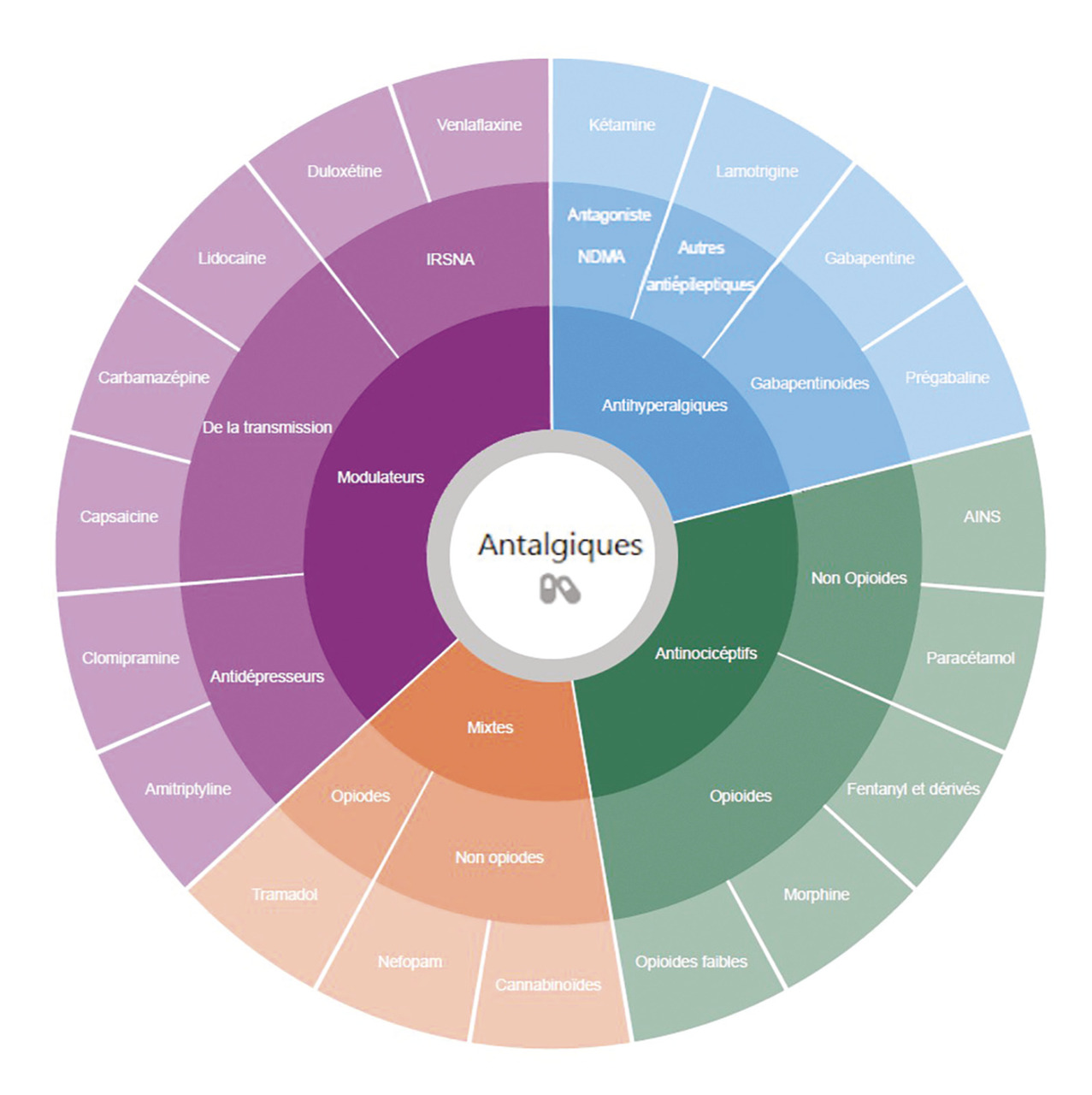
Une autre classification est proposée depuis 2010 par David Lussier et Pierre Beaulieu au nom de l’IASP.11 Cette « nouvelle » classification prend en compte les différents mécanismes des douleurs (nociceptives, neuropathiques, nociplastiques, mixtes) et propose une meilleure adéquation entre les antalgiques et la physiopathologie de la douleur (fig. 2). Elle permet davantage de multimodalités. Mais plus complexe, force est de constater qu’elle n’a pas encore réussi à s’imposer.
À l’accueil : évaluation et traitement initial standardisés mais catégoriels
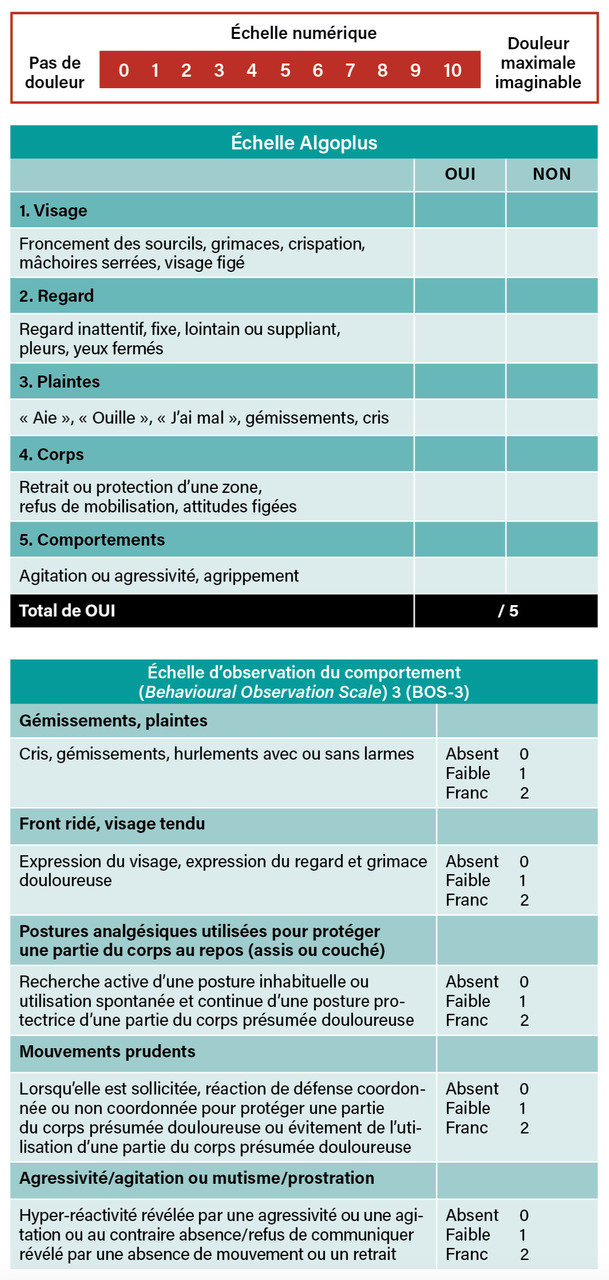
L’évaluation de la douleur aux urgences doit être systématique par l’infirmier organisateur de l’accueil (IOA) ; elle fait partie des constantes du patient. Pour ce premier temps d’évaluation et de bilan infirmier, rapide (trois minutes en moyenne), l’auto-évaluation reste un gold standard. L’échelle visuelle analogique (EVA) est toujours valide. Cependant, il a été montré que son utilisation, du fait d’un support nécessaire et d’une compréhension peu intuitive, était sans doute un frein à l’évaluation systématique. Par ailleurs, l’augmentation des populations incompatibles avec cette échelle (non ou peu francophones, troubles cognitifs, handicaps de communication…) a conduit à élargir le panel d’évaluation à maîtriser aux urgences.
Il est maintenant recommandé d’utiliser l’échelle numérique (EN) pour l’évaluation de la douleur chez les patients adultes admissibles à une auto-évaluation.4 D’autres échelles, comme celle des visages, gardent des indications au cas par cas. Lorsque l’auto-évaluation n’est pas possible, les échelles d’hétéro-évaluation telles l’Algoplus (pour les plus de 65 ans) ou la Behavioural Observation Scale (BOS) 3 (pour les moins de 65 ans) sont dorénavant recommandées pour les urgences (fig. 3). Elles ne permettent pas une cotation précise de l’intensité douloureuse mais son dépistage lorsque le patient ne peut communiquer (effet seuil). Bien sûr, cette évaluation doit être correctement tracée, en précisant bien l’échelle utilisée.
Cette évaluation initiale doit donner lieu, si elle n’est pas nulle, à une première action définie par un protocole antalgique d’accueil.
Ces protocoles sont devenus une recommandation forte.4 Ils doivent prévoir un traitement administrable immédiatement (donc idéalement en non-injectable), selon le niveau de douleur mais aussi selon le terrain du patient et la catégorie traumatique ou médicale de son recours, tout en tenant compte des prises antalgiques précédentes (domicile, transport médicalisé…).
La douleur très sévère doit donner lieu à une priorisation pour titration morphinique intraveineuse rapide (fig. 1), avec l’organisation d’aval que cela implique au sein du service des urgences. Cette démarche est particulièrement importante pour les douleurs abdominales sévères souvent sous-traitées, dans des délais trop longs.
Enfin, les antalgiques utilisés sont parfois directement liés au choix de la filière de soins qui les accueille au sein des urgences, et un protocole dédié peut être licite en traumatologie bénigne, favorisant l’emploi de traitements per os, et non opioïdes, avec entrée dans un parcours ambulatoire.
Malgré le caractère non étiologique des protocoles d’accueil, trois situations médicales sont des non-indications initiales aux opioïdes, quelle que soit l’intensité de la douleur : la céphalée primaire, la suspicion de colique néphrétique évidente et la lombalgie aiguë. C’est aussi le cas en traumatologie, mais cette fois du fait de la cinétique antalgique : une suspicion de fracture déplacée de la cheville ou de col du fémur entraîne une prise en charge dans un secteur de soins qui permet l’accès à une anesthésie loco-régionale ou à une sédation procédurale*, et les opioïdes ne sont utilisés qu’en cas d’indication chirurgicale au décours immédiat de la prise en charge, et non en amont de celle-ci, pour limiter les risques de complications respiratoires.
Ainsi, un urgentiste ne devrait plus voir un patient naïf de toute antalgie en zone de soins sauf prise en charge immédiate complexe ou en urgence vitale, et sauf refus explicite du patient malgré une information claire sur la balance bénéfice/risque largement positive des thérapeutiques choisies par l’IOA. Le consentement du patient est essentiel, même s’il appartient aux soignants de déconstruire des convictions encore trop souvent présentes sur la supposée dangerosité des opioïdes et sur le supposé risque d’erreur diagnostique lié à la prise d’antalgiques.
Réévaluation, coanalgésie, traitements non médicamenteux : gestion multimodale et individualisée
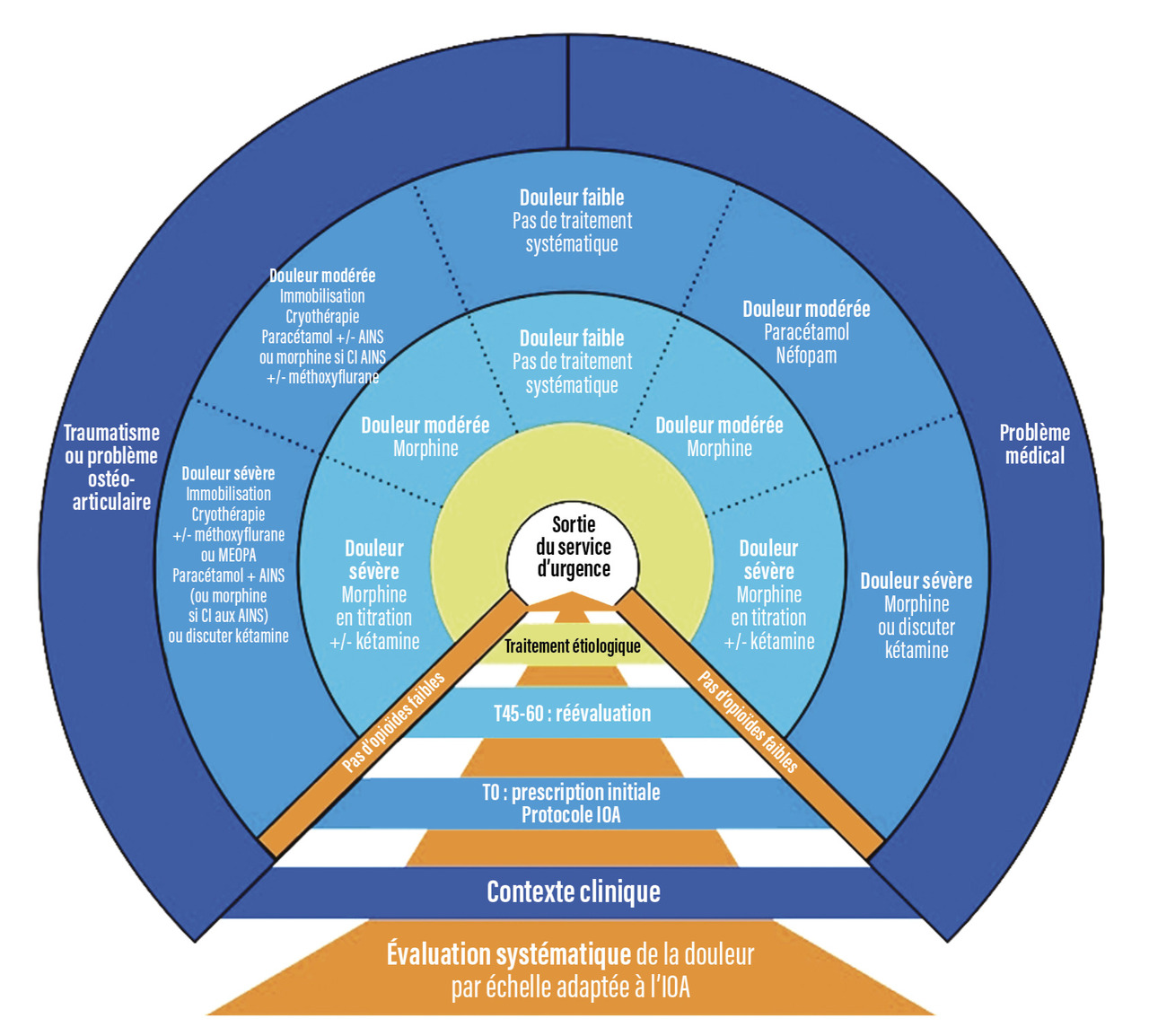
Toute prise en charge après l’accueil doit entraîner une réévaluation de la douleur. Ce deuxième temps d’évaluation permet d’ajuster et d’individualiser la prise en charge, de compléter par de nouveaux traitements la première antalgie, sans forcément recourir à des molécules plus puissantes (fig. 4). Cette réévaluation peut être rapide (après installation en zone critique, par exemple) ou différée sur des secteurs de soins moins dotés en personnel, mais, dans tous les cas, un délai de quarante-cinq minutes au maximum semble adapté aux contraintes pharmacologiques de la prise en charge antalgique. Ce délai permet de réconcilier les deux aspects de la prise en charge de la douleur, symptomatique initiale et étiologique dès que possible, surtout en cas de surflux, de diagnostic non évident, d’hyperalgie, etc. C’est aussi à ce moment que se fait le choix entre protocolisation antalgique secondaire et prise en charge complètement au cas par cas.
En effet, il n’est pas possible d’être monolithique très longtemps en antalgie. Les douleurs traumatiques, dans leur phase suraiguë, doivent faire l’objet d’une antalgie multimodale intégrant des outils médicamenteux et non médicamenteux : l’immobilisation et le glaçage d’un membre sont souvent aussi importants que la première prise médicamenteuse. Pour des douleurs modérées à sévères, les moyens seuls ou combinés que sont le paracétamol, le néfopam ou les anti-inflammatoires non stéroïdiens (AINS) satisfont souvent la prise en charge. Si la douleur est évocatrice de colique néphrétique, ou si une sciatalgie aiguë est associée à une lombalgie chronique, ou en cas de céphalée aiguë migraineuse, la morphine n’est pas le premier recours (comme vu précédemment) : même si la douleur est d’intensité sévère, les AINS par voie intraveineuse sont administrés en première intention, car ils sont efficaces sur le plan symptomatique et étiologique.
Mais si la douleur non traumatique reste sévère ou que le traumatisme relève d’un acte chirurgical, la prise en charge reste fondée sur le protocole de titration morphinique tel qu’il a été défini en 2010 (fig. 1). Il peut aujourd’hui être renforcé en coanalgésie par la kétamine faible dose (0,2 mg/kg en intraveineuse lente) si plus de dix bolus de morphine sont nécessaires. En attendant la pose d’une voie veineuse, un traitement inhalé, par protoxyde d’azote ou méthoxyflurane, peut être administré par l’IOA.
Concernant les « opioïdes faibles », à part en soulagement de douleurs neuropathiques chroniques déjà diagnostiquées (recommandations de la Société française d’étude et de traitement de la douleur [SFETD]), ces molécules induisent davantage d’effets indésirables, sont plus addictogènes et ne sont pas plus efficaces que la morphine. Dans la mesure où les équianalgésies morphiniques sont bien connues (60 mg de codéine = 50 mg de tramadol = 10 mg de morphine), il est dorénavant préconisé de recourir à la morphine elle-même, plutôt qu’à ses dérivés, même en cas de douleur modérée, tant à l’accueil qu’après réévaluation.
Enfin, la coanalgésie n’est pas toujours synergique (comme l’association intraveineuse paracétamol-morphine), et elle doit faire intervenir une combinaison de molécules ou de pratiques dont l’action antalgique est prouvée. Ainsi, il convient d’utiliser avec parcimonie les antispasmodiques et les inhibiteurs de la pompe à protons, qui n’ont pas montré de bénéfices antalgiques dans la douleur abdominale aiguë tout-venant.
Gestion de la douleur induite : prévenir, gérer ou passer à la sédation procédurale
Grande négligée, la douleur induite par les soins constitue un facteur majeur démontré d’aggravation de la douleur et d’insatisfaction tant des patients que des soignants. Sa prévention est pourtant connue depuis longtemps : la lidocaïne sous toutes ses formes (gel, spray, crème, infiltration sous-cutanée, injection en bloc local) est une des molécules princeps12 , avec le protoxyde d’azote, souvent disponible sous forme de mélange équimolaire d’oxygène et de protoxyde d’azote (MEOPA). Mais peuvent y être ajoutées toutes les techniques non médicamenteuses, depuis la distraction simple jusqu’à l’hypnose conversationnelle, réalisées par les soignants formés, avec, au minimum, l’éviction d’une communication nocebo. Si les difficultés organisationnelles et humaines des services d’urgence ne facilitent pas leur mise en œuvre, l’anticipation de ces douleurs est pourtant un élément fondamental et doit intervenir le plus tôt possible après l’accueil du patient, voire au moment de cet accueil.
Lorsque la douleur attendue liée à un soin est estimée trop importante, une sédation procédurale doit être préférée à une antalgie « surdosée ». La sédation procédurale fait intervenir d’autres thérapeutiques et d’autres techniques, dans d’autres conditions de surveillance et de sécurité : il est important de ne pas confondre les deux démarches.
Relais antalgiques après le séjour aux urgences
Passée la phase initiale de gestion de la douleur aux urgences, le relais de l’antalgie doit être questionné. Pour les patients hospitalisés, si la morphine doit être maintenue, l’antalgie autocontrôlée (ou analgésie contrôlée par le patient : PCA**), lorsque les conditions d’utilisation sont remplies, est le meilleur choix. Si la PCA n’est pas possible ou que l’analgésie aiguë doit s’associer à une antalgie au long cours (dans les cancers, par exemple), la morphine (orale – sous forme LP [libération prolongée] + LI [libération immédiate] – en comprimés, en sirop, en patch ou en dispositif transmuqueux) peut être utilisée. Comme en aigu, les voies intramusculaire et sous-cutanée ne sont pas adaptées, et il ne faut y avoir recours qu’exceptionnellement, en l’absence de toute alternative possible.
Pour les patients sortants à domicile, la règle est de ne pas automatiser la prescription de morphiniques après son recours hospitalier et de limiter celle-ci au maximum chez les patients naïfs initialement d’opioïdes. Jusqu’à présent, les ordonnances de sortie comprenaient fréquemment des opioïdes faibles ; cette habitude est sans doute liée au faux confort d’esprit du contournement de l’opioïde fort et à la praticité – jusqu’à présent – de sa prescription sur ordonnance libre. Mais depuis le 1er mars 2025, le tramadol, la codéine et la dihydrocodéine sont soumis à une prescription sur ordonnance sécurisée pour une durée maximale de douze semaines, les plaçant au même niveau de contrainte de prescription que la morphine.
Le néfopam per os est disponible depuis 2024, et sa place reste incertaine dans l’arsenal thérapeutique de relais antalgique, en dehors des contre-indications aux AINS.
Cependant, son référencement permettra probablement d’arrêter le mésusage croissant de la forme intraveineuse de ce médicament, dont la prescription hors autorisation de mise sur le marché (AMM) en usage buvable n’a cessé de croître au fil des ans.
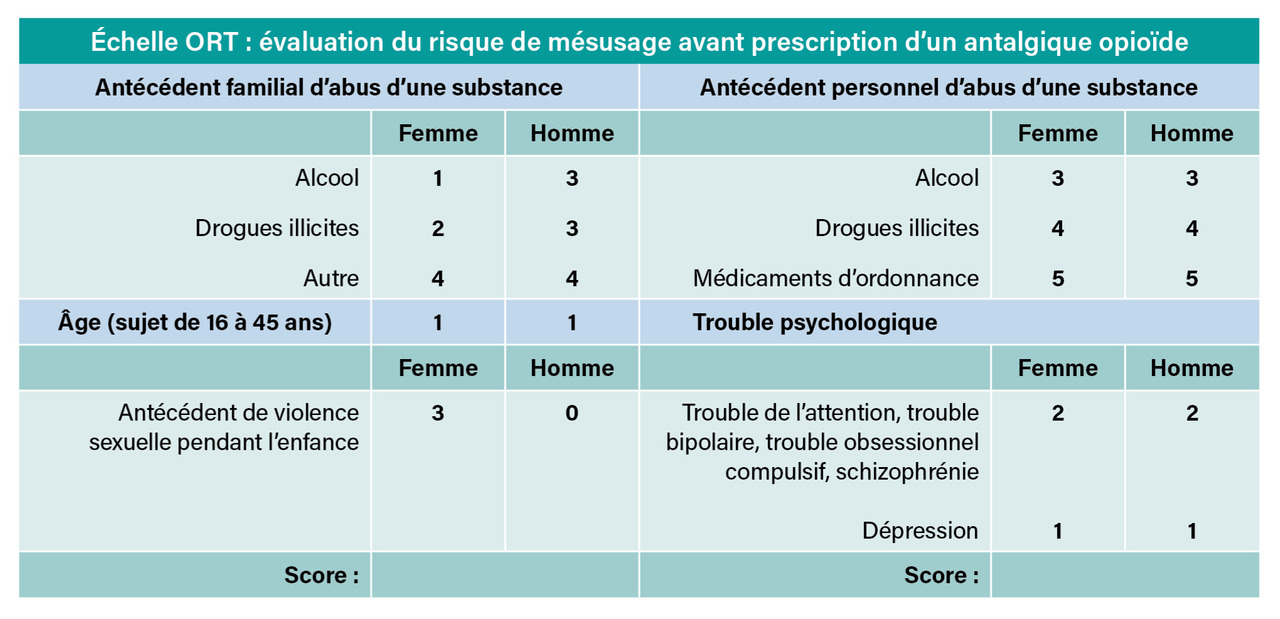
Lorsque les opioïdes apparaissent comme nécessaires, ils sont à prescrire en l’absence de score positif à l’opioid risk tool (inférieur à 4 [fig. 5]), uniquement « à la demande » en complément d’antalgiques simples, et pour une durée maximale de trois à cinq jours. Des études récentes ont montré que, dans 95 % des cas, les patients qui sortent des urgences sous morphiniques les arrêtent spontanément dans ce délai.
Ce délai très court invite à organiser une consultation post-urgence, si possible avec le médecin généraliste ou en service hospitalier (plateformes de consultations, polycliniques) pour réévaluer le patient, consolider l’arrêt si la douleur est contrôlée ou passer à des formes LP (moins addictogènes) si ce n’est pas le cas. Ces recommandations peuvent sembler exigeantes, mais elles sont cohérentes avec celles de la HAS7 sur la prévention du mésusage des opioïdes.
Réévaluer régulièrement le traitement antalgique
Les mesures et traitements antalgiques diffèrent selon la situation d’urgence et en fonction de l’intensité douloureuse (tableau).
La prise en charge de la douleur aux urgences débute par le repérage du patient fragile ou dyscommuniquant ou à risque de sous-traitement ; une première évaluation aboutit à l’administration d’antalgiques si besoin, avec une réévaluation précoce à quarante-cinq minutes. Il est primordial d’éviter toute communication nocebo. Il faut vérifier que le patient désire un traitement médicamenteux et s’il est candidat à rester ambulatoire.
Il est nécessaire de repérer les causes évidentes pour initier immédiatement un traitement ciblé. Toutes les douleurs sévères ne relèvent pas d’un opioïde.
L’utilisation d’opioïdes faibles doit être la plus réduite possible. La morphine titrée reste l’opioïde référent intraveineux.
Il est enfin recommandé de prescrire le moins d’opioïdes possible lors du retour à domicile.
Score de Ramsay
Évaluation de la profondeur de la sédation en réponse à un stimulus :
- 1 : malade anxieux, agité
- 2 : malade coopérant, orienté et calme
- 3 : malade répondant aux ordres
- 4 : malade endormi mais avec une réponse nette à la stimulation de la glabelle ou à un bruit intense
- 5 : malade endormi répondant faiblement aux stimulations ci-dessus
- 6 : pas de réponse aux stimulations nociceptives
Résultats :
- Score 2 - 3 : sédation optimale légère
- Score 4 - 5 : sédation profonde
- Score 6 : surdosage de sédatif
2. Vivien B, Adnet F, Bounes V, et al. Recommandations formalisées d’experts 2010: sédation et analgésie en structure d’urgence (réactualisation de la conférence d’experts de la SFAR de 1999). Ann Fr Med Urgence 2011;1(1):57-71.
3. Raja SN, Carr DB, Cohen M, et al. The revised International Association for the Study of Pain definition of pain: Concepts, challenges, and compromises. Pain 2020;161(9):1976-82.
4. Boccard E, Adnet F, Gueugniaud PY, et al. Prise en charge de la douleur chez l’adulte dans des services d’urgences en France en 2010. Ann Fr Med Urgence 2011;1(5):312-9.
5. Cazenave-Lacroutz A (dir.). Les établissements de santé en 2022, édition 2024. Panoramas de la DREES, 2024.
6. Demoly E, Bara W, Naouri D, et al. (DREES). Urgences hospitalières en 2023 : quelles organisations pour la prise en charge des patients, Études et Résultats, n° 1305, juillet 2024.
7. HAS. Bon usage des médicaments opioïdes : antalgie, prévention et prise en charge du trouble de l’usage et des surdoses, mars 2022.
8. Villoing B, Galinski M, Baron MA, et al. (SFMU). Recommandations formalisées d’experts. Prise en charge de la douleur aiguë en urgence 2024. Annales françaises de médecine d’urgence 2025;15(3):177-203.
9. Lvovschi VE, Hermann K, Lapostolle F, et al. Bedside evaluation of early VAS/NRS based protocols for intravenous morphine in the emergency department: Reasons for poor follow-up and targeted practices. J Clin Med 2021;10(21):5089.
10. Rapport ANSM. État des lieux de la consommation des antalgiques opioïdes et leurs usages problématiques. Février 2019.
11. Beaulieu P, Lussier D, Porreca F, et al. (2015) Pharmacology of Pain 2015.
12. EMC – Médecine d’urgence 2022;16(3):1-12 [article 25-010-C-10].

 Encadrés
Encadrés