La pyélonéphrite aiguë (PNA) se manifeste typiquement par l’apparition brutale d’une fièvre, parfois accompagnée de frissons et d’une douleur en fosse lombaire unilatérale (spontanée ou provoquée par la percussion de la fosse lombaire). Des signes fonctionnels urinaires à type de brûlures permictionnelles, pollakiurie ou urgenturie complètent classiquement le tableau clinique, mais ils sont absents dans 20 % des cas. Des signes digestifs (vomissements, diarrhée) peuvent être présents, et parfois trompeurs car au premier plan clinique.
La PNA survient habituellement de façon spontanée et rarement à la suite d’une cystite : seulement 1 % des femmes avec une cystite développent une PNA dans le mois qui suit.4 Les facteurs de risque de PNA sont l’activité sexuelle, un nouveau partenaire sexuel, l’utilisation de spermicide et des antécédents personnels ou maternels d’infection urinaire. L’infection est également favorisée par la présence d’un obstacle sur les voies urinaires (anomalie anatomique, matériel type sonde en double J, lithiase, grossesse, vessie neurologique), le diabète et des facteurs microbiologiques tels que la virulence et l’inoculum bactériens.5 Moins fréquente chez l’homme, la survenue d’une PNA doit alors systématiquement faire rechercher une uropathie sous-jacente.6
Escherichia coli est la bactérie le plus souvent en cause dans les PNA, en raison de sa capacité à coloniser l’ensemble du tractus urinaire. Elle est à l’origine de plus de 80 % des PNA communautaires survenant chez la femme.7 D’autres entérobactéries, telles que Klebsiella pneumoniae, Proteus mirabilis ou Citrobacter spp., et plus rarement des entérocoques, dont Enterococcus faecalis, peuvent être isolés, notamment en cas de PNA à risque de complication ou survenant chez l’homme.3
Diagnostiquer une pyélonéphrite aiguë
En présence de symptômes évocateurs de PNA, le diagnostic repose sur l’examen cytobactériologique des urines (ECBU), qui doit systématiquement être fait avant de débuter une antibiothérapie probabiliste. Pour être interprétable, un ECBU doit être prélevé après toilette urétrale ou vulvaire, avec recueil du « milieu de jet » ; la technique doit être expliquée aux patients. Bien que l’association d’une bactériurie significative et d’une leucocyturie supérieure ou égale à 104/mL soit habituellement nécessaire pour porter un diagnostic microbiologique, il arrive parfois que le diagnostic de PNA soit posé malgré une bactériurie faible, si celle-ci est associée à des signes cliniques typiques et qu’il n’existe pas de diagnostic différentiel ; la bactériurie peut, en effet, varier en fonction de la concentration des urines. En l’absence de prise d’antibiotique préalable susceptible d’avoir décapité le prélèvement, si l’ECBU est négatif (absence de leucocyturie ou culture négative), les diagnostics différentiels à envisager sont la colique néphrétique, l’appendicite, la cholécystite, etc.
La réalisation d’analyses sanguines n’est pas indiquée en cas de PNA sans signe de gravité survenant chez un patient sans antécédent car elle ne modifie pas la prise en charge.
Une dégradation de la fonction rénale doit faire suspecter un obstacle sur les voies urinaires.
Les hémocultures ne sont pas systématiques : une bactériémie est associée dans environ 50 % des PNA mais n’a de conséquences ni sur la nature ni sur la durée du traitement.
La réalisation d’une imagerie des voies urinaires n’est recommandée que dans de rares situations : suspicion de PNA obstructive (sur lithiase, antécédent de chirurgie urothéliale, cancer urothélial, compression extrinsèque par une masse digestive ou utérine) ; sepsis ou choc septique ; PNA hyperalgique. Le cas échéant, l’examen de première intention est l’échographie des voies urinaires. En cas d’obstacle, celle-ci peut révéler une dilatation des cavités pyélocalicielles, qui nécessite une prise en charge urgente.
Le scanner abdominopelvien avec injection de produit de contraste iodé est l’examen de référence pour rechercher des complications : l’aspect classique de foyer de néphrite correspond à une hypodensité du parenchyme rénal de forme triangulaire à base corticale, mais d’autres signes peuvent être observés, comme l’infiltration de la graisse périrénale ou un épaississement des parois pyéliques. Le scanner peut révéler une dilatation des cavités pyélocalicielles et l’obstacle qui en est à l’origine, une malformation des voies urinaires favorisant la PNA, un abcès rénal (exceptionnel au diagnostic).
Le scanner peut aussi être normal, ce qui n’élimine pas une PNA : le diagnostic est clinique et microbiologique.
Comment prendre en charge une pyélonéphrite aiguë ?
Il convient d’abord d’identifier les formes nécessitant une prise en charge en urgence, puis de choisir l’antibiothérapie probabiliste adaptée selon la présence de facteurs de risque de complication et l’écologie bactérienne.
Éliminer les formes graves
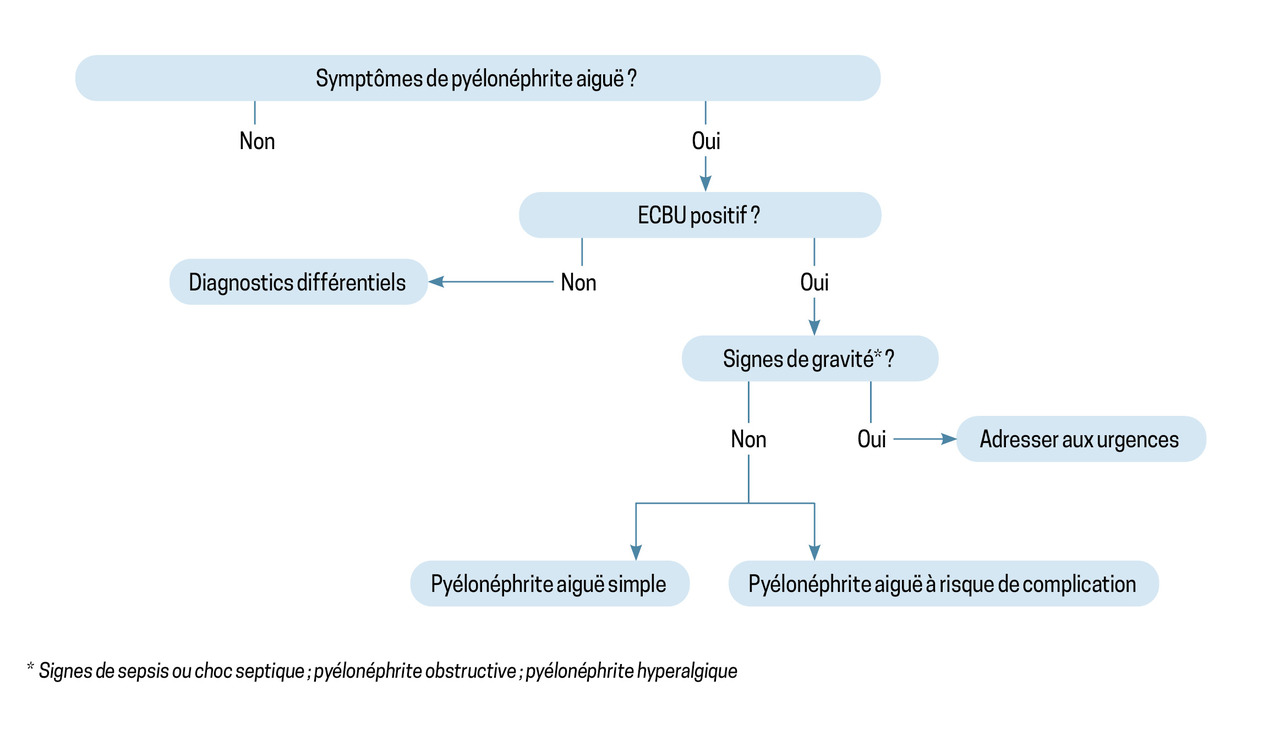
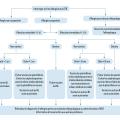
La première étape de la prise en charge d’une PNA est la recherche de signes de gravité, car ils imposent d’adresser le patient aux urgences (fig. 1). Ils incluent : le sepsis ou choc septique, pour lesquels des scores de reconnaissance existent, tels que le National Early Warning Score (NEWS), prenant en compte la température, la pression artérielle systolique, la fréquence cardiaque et respiratoire, la saturation périphérique en oxygène et l’état de conscience ; la PNA obstructive ; la PNA hyperalgique.
Critères pour choisir l’antibiothérapie la plus efficace
Deux éléments essentiels guident le choix de l’antibiotique à prescrire.
Pyélonéphrite aiguë simple ou à risque de complication
Parmi les formes sans signe de gravité, on différencie les PNA « simples », survenant chez la femme jeune sans antécédent, des PNA « à risque de complication » qui concernent la femme enceinte, la femme âgée de plus de 65 ans et en perte d’autonomie ou de plus de 75 ans, l’homme, les personnes immuno-déprimées, les PNA sur matériel (sonde urinaire, sonde en double J, néphrostomie) ou toute anomalie connue de l’arbre urinaire (sténose urétrale, cancer urothélial, lithiases, malformation). Cette distinction est nécessaire car elle guide la durée de l’antibiothérapie.
Connaître l’épidémiologie de l’antibiorésistance pour mieux prescrire
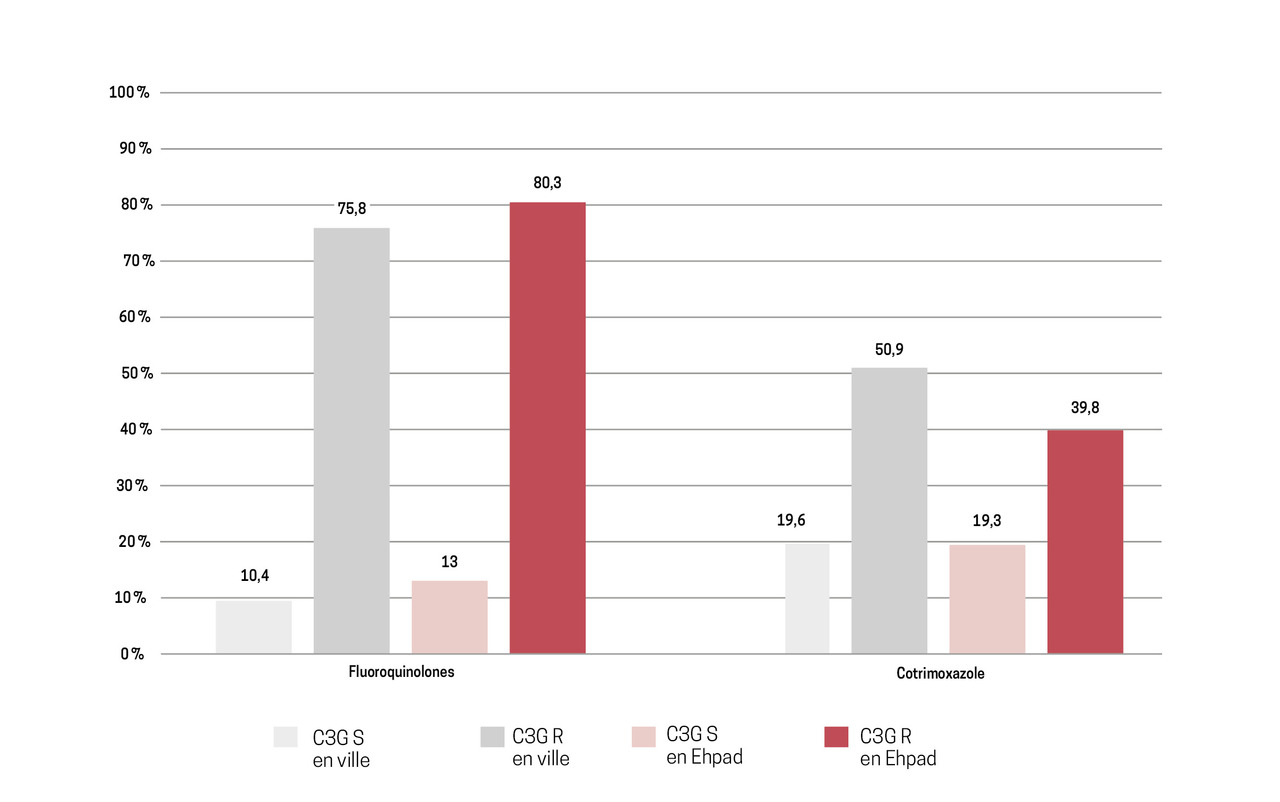
Le choix de l’antibiothérapie est aussi dicté par l’antibiorésistance, laquelle est en augmentation en France. Ainsi en 2022, la prévalence d’E. coli producteur de bêtalactamases à spectre étendu (BLSE) était de 3 % en ville et de 7,7 % en établissement d’hébergement pour personnes âgées dépendantes (Ehpad). La prévalence de la résistance d’E. coli aux fluoroquinolones était de 12,6 % en ville et de 18,7 % en Ehpad. L’association d’une résistance aux céphalosporines de troisième génération (C3G) et d’une résistance aux fluoroquinolones ou au triméthoprime-sulfaméthoxazole est également très fréquente (fig. 2).8
La prévalence des entérobactéries productrices de carbapénémases dans les ECBU de ville reste, quant à elle, très faible (moins de 1 %) mais semble en augmentation.8
Les facteurs de risque identifiés de colonisation de la flore digestive par une entérobactérie productrice de BLSE incluent la vie en Ehpad ou dans toute autre institution de long séjour, un antécédent de colonisation ou d’infection urinaire à entérobactérie productrice de BLSE au cours des six derniers mois, une antibiothérapie par amoxicilline-acide clavulanique, les C2G ou C3G, fluoroquinolones dans les six derniers mois, une hospitalisation récente (dans les trois derniers mois), un voyage en zone d’endémie de BLSE (Italie, Grèce, Europe de l’Est, Asie du Sud-Est notamment).
Recommandations pour le traitement initial
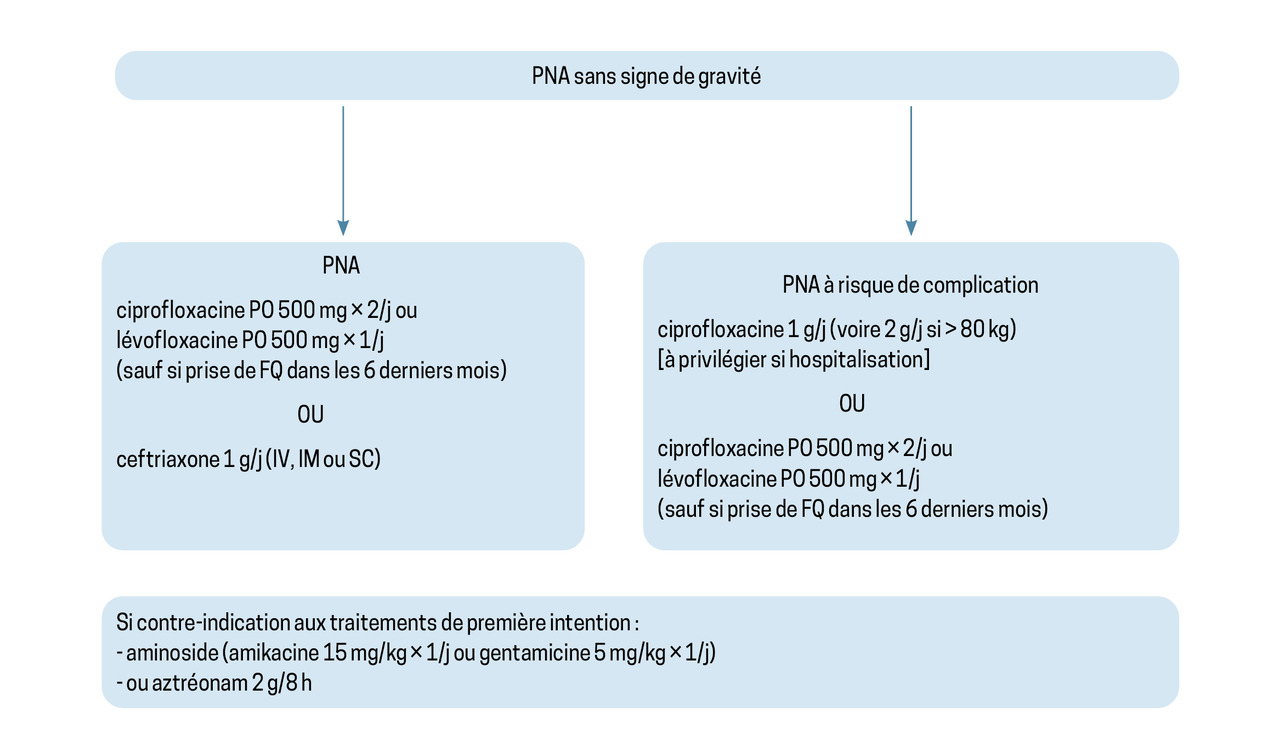
La figure 3, adaptée des recommandations de la Société de pathologie infectieuse de langue française (Spilf) de 2017, présente les options thérapeutiques recommandées en traitement probabiliste.9
Pour une PNA simple sans signe de gravité ni facteur de risque de BLSE, une antibiothérapie probabiliste peut être débutée d’emblée après la réalisation de l’ECBU et repose sur une C3G ou une fluoroquinolone en l’absence de prise de fluoroquinolone dans les six derniers mois. Parmi les C3G, la ceftriaxone a l’avantage d’une administration en une seule dose quotidienne sans adaptation à la fonction rénale. En 2014, l’Agence nationale de sécurité du médicament (ANSM) a restreint son administration aux voies intraveineuse et intramusculaire, mais depuis, plusieurs études ont montré la bonne tolérance et l’efficacité de la voie sous-cutanée.10 Une évolution des recommandations de l’ANSM paraît donc nécessaire.
Les C3G par voie orale ne sont pas validées en traitement probabiliste en raison d’une absorption et d’une diffusion moyennes et très variables selon les personnes. Une vigilance particulière doit être portée aux effets indésirables parfois sévères des fluoroquinolones : confusion, tendinopathie (particulièrement chez les sujets âgés, en cas de corticothérapie concomitante ou chez les insuffisants rénaux), allongement de l’intervalle QT à l’électrocardiogramme. Il est indispensable d’informer les patients du risque de tendinopathie afin d’interrompre rapidement le traitement en cas de douleur tendineuse.
En cas d’allergie vraie aux bêtalactamines (encadré et fig. 4) et de prise de fluoroquinolones dans les six derniers mois, deux options sont validées, disponibles par voie intraveineuse ou intramusculaire : l’aztréonam ou un aminoside en monothérapie. La toxicité rénale et auditive des aminosides limite souvent leur utilisation.
Réévaluer le traitement
Toute antibiothérapie probabiliste doit être réévaluée quarante-huit à soixante-douze heures plus tard, avec examen clinique et adaptation du traitement antibiotique selon les résultats de l’ECBU (identification microbiologique et antibiogramme).
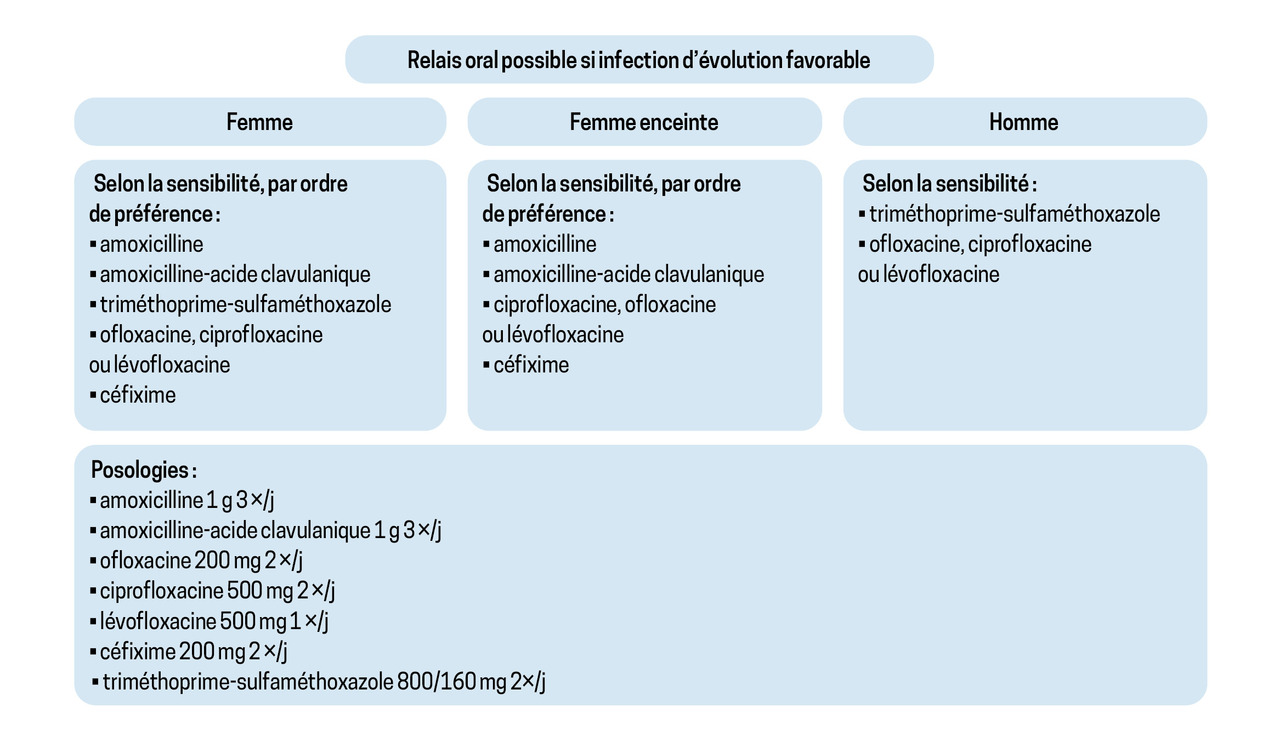
Un relais oral doit être privilégié si la bactérie identifiée est sensible. Les molécules recommandées sont, par ordre alphabétique : amoxicilline, amoxicilline-acide clavulanique, céfixime, fluoroquinolones et triméthoprime-sulfaméthoxazole (fig. 5).9
La fosfomycine, le pivmécillinam et le triméthoprime ne sont pas validés dans le traitement de la PNA à l’heure actuelle. La nitrofurantoïne, quant à elle, ne diffuse pas dans le parenchyme rénal.
En l’absence d’option disponible par voie orale (résistance ou contre-indication), la ceftriaxone est la molécule de choix en cas de bactérie sensible aux C3G.
En cas de résistance aux C3G, principalement par production de BLSE, l’ertapénème est une carbapénème administrable une fois par jour en sous-cutané à la dose de 1 g/j. L’épargne des carbapénèmes est toutefois un enjeu majeur pour limiter la progression de l’antibiorésistance.
Durée de l’antibiothérapie
La durée recommandée de l’antibiothérapie pour une PNA simple est de sept jours en cas de traitement par fluoroquinolones ou bêtalactamines injectables et de dix jours pour les autres molécules.9 Dans le rare cas d’une monothérapie par aminoside, la durée de traitement est de cinq jours.
En cas de PNA à risque de complication, une antibiothérapie de dix à quatorze jours est recommandée quel que soit l’antibiotique utilisé, bien que ceci repose sur un faible niveau de preuve ; en pratique, dix jours de traitement suffisent en cas d’évolution rapidement favorable.9
Peu de place pour les examens complémentaires en surveillance
La surveillance d’une PNA est exclusivement clinique : le contrôle de l’ECBU n’est recommandé qu’en cas d’échec clinique sous traitement, défini comme la persistance de la fièvre et/ou de signes fonctionnels urinaires quarante-huit heures après le début de l’antibiothérapie, ou de récidive symptomatique. En cas d’échec malgré une antibiothérapie adaptée et une bonne observance thérapeutique, la réalisation d’une imagerie des voies urinaires doit être discutée, à la recherche de complications (obstacle, abcès).
Particularités de la PNA chez la femme enceinte
La pyélonéphrite gravidique est à risque de complications, notamment de fausse couche ou d’accouchement prématuré.
La prise en charge initiale est souvent hospitalière. Un avis obstétrical et une échographie des voies urinaires sont systématiques quel que soit le terme.
La plupart des antibiotiques recommandés sont utilisables chez la femme enceinte, excepté le triméthoprime-sulfaméthoxazole, qui doit être évité dans les deux premiers mois de grossesse – le site du CRAT (http ://lecrat.fr) met à disposition des informations sur la sécurité des médicaments durant la grossesse.
Il est nécessaire de contrôler l’ECBU huit à dix jours après le début de l’antibiothérapie, puis une fois par mois jusqu’à l’accouchement.9
Que faire en cas d’allergie médicamenteuse déclarée ?
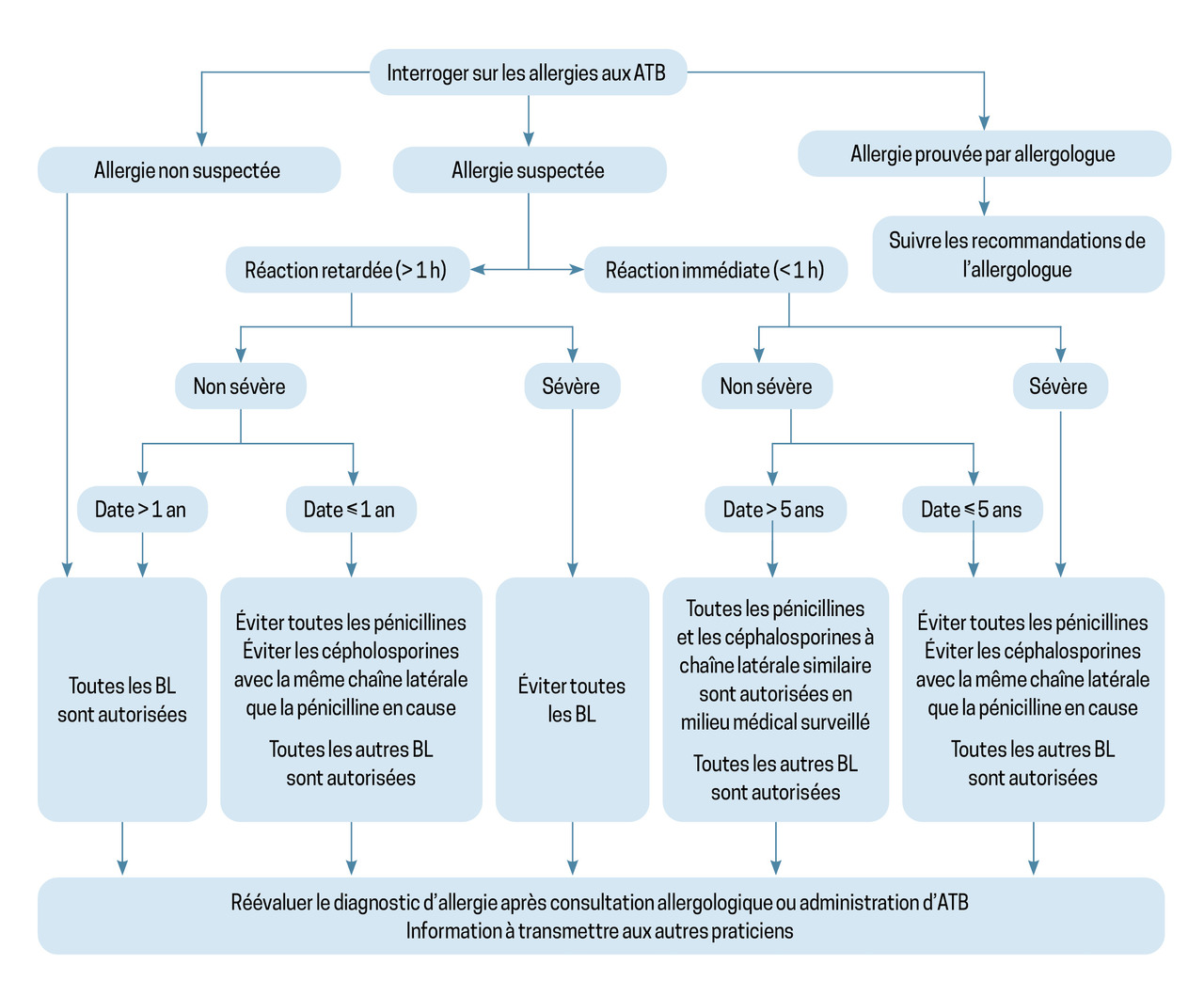
L’allergie à la pénicilline est une des allergies médicamenteuses les plus fréquemment déclarées, mais elle est rare en réalité.11 Une allergie à la pénicilline non confirmée n’est pas sans conséquence, il faut donc, dans la mesure du possible, préciser avec le patient les symptômes l’ayant fait suspecter.
L’allergie peut probablement être d’emblée infirmée en cas de nouvelle prise de l’antibiotique sans réaction depuis la réaction initiale, si les symptômes rapportés ne sont pas compatibles avec une allergie (troubles digestifs isolés ou palpitations par exemple) ou si le délai entre la prise de l’antibiotique en question et les symptômes n’est pas compatible avec une réaction allergique.12
La démarche à suivre dans les autres situations, telle que proposée par Wijnakker et al., est résumée dans lafigure 4.
Que dire à vos patients ?
La pyélonéphrite aiguë (PNA) n’est pas une infection grave, à condition que la prise en charge soit appropriée et rapide.
La technique de réalisation de l’examen cytobactériologique des urines (ECBU) doit être respectée pour une bonne interprétation : le prélèvement doit être précédé d’une hygiène des mains (lavage à l’eau et au savon) et d’une toilette de la région urétrale ou vulvaire à l’eau. Le prélèvement doit être effectué si possible au moins quatre heures après la miction précédente. L’ECBU concerne le « milieu de jet », les 20 premiers millilitres d’urine sont éliminés pour ne recueillir que les 20 - 30 mL suivants dans un flacon stérile sans en toucher le bord supérieur.
Une PNA n’entraîne habituellement pas de séquelle sur la fonction rénale.
Un apport hydrique suffisant (au moins 2 L/j) est suggéré en cas d’infection urinaire.
Une cystite n’évolue qu’exceptionnellement vers une PNA.
En cas d’allergie possible ou prouvée à un antibiotique, une consultation en allergologie est indiquée après traitement de la PNA pour déterminer précisément les antibiotiques contre-indiqués.
2. Boissier R, Savoie PH, Long JA. Epidemiology of urological emergencies in France. Prog Urol 2021;31(15):945‑55.
3. Czaja CA, Scholes D, Hooton TM, et al. Population-Based Epidemiologic Analysis of Acute Pyelonephritis. Clinical Infectious Diseases 2007;45(3):273‑80.
4. Jansåker F, Li X, Vik I, et al. The Risk of Pyelonephritis Following Uncomplicated Cystitis: A Nationwide Primary Healthcare Study. Antibiotics 2022;11(12):1695.
5. Bosch-Nicolau P, Falcó V, Viñado B, et al. A Cohort Study of Risk Factors That Influence Empirical Treatment of Patients with Acute Pyelonephritis. Antimicrob Agents Chemother 2017;61(12):e01317-17.
6. Jang W, Jo HU, Kim B, et al. Comparison of the clinical characteristics of community-acquired acute pyelonephritis between male and female patients. J Infect Chemother 2021;27(7):1013‑9.
7. Scholes D, Hooton TM, Roberts PL, et al. Risk factors associated with acute pyelonephritis in healthy women. Ann Intern Med 2005;142(1):20‑7.
8. Repias : Réseau de prévention des infections associées aux soins. PRIMO : Résultats 2022. Surveillance de la résistance bactérienne aux antibiotiques en soins de ville et en Ehpad. https://bit.ly/4iljfQZ
9. Caron F, Galperine T, Flateau C, et al. Practice guidelines for the management of adult community-acquired urinary tract infections. Med Mal Infect 2018;48(5):327‑58.
10. Jumpertz M, Guilhaumou R, Million M, et al. Subcutaneously administered antibiotics: A review. J Antimicrob Chemother 2022;78(1):1‑7.
11. DesBiens M, Scalia P, Ravikumar S, et al. A Closer Look at Penicillin Allergy History: Systematic Review and Meta-Analysis of Tolerance to Drug Challenge. Am J Med 2020;133(4):452-62.e4.
12. Wijnakker R, van Maaren MS, Bode LGM, et al. The Dutch Working Party on Antibiotic Policy (SWAB) guideline for the approach to suspected antibiotic allergy. Clin Microbiol Infect 2023;29(7):863‑75.

 Encadrés
Encadrés