La juste prescription d’antibiotiques est un enjeu majeur afin de lutter contre l’antibiorésistance, aux lourdes conséquences. Avant d’initier une antibiothérapie, il faut s’efforcer de rassembler les arguments pour une infection bactérienne : en leur absence et en l’absence de signes inquiétants, il est licite de s’abstenir.
L’augmentation inquiétante de la résistance bactérienne aux antibiotiques et le lien direct observé entre consommation d’antibiotiques et résistance amènent à inciter les praticiens à limiter leurs prescriptions d’antibiotiques aux seules situations où cela est justifié. L’impact d’une telle rationalisation est particulièrement important en médecine de ville puisque 90 % des antibiotiques consommés en France le sont dans ce contexte et tout particulièrement pour les infections oto-rhino- laryngées (ORL) et respiratoires hautes ou basses qui représentent deux tiers de l’ensemble des antibiothérapies et sont pourtant souvent virales.1 L’exercice n’est cependant pas si simple dans la vraie vie du fait des difficultés d’orientation diagnostique entre infections virales et bactériennes et parfois de la pression des patients. L’objectif de cet article est de guider les prescripteurs dans ces choix en insistant notamment sur les situations où une antibiothérapie n’est pas nécessaire.
Pourquoi une prescription raisonnée d’antibiotiques ?
Le 3 septembre 1928, de retour de vacances, le futur Prix Nobel Alexander Fleming découvrait la pénicilline. La même année, il envisageait le risque de résistance, et avec une incroyable lucidité écrivait : « La personne irréfléchie qui joue avec un traitement à base de pénicilline est moralement responsable de la mort de l’homme qui succombe à une infection par l’organisme résistant à la pénicilline. »
Ce n’est qu’à partir de 1940 que la fabrication de la pénicilline put devenir industrielle, permettant son utilisation large, mais dès 1944 les premiers cas de résistance à la pénicilline étaient décrits. Aujourd’hui, 90 ans après sa découverte, la résistance aux antibiotiques est devenue un phénomène global et une préoccupation majeure pour les autorités de santé du monde entier : l’antibiorésistance entraîne une augmentation des dépenses médicales, une prolongation des hospitalisations et une hausse de la mortalité au point que, si des mesures radicales ne sont pas prises, l’Organisation mondiale de la santé (OMS) prévoit que, dans une génération, la résistance bactérienne sera la première cause de mortalité au monde (10 millions de décès annuels).
Actuellement, dans le monde, le nombre de décès annuels liés à cette résistance est estimé à près de 700 000, et en Europe, selon le centre européen de prévention et contrôle des maladies (ECDC), il est estimé à 33 000, ce qui est comparable aux décès cumulés liés à la grippe, à la tuberculose et à l’infection par le virus de l’immunodéficience humaine (VIH).2 En France, bien que source de débats, on estime que 120 000 personnes par an sont infectées par une bactérie résistante conduisant à un décès dans 5 000 à 15 000 cas. Les principales résistances aux antibiotiques en France concernent les entérobactéries du tube digestif (bacilles à Gram négatif), en particulier Escherichia coli et Klebsiella pneumoniae, et notamment leur résistance aux céphalosporines de 3e génération (C3G) principalement par la production d’une enzyme bloquant l’action de l’antibiotique appelée bêtalactamase à spectre étendu (BLSE). En ville, de 2008 à 2015, la proportion de souches d’E. coli résistantes aux C3G a été multipliée par 3,7 atteignant 4,8 % de souches résistantes. En établissements de soins, la situation est plus grave : la résistance d’E. coli aux C3G a régulièrement augmenté, de 2,0 % en 2007 à 10,2 % en 2017 (souches isolées d’infections graves). Pour K. pneumoniae, les chiffres sont encore plus alarmants : la proportion de résistance aux C3G est passée de 10,0 % en 2007 à 28,8 % en 2017.3 Concernant les Staphylococcus aureus résistants à la méticilline (SARM), leur proportion diminue depuis près de 10 ans mais représente tout de même 30 % des infections à staphylocoque doré acquises en milieu de soins.
Le surcoût financier imputable à la résistance bactérienne s’élèverait à plus de 1,5 milliard d’euros en Europe et plus de 55 milliards de dollars aux États-Unis. Dans le monde entier, l’antibiorésistance pourrait coûter plus de 100 000 milliards de dollars4 et, pour la Banque mondiale, pourrait avoir un impact économique similaire à celui de la crise financière de 2008.
Qu’elle soit justifiée ou non, la prise d’antibiotiques a des répercussions immédiates, systématiques et prolongées sur le microbiote du patient, cet exceptionnel et impressionnant réservoir de 1014 bactéries du tube digestif, de la peau, des voies respiratoires et de la muqueuse vaginale. Trois antibiotiques, très largement prescrits, sont particulièrement générateurs de résistances bactériennes du fait d’un spectre d’action large : l’association amoxicilline-acide clavulanique, les C3G et les fluoroquinolones. Pourtant, il n’y a pas lieu en général de prescrire l’association amoxicilline-acide clavulanique en première intention, l’amoxicilline seule, aux doses recommandées (2 à 3 g/j), étant le plus souvent suffisante.1
Ce n’est qu’à partir de 1940 que la fabrication de la pénicilline put devenir industrielle, permettant son utilisation large, mais dès 1944 les premiers cas de résistance à la pénicilline étaient décrits. Aujourd’hui, 90 ans après sa découverte, la résistance aux antibiotiques est devenue un phénomène global et une préoccupation majeure pour les autorités de santé du monde entier : l’antibiorésistance entraîne une augmentation des dépenses médicales, une prolongation des hospitalisations et une hausse de la mortalité au point que, si des mesures radicales ne sont pas prises, l’Organisation mondiale de la santé (OMS) prévoit que, dans une génération, la résistance bactérienne sera la première cause de mortalité au monde (10 millions de décès annuels).
Actuellement, dans le monde, le nombre de décès annuels liés à cette résistance est estimé à près de 700 000, et en Europe, selon le centre européen de prévention et contrôle des maladies (ECDC), il est estimé à 33 000, ce qui est comparable aux décès cumulés liés à la grippe, à la tuberculose et à l’infection par le virus de l’immunodéficience humaine (VIH).2 En France, bien que source de débats, on estime que 120 000 personnes par an sont infectées par une bactérie résistante conduisant à un décès dans 5 000 à 15 000 cas. Les principales résistances aux antibiotiques en France concernent les entérobactéries du tube digestif (bacilles à Gram négatif), en particulier Escherichia coli et Klebsiella pneumoniae, et notamment leur résistance aux céphalosporines de 3e génération (C3G) principalement par la production d’une enzyme bloquant l’action de l’antibiotique appelée bêtalactamase à spectre étendu (BLSE). En ville, de 2008 à 2015, la proportion de souches d’E. coli résistantes aux C3G a été multipliée par 3,7 atteignant 4,8 % de souches résistantes. En établissements de soins, la situation est plus grave : la résistance d’E. coli aux C3G a régulièrement augmenté, de 2,0 % en 2007 à 10,2 % en 2017 (souches isolées d’infections graves). Pour K. pneumoniae, les chiffres sont encore plus alarmants : la proportion de résistance aux C3G est passée de 10,0 % en 2007 à 28,8 % en 2017.3 Concernant les Staphylococcus aureus résistants à la méticilline (SARM), leur proportion diminue depuis près de 10 ans mais représente tout de même 30 % des infections à staphylocoque doré acquises en milieu de soins.
Le surcoût financier imputable à la résistance bactérienne s’élèverait à plus de 1,5 milliard d’euros en Europe et plus de 55 milliards de dollars aux États-Unis. Dans le monde entier, l’antibiorésistance pourrait coûter plus de 100 000 milliards de dollars4 et, pour la Banque mondiale, pourrait avoir un impact économique similaire à celui de la crise financière de 2008.
Qu’elle soit justifiée ou non, la prise d’antibiotiques a des répercussions immédiates, systématiques et prolongées sur le microbiote du patient, cet exceptionnel et impressionnant réservoir de 1014 bactéries du tube digestif, de la peau, des voies respiratoires et de la muqueuse vaginale. Trois antibiotiques, très largement prescrits, sont particulièrement générateurs de résistances bactériennes du fait d’un spectre d’action large : l’association amoxicilline-acide clavulanique, les C3G et les fluoroquinolones. Pourtant, il n’y a pas lieu en général de prescrire l’association amoxicilline-acide clavulanique en première intention, l’amoxicilline seule, aux doses recommandées (2 à 3 g/j), étant le plus souvent suffisante.1
Pour ne pas prescrire d’antibiotiques : ne pas être infecté
La lutte contre la résistance aux antibiotiques passe d’abord par la prévention des infections elles-mêmes, le slogan utilisé en 2018 par les agences de santé s’en inspirant « Une infection évitée, c’est un antibiotique préservé ».
La promotion de la vaccination a permis de faire baisser l’incidence des infections et, par conséquent, on le déduit aisément, l’usage des antibiotiques. Par exemple, depuis la mise en place de la vaccination contre le pneumocoque, l’incidence des otites moyennes aiguës et de leurs complications a diminué, tout comme les infections invasives à pneumocoque qui, elles, ont baissé, entre 2009 et 2012, de 50 % chez les enfants âgés de 5 à 15 ans et de 15 % chez les adultes.5, 6 La vaccination antipneumococcique a également eu un impact sur la sensibilité aux antibiotiques de Streptococcus pneumoniae avec une diminution de la circulation des souches résistantes à l’amoxicilline.7 Néanmoins, la France se situe encore parmi les pays européens où sa résistance à la pénicilline ou aux macrolides est la plus élevée.
De même, dans les actes de soins, en cabinet, en établissement d’héber- gement pour personnes âgées dé- pendantes (EHPAD) ou à l’hôpital, l’hygiène des mains, via une large utilisation des solutions hydro- alcooliques, reste le meilleur moyen pour limiter la transmission manuportée de bactéries multirésistantes d’un patient à un autre. La diminution observée de la prévalence des SARM citée plus haut a, en partie, été due à l’introduction des solutions hydro-alcooliques.
La promotion de la vaccination a permis de faire baisser l’incidence des infections et, par conséquent, on le déduit aisément, l’usage des antibiotiques. Par exemple, depuis la mise en place de la vaccination contre le pneumocoque, l’incidence des otites moyennes aiguës et de leurs complications a diminué, tout comme les infections invasives à pneumocoque qui, elles, ont baissé, entre 2009 et 2012, de 50 % chez les enfants âgés de 5 à 15 ans et de 15 % chez les adultes.5, 6 La vaccination antipneumococcique a également eu un impact sur la sensibilité aux antibiotiques de Streptococcus pneumoniae avec une diminution de la circulation des souches résistantes à l’amoxicilline.7 Néanmoins, la France se situe encore parmi les pays européens où sa résistance à la pénicilline ou aux macrolides est la plus élevée.
De même, dans les actes de soins, en cabinet, en établissement d’héber- gement pour personnes âgées dé- pendantes (EHPAD) ou à l’hôpital, l’hygiène des mains, via une large utilisation des solutions hydro- alcooliques, reste le meilleur moyen pour limiter la transmission manuportée de bactéries multirésistantes d’un patient à un autre. La diminution observée de la prévalence des SARM citée plus haut a, en partie, été due à l’introduction des solutions hydro-alcooliques.
Identifier l’infection bactérienne
Fièvre sans infection
La présence d’une fièvre ne veut pas toujours dire infection. La fièvre n’est qu’une réponse de l’hypothalamus à une agression et, si les infections sont le plus fréquemment à l’origine d’une fièvre, d’autres fièvres non infectieuses existent : maladies inflammatoires (vascularites, granulomatoses), thromboses veineuses, agression tissulaire (pancréatite, infarctus tissulaire [myocarde], chirurgie majeure, traumatisme et hématome, cancer ainsi qu’allergie médicamenteuse et thyroïdite…). Une fièvre aiguë (≤ 5 jours) est le plus souvent infectieuse, alors qu’une fièvre persistante (> 20 jours) a plus de 50 % de chance d’être d’origine non infectieuse.
Bactérie ou virus ? L’épineuse question, notamment en cas d’infections ORL : l’aide du TDR
En 2016, 44 % des prescriptions d’antibiotiques en ville concernaient des affections des voies respiratoires hautes (« ORL »).1 Dans les angines, l’enjeu est donc de distinguer les angines virales (70 % des cas chez l’enfant et 90 % des cas chez l’adulte) des angines bactériennes à streptocoque bêta-hémolytique du groupe A, ou Streptococcus pyogenes, qui nécessitent alors un traitement antibiotique afin de prévenir les complications locales (phlegmons) et secon- daires (rhumatisme articulaire aigu notamment). L’utilisation du score clinique de Mac Isaac (tableau 1 ) permet d’affirmer avec quasi-certitude l’origine virale ou non. En effet, chez l’adulte, un score clinique de Mac Isaac inférieur à 2 a une valeur prédictive négative supérieure à 95 % pour éliminer l’origine streptococcique d’une angine. Chez l’enfant, l’utilisation de ce score est moins pertinente. La limite à ce score est sa mémorisation (il est en pratique peu utilisé), ce qui renforce l’intérêt de l’utilisation du test de dépistage rapide du streptocoque A (TDR) qui permet d’identifier une angine d’origine virale lorsqu’il est négatif. Ce TDR « angine » fourni par l’Assurance maladie (à commander gratuitement sur ameli.fr) nécessite une dizaine de minutes. Le praticien doit organiser son temps pour que sa réalisation n’entrave pas le déroulement de la consultation (attente du résultat en salle d’attente par exemple). Il est donc recommandé de pratiquer un TDR chez tout enfant de plus de 3 ans, et tout adulte (en principe avec un score de Mac Isaac ≥ 2) ayant une angine érythémateuse ou érythématopultacée. L’utilisation des TDR « angine » augmente mais est encore à encourager : en 2017, 39,7 % des médecins généralistes en ont commandés contre 30,5 % en 2014.3
On rappelle que l’amoxicilline seule est la molécule recommandée, en première intention, dans l’immense majorité des situations où un traitement antibiotique des infections ORL est justifié. L’amoxicilline-acide clavulanique n’est justifié en première intention que dans le cas d’une otite moyenne aiguë purulente associée à une conjonctivite chez l’enfant ou dans les rares cas de sinusite frontale, ethmoïdale ou sphénoïdale.
On rappelle que l’amoxicilline seule est la molécule recommandée, en première intention, dans l’immense majorité des situations où un traitement antibiotique des infections ORL est justifié. L’amoxicilline-acide clavulanique n’est justifié en première intention que dans le cas d’une otite moyenne aiguë purulente associée à une conjonctivite chez l’enfant ou dans les rares cas de sinusite frontale, ethmoïdale ou sphénoïdale.
Distinguer colonisation et infection : le cas des ECBU
Un prélèvement microbiologique retrouvant des bactéries ne signifie pas forcément la présence d’une infection. Par exemple, en cas de résultats positifs d’un examen cytobactério- logique des urines (ECBU) réalisé « à titre systématique » ou devant des urines troubles, mais en l’absence de plainte clinique et de fièvre (bactériurie asymptomatique), il n’y a pas lieu de prescrire un antibiotique sauf chez la femme enceinte. Sur sonde urinaire, un ECBU positif est souvent en faveur d’une colonisation. En effet, la présence de bactéries dans le biofilm de la sonde ne signe pas systématiquement l’infection, et la leucocyturie dans ce cas est quasi systématique. Il ne faut donc pas faire d’ECBU chez un patient sondé devant des urines troubles en l’absence de symptômes évocateurs. En présence de fièvre et en l’absence d’autres points d’appel infectieux, une infection urinaire sur sonde peut être évoquée si la bactériurie est supérieure ou égale à 105 unités formant colonie (UFC)/mL, quel que soit le seuil de leucocyturie.
De même, la contamination d’un prélèvement est à bien distinguer d’une infection. Ainsi, la positivité d’un seul flacon d’hémocultures à staphylocoque à coagulase négative ou un ECBU positif et/ou à flore polymicrobienne sans leucocyturie ne nécessitent pas d’antibiothérapie.
De même, la contamination d’un prélèvement est à bien distinguer d’une infection. Ainsi, la positivité d’un seul flacon d’hémocultures à staphylocoque à coagulase négative ou un ECBU positif et/ou à flore polymicrobienne sans leucocyturie ne nécessitent pas d’antibiothérapie.
BPCO avec crachats même sales ne signifie pas antibiothérapie
Le traitement des infections respiratoires basses représente 23 % des antibiothérapies initiées en ville. Parmi ces prescriptions, souvent injustifiées, figurent les traitements d’exacerbation des bronchopneumopathies chroniques obstructives (BPCO). L’exacerbation d’une BPCO, et donc l’augmentation des crachats, est une pathologie inflammatoire dont l’origine n’est pas toujours infectieuse. L’indication d’une antibiothérapie est justifiée uniquement chez les patients ayant une BPCO de stade III (volume expiratoire maximal par seconde [VEMS] fait en dehors d’une poussée entre 30 et 50 % de la théorique) avec expectorations franchement purulentes et verdâtres, par amoxicilline seule, ou de stade IV (VEMS < 30 %) par amoxicilline-acide clavulanique. Bien souvent, on ne dispose pas d’épreuve fonctionnelle respiratoire antérieure permettant de classifier la BPCO : dans ce cas, la dyspnée d’effort signe le stade III, et la dyspnée au moindre effort ou dyspnée de repos signe le stade IV. Dans tous les autres cas d’exacer- bation de BPCO (stade I, II et stade III sans expectoration franchement purulente), aucun antibiotique n’est justifié.
Diarrhées infectieuses : antibiothérapie très rarement nécessaire
La majorité des diarrhées infectieuses sont d’origines virales et/ou bénignes avec guérison spontanée. La majorité des gastroentérites ne nécessitent donc pas d’antibiothérapie. Elle n’est indiquée que pour les dysenteries (douleurs abdominales intenses, épreinte, ténesme, mucus et sang dans les selles) associées à de la fièvre ou pour les formes sévères et profuses des diarrhées cholériformes (selles liquides, plutôt afécales). L’identification de levures à type de Candida dans les selles n’est en rien synonyme d’infection (saprophyte du tube digestif) et ne nécessite pas de traitement antifongique.
Pas d’antibiotiques pour les infections superficielles de la peau
Les furoncles et les folliculites ne nécessitent pas d’antibiothérapie sauf en cas de fièvre ou de localisation exposant à une complication (face). Seul un traitement anti- septique local est nécessaire. Les antibiotiques par voie locale n’ont pas démontré leur intérêt. Par ailleurs, la réalisation d’un prélèvement par écouvillon d’une plaie cutanée même d’aspect surinfecté est inutile car les bactéries retrouvées reflètent la flore cutanée saprophyte.
Les situations cliniques ne justifiant pas d’une prescription d’antibiotiques sont résumées dans lafigure 1. La figure 2 propose des règles simples pour éviter des prescriptions inutiles.
Les situations cliniques ne justifiant pas d’une prescription d’antibiotiques sont résumées dans la
Respecter les durées
Chaque indication d’antibiothérapie a une durée bien définie. La majorité de ces durées n’excède pas 7 jours alors que la durée moyenne de toutes les antibiothérapies prescrites, selon l’Agence nationale de sécurité du médicament, était de 9,2 jours en 2016.1 D’une manière générale, la durée de traitement doit être la plus courte possible afin d’éviter la sélection de souches résistantes et limiter l’impact écologique. Les principales durées de traitement sont rappelées dans le tableau 2.
Fièvre sans signe d’appel : pas d’antibiotique en première intention, savoir attendre
La suspicion d’une infection sans signe clinique d’orientation (fièvre « nue ») ne justifie habituellement pas d’antibiotiques. Dans cette situation, en dehors de signes de gravité avérés ou liés au terrain (femmes enceintes, patients immunodéprimés, grand âge), une période d’observation doit être suivie avec réévaluation à 48 heures, l’origine virale étant fréquente.
Rôle des patients ?
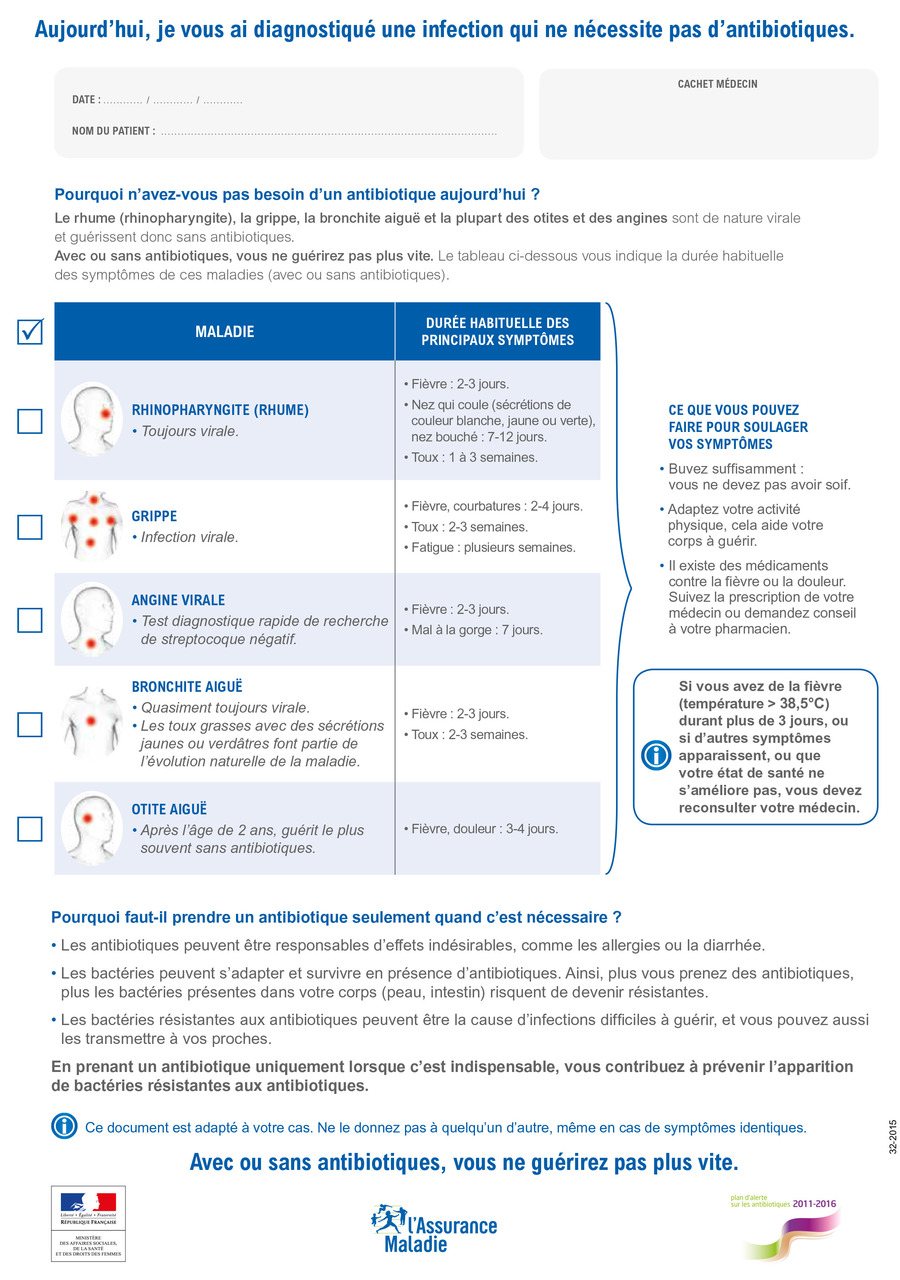
Le souvenir de la campagne « Les antibiotiques, c’est pas automatique » de 2004 facilite la discussion sur l’inutilité des antibiotiques dans les infections virales. Néanmoins, la demande insistante de certains patients peut mettre à mal la volonté de non-prescription d’antibiotiques, l’explication prenant bien plus de temps que la prescription ! En 2015, l’Assurance maladie a édité un document à remettre au patient « Pour-quoi n’avez-vous pas besoin d’un antibiotique aujourd’hui »8 (fig. 3 ) qui a été bien perçu par les patients puisque 93 % d’entre eux déclaraient que ce document les avait aidé à comprendre pourquoi leur médecin ne leur avait pas prescrit d’antibiotique.9
Des signes encourageants ?
L’Assurance maladie a mis en place une rémunération sur objectifs de santé publique (ROSP) des médecins généralistes intégrant le nombre de prescriptions d’antibiotiques chez les patients adultes âgés de 16 à 65 ans sans affection de longue durée. En 2017, pour ces patients, le nombre de prescriptions d’antibiotiques (notamment ceux particulièrement générateurs de résistance) a diminué : -3,4 prescriptions pour 100 patients par rapport à 2016, soit 770 000 prescriptions évitées.10
Un impératif vital
La réduction des prescriptions d’antibiotiques est un impératif vital pour l’avenir. Retenons que la majorité des infections ORL et respiratoires hautes n’en justifient pas, que le TDR « angine » devrait être utilisé devant toute rhinopharyngite, que l’amoxicilline-acide clavulanique n’a quasiment pas d’indication en première intention et que 7 jours est la durée maximal dans la majorité des situations.
Références
1. Agence nationale de sécurité du médicament et des produits de santé. La consommation d’antibiotiques en France en 2016. Rapport annuel, ANSM 2017. https://ansm.sante.fr ou http://bit.ly/2Wknkua
2. Cassini A, Högberg LD, Plachouras D, et al. Attributable deaths and disability-adjusted life-years caused by infections with antibiotic-resistant bacteria in the EU and the European Economic Area in 2015: a population-level modelling analysis. Lancet Infect Dis;2019;19:56-66.
3. Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail, Agence nationale de sécurité du médicament et des produits de santé, Santé publique France. Consommation d’antibiotiques et résistance aux antibiotiques en France : nécessité d’une mobilisation déterminée et durable. ANSES, ANSM, SPF 2018. http://invs.santepubliquefrance.fr ou http://bit.ly/2IVirEY
4. Gandra S, Barter DM, Laxminarayan R. Economic burden of antibiotic resistance: how much do we really know? Clin Microbiol Infect 2014;20:973-80.
5. Lepoutre A, Varon E, Georges S, et al. Impact of the pneumococcal conjugate vaccines on invasive pneumococcal disease in France, 2001-2012. Vaccine 2015;33:359-66.
6. Dagan R, Pelton S, Bakaletz L, Cohen R. Prevention of early episodes of otitis media by pneumococcal vaccines might reduce progression to complex disease. Lancet Infect Dis 2016;16:480-92.
7. Kempf M, Varon E, Lepoutre A, et al. Decline in antibiotic resistance and changes in the serotype distribution of Streptococcus pneumoniae isolates from children with acute otitis media; a 2001-2011 survey by the French Pneumococcal Network. Clin Microbiol Infect 2015;21:35-42.
8. Assurance maladie. Pourquoi n’avez-vous pas besoin d’un antibiotique aujourd’hui ? Ameli, 2015. www.ameli.fr ou http://bit.ly/2ZMZaLf
9. Assurance maladie. Antibiotiques : les actions de l’Assurance maladie pour promouvoir le bon usage ATB : actions de l’Assurance maladie. Rencontres santé publique 2016 de la CNAMTS, 2016.
10. Assurance maladie. ROSP médecin traitant de l’adulte 2017 : focus sur les indicateurs. Ameli, 2018. Available from: www.ameli.fr ou http://bit.ly/2WlkaGO
2. Cassini A, Högberg LD, Plachouras D, et al. Attributable deaths and disability-adjusted life-years caused by infections with antibiotic-resistant bacteria in the EU and the European Economic Area in 2015: a population-level modelling analysis. Lancet Infect Dis;2019;19:56-66.
3. Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail, Agence nationale de sécurité du médicament et des produits de santé, Santé publique France. Consommation d’antibiotiques et résistance aux antibiotiques en France : nécessité d’une mobilisation déterminée et durable. ANSES, ANSM, SPF 2018. http://invs.santepubliquefrance.fr ou http://bit.ly/2IVirEY
4. Gandra S, Barter DM, Laxminarayan R. Economic burden of antibiotic resistance: how much do we really know? Clin Microbiol Infect 2014;20:973-80.
5. Lepoutre A, Varon E, Georges S, et al. Impact of the pneumococcal conjugate vaccines on invasive pneumococcal disease in France, 2001-2012. Vaccine 2015;33:359-66.
6. Dagan R, Pelton S, Bakaletz L, Cohen R. Prevention of early episodes of otitis media by pneumococcal vaccines might reduce progression to complex disease. Lancet Infect Dis 2016;16:480-92.
7. Kempf M, Varon E, Lepoutre A, et al. Decline in antibiotic resistance and changes in the serotype distribution of Streptococcus pneumoniae isolates from children with acute otitis media; a 2001-2011 survey by the French Pneumococcal Network. Clin Microbiol Infect 2015;21:35-42.
8. Assurance maladie. Pourquoi n’avez-vous pas besoin d’un antibiotique aujourd’hui ? Ameli, 2015. www.ameli.fr ou http://bit.ly/2ZMZaLf
9. Assurance maladie. Antibiotiques : les actions de l’Assurance maladie pour promouvoir le bon usage ATB : actions de l’Assurance maladie. Rencontres santé publique 2016 de la CNAMTS, 2016.
10. Assurance maladie. ROSP médecin traitant de l’adulte 2017 : focus sur les indicateurs. Ameli, 2018. Available from: www.ameli.fr ou http://bit.ly/2WlkaGO
Dans cet article
- Pourquoi une prescription raisonnée d’antibiotiques ?
- Pour ne pas prescrire d’antibiotiques : ne pas être infecté
- Identifier l’infection bactérienne
- Respecter les durées
- Fièvre sans signe d’appel : pas d’antibiotique en première intention, savoir attendre
- Rôle des patients ?
- Des signes encourageants ?
- Un impératif vital