Lors de la survenue d’une crise d’épilepsie, le bilan paraclinique a pour objectif d’établir le diagnostic syndromique de l’épilepsie et d’évaluer le risque de récidive de crise. En effet, ce risque est très variable, allant de 23 à 71 % après une première crise, selon les études.1,2 Les deux principaux facteurs de risque sont l’existence d’une lésion sous-jacente et la présence d’anomalies épileptiques à l’électroencéphalogramme (EEG), ces deux facteurs étant cumulatifs. L’estimation de ce risque entraîne des conséquences thérapeutiques importantes : en effet, dans le cas où le bilan permet de conclure à un haut risque de récidive de crise, l’indication d’un traitement antiépileptique est la norme, alors que dans le cas d’une crise isolée avec un bilan paraclinique négatif, un traitement n’est habituellement pas indiqué.
Les deux examens-clés de ce bilan sont l’imagerie cérébrale, qui doit être une imagerie par résonance magnétique (IRM) cérébrale de bonne qualité afin de rechercher une anomalie structurelle causale sous-jacente, et l’EEG, à la recherche d’anomalies épileptiques intercritiques. D’autres examens peuvent parfois être utiles selon le contexte, mais ces deux examens constituent, en association avec les données cliniques, la base du raisonnement du clinicien et sont finalement les seuls examens nécessaires dans la majorité des cas.
Les deux examens-clés de ce bilan sont l’imagerie cérébrale, qui doit être une imagerie par résonance magnétique (IRM) cérébrale de bonne qualité afin de rechercher une anomalie structurelle causale sous-jacente, et l’EEG, à la recherche d’anomalies épileptiques intercritiques. D’autres examens peuvent parfois être utiles selon le contexte, mais ces deux examens constituent, en association avec les données cliniques, la base du raisonnement du clinicien et sont finalement les seuls examens nécessaires dans la majorité des cas.
Imagerie cérébrale
L’imagerie cérébrale est une exploration cruciale dans le bilan étiologique initial d’une épilepsie. L’examen radiologique habituellement réalisé aux urgences, où le patient qui présente une première crise d’épilepsie est pris en charge dans la majorité des cas, est une tomodensitométrie (TDM) cérébrale, ou scanner cérébral. La TDM peut permettre de dépister certaines causes secondaires d’épilepsie, telles qu’une lésion tumorale suffisamment volumineuse ou une lésion hémorragique, mais elle ne peut visualiser de nombreuses autres causes. La TDM cérébrale est donc insuffisante et il est recommandé que tous les patients ayant une première crise d’épilepsie de cause inconnue puissent bénéficier d’une IRM cérébrale dès que possible.
Afin que cette IRM cérébrale puisse être la plus pertinente possible, elle doit répondre à un certain nombre de critères. Au niveau des caractéristiques techniques de la machine d’IRM, il faut privilégier un appareil à 3 teslas qui permet une meilleure résolution spatiale qu’une IRM à 1,5 tesla. Les séquences nécessaires, ainsi que les séquences optionnelles, ont fait l’objet de recommandations de la Ligue internationale contre l’épilepsie (ILAE)3,4 ; il est donc important de s’assurer que celles-ci ont bien été respectées. Les séquences nécessaires à effectuer pour tout bilan d’épilepsie (tableau ) sont :
Afin que cette IRM cérébrale puisse être la plus pertinente possible, elle doit répondre à un certain nombre de critères. Au niveau des caractéristiques techniques de la machine d’IRM, il faut privilégier un appareil à 3 teslas qui permet une meilleure résolution spatiale qu’une IRM à 1,5 tesla. Les séquences nécessaires, ainsi que les séquences optionnelles, ont fait l’objet de recommandations de la Ligue internationale contre l’épilepsie (ILAE)3,4 ; il est donc important de s’assurer que celles-ci ont bien été respectées. Les séquences nécessaires à effectuer pour tout bilan d’épilepsie (
- une séquence 3D T1 pour visualiser avec précision l’anatomie structurelle cérébrale et d’éventuelles anomalies de celle-ci, par exemple une anomalie du développement cortical, une atrophie corticale (diffuse ou focale, comme une atrophie hippocampique dans le cadre d’une sclérose hippocampique), une séquelle de lésion ancienne anté- ou néonatale... ;
- une séquence 3D T2 FLAIR qui, grâce à un meilleur contraste entre les tissus sains et pathologiques, permet de dépister nombre de lésions épileptogènes (tumeur gliale, hypersignal hippocampique dans le cadre d’une sclérose hippocampique…) ;
- une séquence coronale T2 acquise dans un plan perpendiculaire à l’axe hippocampique afin d’étudier finement la structure interne de l’hippocampe qui est la localisation la plus fréquente d’une lésion épileptogène. La sclérose hippocampique était la pathologie majo–ritaire il y a quelques années, mais on observe actuellement une diminution de sa prévalence et une augmentation de la détection d’autres types de lésions hippocampiques qui étaient autrefois difficiles à mettre en évidence avec des imageries de moins bonne qualité (tumeurs neuro-épithéliales dysembryoplasiques [DNET], gangliogliomes, dysplasies hippocampiques…).
- une séquence de susceptibilité magnétique (T2*/SWI) qui est extrêmement sensible à la présence de fer, et donc de sang, dans les tissus ; elle permet ainsi de mettre en évidence des lésions hémorragiques, y compris anciennes. Elle est particulièrement pertinente en cas d’antécédent de traumatisme crânien. Elle montre également les lésions calcifiées (bien qu’il soit parfois difficile de distinguer à l’IRM une lésion calcifiée d’une lésion hémorragique, la confrontation avec une TDM cérébrale pouvant alors être utile), telles que les lésions de neurocysticercose, une pathologie relativement rare en France métropolitaine mais qui est la cause la plus fréquente d’épilepsie focale à l’échelle mondiale et qui doit donc être recherchée chez les patients originaires de régions endémiques ;
- une séquence T1 après injection de gadolinium, qui a l’inconvénient évident de nécessiter une injection, mais peut cependant être nécessaire en fonction du contexte, par exemple en cas de suspicion de lésion néoplasique ou infectieuse (abcès cérébral, encéphalite…).
Électrophysiologie
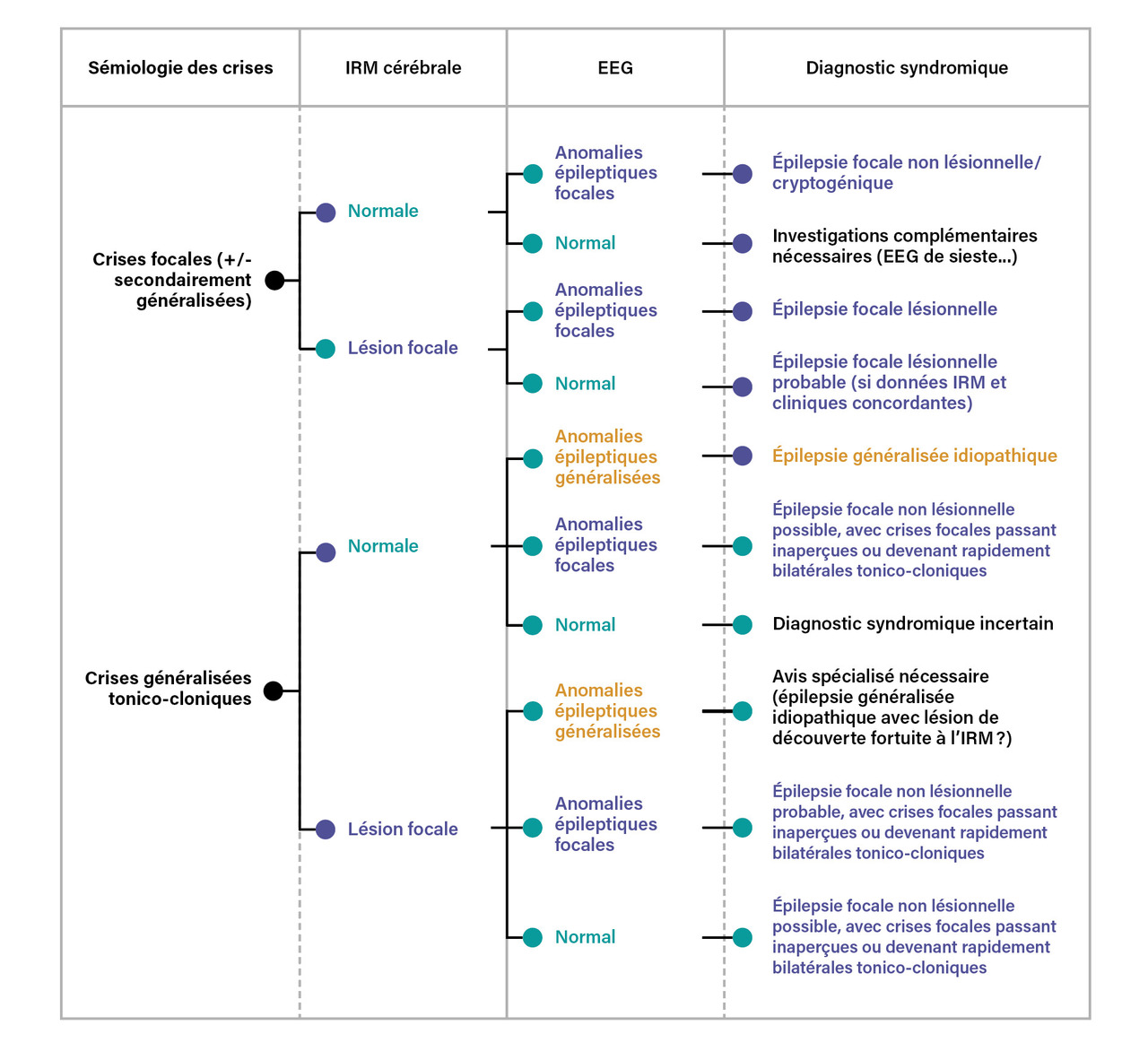
L’EEG est le second examen-clé du bilan étiologique d’un patient épileptique. Son but est de rechercher des anomalies épileptiques intercritiques, survenant de façon sporadique et aléatoire chez les patients épileptiques, qui sont d’une grande aide pour le diagnostic syndromique (figure ). Il peut s’agir d’anomalies focales, présentes uniquement dans une région cérébrale donnée, ou généralisées, enregistrées simultanément sur l’ensemble des électrodes. La présence d’anomalies épileptiques focales, si elle concorde avec les données cliniques (la sémiologie des crises) et/ou radiologiques, permet d’établir assez clairement le diagnostic syndromique d’épilepsie focale provenant de cette région. D’un autre côté, la présence d’anomalies épileptiques généralisées est une signature des épilepsies généralisées idiopathiques, dans lesquelles l’imagerie cérébrale est par définition normale ; l’EEG est ainsi le seul examen paraclinique permettant d’apporter des éléments positifs en faveur de ce diagnostic ; la concordance de l’EEG, des manifestations cliniques et de la normalité de l’imagerie cérébrale permet alors de retenir ce diagnostic syndromique.
L’EEG est cependant un examen dont la sensibilité reste assez moyenne : en effet, il enregistre l’activité électrique cérébrale sur une courte période, de l’ordre de quelques dizaines de minutes, et cette activité peut être parfaitement normale durant cet intervalle, y compris chez des patients épileptiques.
Un EEG normal n’élimine donc pas le diagnostic d’épilepsie, mais il existe plusieurs façons d’en augmenter la sensibilité. En premier lieu, la réalisation de manœuvres de stimulation durant l’examen (par hyperpnée et stimulation lumineuse intermittente) augmente les chances de mettre en évidence des anomalies épileptiques intercritiques. Ces manœuvres sont de réalisation habituelle au cours des examens EEG programmés mais sont rarement effectuées sur les EEG aux urgences. De plus, aux urgences, les EEG sont fréquemment réalisés avec un nombre plus faible d’électrodes (la plupart des EEG effectués au lit le sont avec 8 électrodes contre 21 électrodes pour les EEG programmés), ce qui en diminue d’autant la résolution spatiale et donc la sensibilité. Si un EEG réalisé aux urgences n’apporte donc pas d’élément contributif, il doit être complété par un EEG standard au laboratoire d’électrophysiologie ou au cabinet du neurologue.
De plus, il est important de ne pas hésiter à répéter un examen électrophysiologique au cas où le premier serait normal. En effet, la sensibilité de l’EEG augmente avec la répétition, passant de 39 à 50 % après un seul EEG et à 68 à 84 % après trois EEG5,6 ; il n’y a pas de bénéfice à réaliser plus de trois ou quatre examens lorsque ceux-ci sont négatifs.
Enfin, la réalisation d’un EEG de sieste après privation partielle de sommeil améliore également la sensibilité de l’examen. La privation de sommeil, qui est un facteur fréquemment déclencheur de crises d’épilepsie, augmente également les chances de survenue d’anomalies épileptiques intercritiques, de même que l’enregistrement d’un endormissement, des premiers stades de sommeil et d’un réveil, en particulier dans certains syndromes pour lesquels les manifestations cliniques sont associées au sommeil ou au réveil.
L’EEG est cependant un examen dont la sensibilité reste assez moyenne : en effet, il enregistre l’activité électrique cérébrale sur une courte période, de l’ordre de quelques dizaines de minutes, et cette activité peut être parfaitement normale durant cet intervalle, y compris chez des patients épileptiques.
Un EEG normal n’élimine donc pas le diagnostic d’épilepsie, mais il existe plusieurs façons d’en augmenter la sensibilité. En premier lieu, la réalisation de manœuvres de stimulation durant l’examen (par hyperpnée et stimulation lumineuse intermittente) augmente les chances de mettre en évidence des anomalies épileptiques intercritiques. Ces manœuvres sont de réalisation habituelle au cours des examens EEG programmés mais sont rarement effectuées sur les EEG aux urgences. De plus, aux urgences, les EEG sont fréquemment réalisés avec un nombre plus faible d’électrodes (la plupart des EEG effectués au lit le sont avec 8 électrodes contre 21 électrodes pour les EEG programmés), ce qui en diminue d’autant la résolution spatiale et donc la sensibilité. Si un EEG réalisé aux urgences n’apporte donc pas d’élément contributif, il doit être complété par un EEG standard au laboratoire d’électrophysiologie ou au cabinet du neurologue.
De plus, il est important de ne pas hésiter à répéter un examen électrophysiologique au cas où le premier serait normal. En effet, la sensibilité de l’EEG augmente avec la répétition, passant de 39 à 50 % après un seul EEG et à 68 à 84 % après trois EEG5,6 ; il n’y a pas de bénéfice à réaliser plus de trois ou quatre examens lorsque ceux-ci sont négatifs.
Enfin, la réalisation d’un EEG de sieste après privation partielle de sommeil améliore également la sensibilité de l’examen. La privation de sommeil, qui est un facteur fréquemment déclencheur de crises d’épilepsie, augmente également les chances de survenue d’anomalies épileptiques intercritiques, de même que l’enregistrement d’un endormissement, des premiers stades de sommeil et d’un réveil, en particulier dans certains syndromes pour lesquels les manifestations cliniques sont associées au sommeil ou au réveil.
Autres examens
Bilan biologique sanguin
Un bilan biologique sanguin est habituellement réalisé aux urgences après la survenue d’une crise d’épilepsie ou d’une perte de connaissance non étiquetée. Ce bilan a deux intérêts principaux : apporter des arguments en faveur du diagnostic de crise d’épilepsie et rechercher certaines causes de crise, en particulier des anomalies métaboliques.
Les examens utiles sont ainsi :
Les examens utiles sont ainsi :
- la recherche d’anomalies biologiques post-critiques ; une crise généralisée tonico-clonique est un événement qui occasionne une activité métabolique cellulaire intense, en particulier au niveau musculaire. En conséquence, il est fréquent de retrouver en post-critique une élévation du taux de créatine phosphokinase (CPK) et une élévation des lactates. Leur élévation est cependant transitoire et les taux reviennent rapidement à la normale. De plus, la sensibilité et la spécificité de ces anomalies sont loin d’être parfaites. Elles peuvent néanmoins être un élément en faveur du diagnostic, ce qui peut s’avérer utile, par exemple lorsqu’il n’y a pas eu de témoin de la crise ;
- la recherche d’un trouble métabolique favorisant certains désordres hydroélectrolytiques pouvant être responsables de crise chez des patients non connus comme souffrant d’épilepsie, ou des facteurs aggravants de l’épilepsie chez des patients souffrant d’épilepsie. Les désordres hydroélectrolytiques sont rarement impliqués chez les sujets jeunes, mais ils deviennent une cause beaucoup plus fréquemment observée chez les sujets âgés. Les principaux troubles métaboliques impliqués dans la survenue d’une crise d’épilepsie sont les dysnatrémies (hypo- et hypernatrémie) et, plus rarement, les dyscalcémies (hypo- et hypercalcémies).
Analyse du liquide cérébrospinal
L’analyse du liquide cérébrospinal (LCS) n’est pas de pratique courante après une crise d’épilepsie, mais peut être justifiée aux urgences dans certaines situations particulières. L’indication principale d’une ponction lombaire est la recherche d’une cause infectieuse, en cas de suspicion de méningoencéphalite (en particulier une méningoencéphalite herpétique, qui s’accompagne dans 50 à 75 % des cas7,8 de manifestations épileptiques à la phase aiguë). Elle peut également être utile en cas de suspicion d’encéphalite auto-immune, pour rechercher une synthèse intrathécale d’immunoglobulines ou la présence d’anticorps antineuronaux dans le liquide céphalorachidien (LCR).
Examens d’imagerie complémentaires
Une imagerie vasculaire, angio-TDM ou angio-IRM cérébrale, peut être un examen paraclinique de seconde intention pour rechercher des malformations vasculaires cérébrales (malformation artérioveineuse…). Cela reste une origine très rare d’épilepsie, mais lorsque l’imagerie initiale le suggère, ces séquences vasculaires sont alors cruciales pour établir ce diagnostic qui modifie fortement la prise en charge thérapeutique du patient. Dans ce cas, il doit en effet être référé à une équipe spécialisée pour discuter la réalisation d’un traitement par neuroradiologie interventionnelle ou une prise en charge neurochirurgicale.
Bilan génétique
Le bilan génétique est traité dans le Focus « Épilepsies génétiques : quels tests, pour qui, pourquoi ? » page 977 .
Essentielle estimation du risque de récidive de crise
La réalisation d’une IRM cérébrale de bonne qualité et d’au moins un EEG est indispensable dans le bilan étiologique initial d’une épilepsie. Ces examens permettent, en association avec les données cliniques, de préciser le diagnostic syndromique ainsi que d’estimer le risque de récidive de crise, dont découle l’indication ou non d’un traitement antiépileptique de fond. Il est, par ailleurs, important de noter qu’après une première crise, le risque de récidive est maximal dans les six premiers mois puis décroît avec le temps, et que ce risque peut être réduit par l’introduction d’un traitement antiépileptique de fond.9,10 La réalisation de ce bilan étiologique le plus tôt possible après la survenue d’une première crise permet de discuter rapidement l’introduction ou non d’un traitement antiépileptique afin de potentiellement prévenir la survenue de crises ultérieures.
Références
1. Berg AT, Shinnar S. The risk of seizure recurrence following a first unprovoked seizure: A quantitative review. Neurology 1991;41(7):965-72.
2. Berg AT. Risk of recurrence after a first unprovoked seizure. Epilepsia 2008;49(s1):13-8.
3. Bernasconi A, Cendes F, Theodore WH, et al. Recommendations for the use of structural magnetic resonance imaging in the care of patients with epilepsy: A consensus report from the International League Against Epilepsy Neuroimaging Task Force. Epilepsia 2019;epi.15612.
4. Wang I, Bernasconi A, Bernhardt B, et al. MRI essentials in epileptology: A review from the ILAE Imaging Taskforce. Epileptic Disord 2020;22(4):421-37.
5. Baldin E, Hauser WA, Buchhalter JR, et al. Yield of epileptiform electroencephalogram abnormalities in incident unprovoked seizures: A population-based study. Epilepsia 2014;55(9):1389-98.
6. Salinsky M, Kanter R, Dasheiff RM. Effectiveness of multiple EEGs in supporting the diagnosis of epilepsy: An operational curve. Epilepsia 1987;28(4):331-4.
7. Misra UK, Kalita J. Seizures in encephalitis: Predictors and outcome. Seizure 2009;18(8):583-7.
8. Whitley RJ. Herpes simplex encephalitis: Adolescents and adults. Antiviral Res 2006;71(2):141-88.
9. First Seizure Trial Group. Randomized clinical trial on the efficacy of antiepileptic drugs in reducing the risk of relapse after a first unprovoked tonic‐clonic seizure. Neurology 1993;43(3 Part 1):478-83.
10. Marson A, Jacoby A, Johnson A, et al. Immediate versus deferred antiepileptic drug treatment for early epilepsy and single seizures: A randomised controlled trial. The Lancet 2005;365(9476):2007-13.
2. Berg AT. Risk of recurrence after a first unprovoked seizure. Epilepsia 2008;49(s1):13-8.
3. Bernasconi A, Cendes F, Theodore WH, et al. Recommendations for the use of structural magnetic resonance imaging in the care of patients with epilepsy: A consensus report from the International League Against Epilepsy Neuroimaging Task Force. Epilepsia 2019;epi.15612.
4. Wang I, Bernasconi A, Bernhardt B, et al. MRI essentials in epileptology: A review from the ILAE Imaging Taskforce. Epileptic Disord 2020;22(4):421-37.
5. Baldin E, Hauser WA, Buchhalter JR, et al. Yield of epileptiform electroencephalogram abnormalities in incident unprovoked seizures: A population-based study. Epilepsia 2014;55(9):1389-98.
6. Salinsky M, Kanter R, Dasheiff RM. Effectiveness of multiple EEGs in supporting the diagnosis of epilepsy: An operational curve. Epilepsia 1987;28(4):331-4.
7. Misra UK, Kalita J. Seizures in encephalitis: Predictors and outcome. Seizure 2009;18(8):583-7.
8. Whitley RJ. Herpes simplex encephalitis: Adolescents and adults. Antiviral Res 2006;71(2):141-88.
9. First Seizure Trial Group. Randomized clinical trial on the efficacy of antiepileptic drugs in reducing the risk of relapse after a first unprovoked tonic‐clonic seizure. Neurology 1993;43(3 Part 1):478-83.
10. Marson A, Jacoby A, Johnson A, et al. Immediate versus deferred antiepileptic drug treatment for early epilepsy and single seizures: A randomised controlled trial. The Lancet 2005;365(9476):2007-13.