Depuis les années 1980, la chirurgie conservatrice suivie d’une radiothérapie postopératoire est devenue le standard thérapeutique pour la plupart des sarcomes des tissus mous des membres.1,2 Le bénéfice de l’association radio-chirurgicale est surtout observé chez des patients avec des tumeurs de haut grade, de localisation profonde et de taille supérieure à 5 cm.3,4
Des exceptions à l’indication de radiothérapie sont envisageables pour des tumeurs dites à faible risque de récidive, comme des tumeurs de bas grade de taille inférieure à 5 cm et/ou de localisation superficielle qui ont bénéficié d’une chirurgie en monobloc et en marges saines. En l’absence d’essais randomisés sur cette question, l’équipe du Memorial Sloan Kettering Cancer Center propose un nomogramme afin de prédire le risque de récidive locale après chirurgie exclusive si le risque estimé à trois et cinq ans est faible et si la localisation de la tumeur permet une reprise chirurgicale conservatrice en cas de récidive ; l’abstention de la radiothérapie adjuvante pourrait alors être envisagée après discussion en réunion de concertation pluridisciplinaire (RCP) sarcomes et en proposant une surveillance rapprochée.5
Planification de la radiothérapie
Les stratégies de radiothérapie pré- ou postopératoire donnent des taux similaires de contrôle local et de survie.6 En présence de facteurs de mauvais pronostic, la radiothérapie préopératoire est privilégiée en raison de la possibilité d’induire une réduction du volume tumoral ainsi que la sécurisation des marges d’exérèse. La définition des volumes cibles est également plus précise et réduite comparativement à ceux définis lors d’une radiothérapie postopératoire, ce qui permet la diminution à long terme des complications radio-induites tardives (fibrose, fracture osseuse, œdème, raideur articulaire) et un meilleur pronostic fonctionnel avec une qualité de vie améliorée. Toutefois, l’inconvénient de placer la radiothérapie avant l’exérèse chirurgicale est d’augmenter le risque de complications liées à la cicatrisation. Ces stratégies doivent être mises en place après discussion en RCP spécialisée par des équipes entraînées, prenant en compte la localisation de la tumeur ainsi que les possibilités de prévention des complications.
La dose de radiothérapie externe est ainsi adaptée en fonction du timing de la radiothérapie mais aussi selon la qualité des marges d’exérèse, principal facteur prédictif de récidive locale. On délivre 50 Gy en 25 fractions en cas de radiothérapie préopératoire ou en postopératoire en cas de résection en marges saines et 60 Gy en 30 fractions en cas de résection en marges limites ou microscopiquement atteintes, dites R1.
Modalités de la radiothérapie et impact sur la survenue de possibles complications
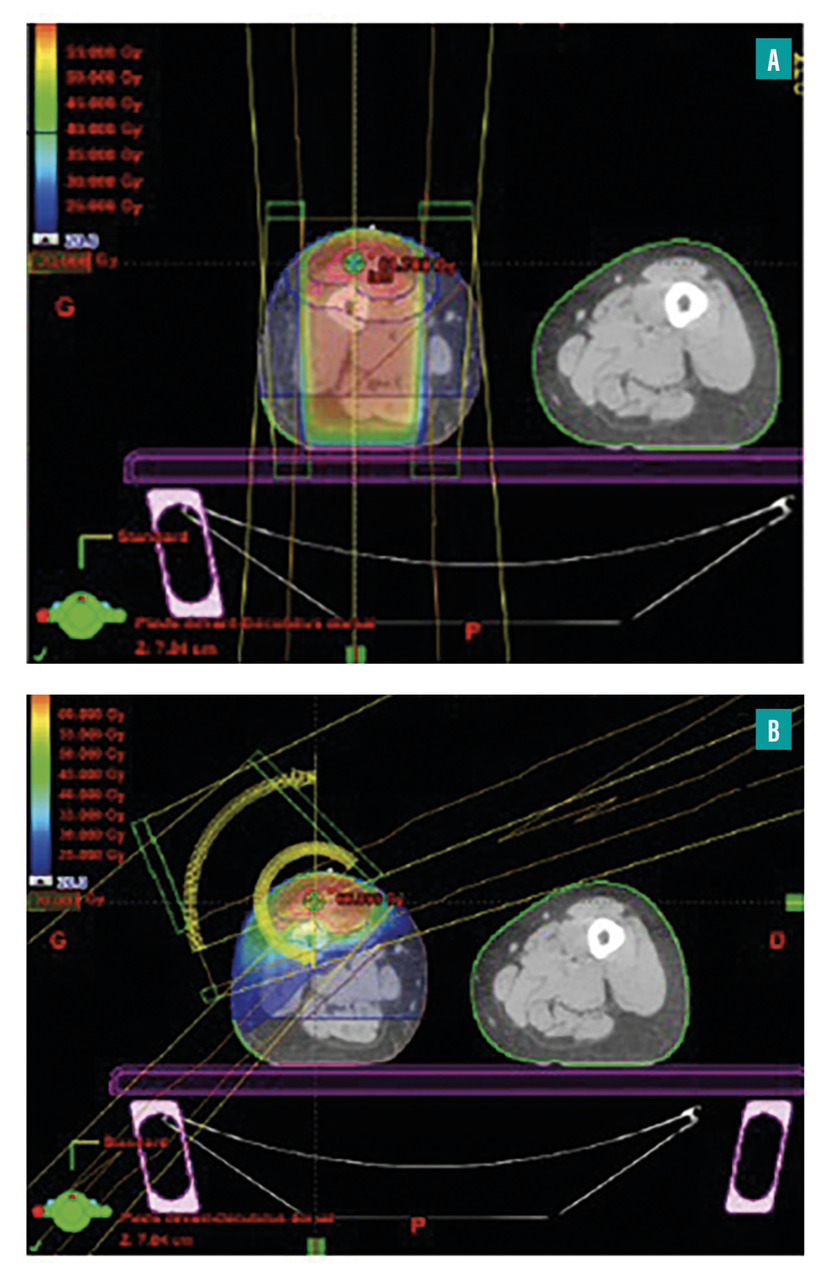
Classiquement, la radiothérapie des sarcomes des membres utilisait deux faisceaux d’irradiation opposés en forme de tunnel qui couvraient l’ensemble du volume cible avec d’importantes marges de sécurité, entraînant une irradiation de l’ensemble des compartiments musculaires du membre. De ce fait, il était difficile, d’une part, de protéger les organes à risque, comme la peau et l’os, et, d’autre part, d’apporter une irradiation homogène sur des volumes complexes et irréguliers avec d’importantes différences d’épaisseur par zone (fig. A).
Même si la toxicité aiguë est souvent limitée à la peau, et la récupération est en général complète en quelques semaines, de nombreux patients présentent des effets indésirables tardifs radio-induits après radiothérapie conformationnelle en 3D tels que fibrose cutanée et sous-cutanée (57 %), raideur articulaire (32 %), contractures musculaires (20 %), œdème du membre (19 %), douleurs (7 %) et, de manière beaucoup moins fréquente mais potentiellement beaucoup plus grave, fracture osseuse (6 %) et complications vasculaires (1,7 %).7 La survenue de ces effets indésirables tardifs est intimement liée à l’étendue du volume d’irradiation.8
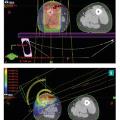
L’accessibilité actuelle aux examens d’imagerie (imagerie par résonance magnétique [IRM] et scanner), permettant une définition plus précise du volume cible à irradier, et l’utilisation de nouvelles technologies (radiothérapie conformationnelle par modulation d’intensité [RCMI ou IMRT] et la radiothérapie guidée par l’image [IGRT]) limitent le volume exposé à des doses élevées d’irradiation tout en assurant une distribution de doses adéquate, tant en périphérie qu’à l’intérieur du volume cible (fig. B). La RCMI permet également de diminuer les « points chauds » de manière significative sur les tissus sains avoisinants et au niveau de la peau. Ces avantages dosimétriques se sont traduits par une nette amélioration du profil de toxicité avec d’excellents taux de contrôle local (94 % à cinq ans).9,10
Nouveaux schémas hypofractionnés
Plus récemment et en tenant compte d’une certaine radiorésistance des sarcomes aux faibles doses par fraction, des schémas de radiothérapie hypofractionnée, qui délivrent des fortes doses par fraction en peu de fractions, ont été évalués.
L’avantage de ce type de traitement est la délivrance d’une dose totale plus faible en peu de fractions avec un effet biologique identique à un traitement classique.
L’inconvénient est le risque de complications à long terme, surtout en matière de fibrose et de fracture osseuse. Les résultats des premières études de phase II suggèrent que des doses journalières de 2,75 à 8 Gy délivrées sur une à trois semaines peuvent donner des résultats oncologiques similaires à ceux de la radiothérapie classique. Les résultats d’efficacité oncologique et de toxicité à long terme sont attendus avant de valider cette stratégie en routine.11
2. Rosenberg SA, Tepper J, Glatstein E, et al. The treatment of soft-tissue sarcomas of the extremities: Prospective randomized evaluations of (1) limb-sparing surgery plus radiation therapy compared with amputation and (2) the role of adjuvant chemotherapy. Ann Surg 1982;196(3):305-15.
3. Pisters PW, Harrison LB, Leung DH, et al. Long-term results of a prospective randomized trial of adjuvant brachytherapy in soft tissue sarcoma. J Clin Oncol 1996;14:859-68.
4. Yang JC, Chang AE, Baker AR, et al. Randomized prospective study of the benefit of adjuvant radiation therapy in the treatment of soft tissue sarcomas of the extremity. J Clin Oncol 1998;16:197-203.
5. Cahlon O, Brennan MF, Jia X, et al. A postoperative nomogram for local recurrence risk in extremity soft tissue sarcomas after limb-sparing surgery without adjuvant radiation. Ann Surg 2012;255:343-7.
6. O’Sullivan B, Davis AM, Turcotte R, et al. Preoperative versus postoperative radiotherapy in soft-tissue sarcoma of the limbs: A randomised trial. Lancet 2002; 359(9325):2235-41.
7. Cannon CP, Ballo MT, Zagars GK, et al. Complications of combined modality treatment of primary lower extremity soft-tissue sarcomas. Cancer 2006;107(10):2455-61.
8. McGee L, Indelicato DJ, Dagan R, et al. Long-term results following postoperative radiotherapy for soft tissue sarcomas of the extremity. Int J Radiat Oncol Biol Phys 2012;84(4):1003-9.
9. Alektiar KM, Hong L, Brennan MF, et al. Intensity modulated radiation therapy for primary soft tissue sarcoma of the extremity: Preliminary results. Int J Radiat Oncol Biol Phys 2007;68(2):458-64.
10. Alektiar KM, Brennan MF, Healey JH, et al. Impact of intensity-modulated radiation therapy on local control in primary soft-tissue sarcoma of the extremity. J Clin Oncol 2008;26(20):3440-4.
11. Kalbasi A, Kamrava M, Chu F, et al. A phase II trial of 5-day neoadjuvant radiotherapy for patients with high-risk primary soft tissue sarcoma. Clin Cancer Res 2020;26(8):1829-36.