Les durées courtes d’antibiothérapie sont un sujet d’actualité sur lequel portent beaucoup de travaux de recherche. En effet, l’exposition antibiotique est l’un des facteurs favorisant l’émergence de la résistance bactérienne. Ceci par un double mécanisme : la pression de sélection et l’induction de mécanismes de résistance. Réduire ce phénomène, en raccourcissant la durée de traitement au minimum nécessaire, sans altérer le pronostic du patient, est un objectif majeur du bon usage antibiotique et de santé publique.1,2
Multiples intérêts
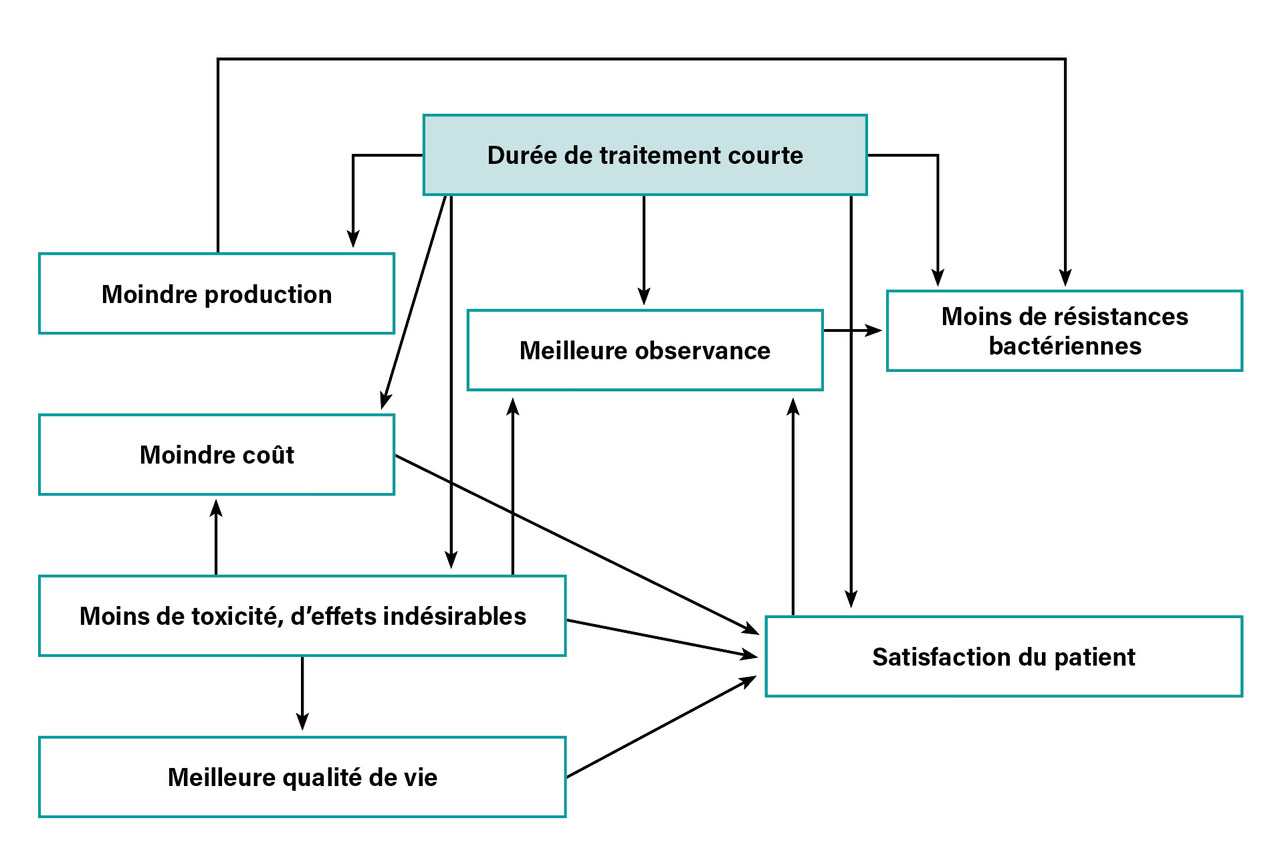
Réduire la durée de traitement antibiotique présente trois principaux avantages potentiels (figure ).
Limiter les résistances bactériennes
Goossens et al., notamment, ont montré qu’il existe une corrélation entre la consommation de pénicilline dans la population communautaire et la prévalence des pneumocoques résistants à la pénicilline dans différents pays européens.3 Ces travaux ont conduit à s’interroger sur l’impact de la durée de traitement sur l’émergence des résistances bactériennes. En effet, les micro-organismes qui constituent les microbiotes physiologiques (cutanéomuqueux, ORL, digestif…) jouent un rôle majeur de réservoir naturel de la résistance bactérienne.4
Guillemot et al. ont montré que la prise d’un traitement de plus de cinq jours par bêtalactamines est associé, chez l’enfant, à une augmentation de la prévalence du portage de pneumocoque de sensibilité diminuée.5
Par ailleurs, Chastres et al., dans un essai randomisé en double aveugle réalisé au cours des pneumonies acquises sous ventilation mécanique, comparant huit jours versus quinze jours d’antibiothérapie, ont montré que l’efficacité est identique, mais, chez les patients présentant une récidive, la proportion de bactéries multirésistantes est significativement plus importante dans le bras quinze jours que dans le groupe huit jours (62,3 % versus 42,1 % ; p = 0,04).6 Ce résultat met en évidence l’intérêt individuel d’une durée courte d’antibiothérapie.
À l’échelon populationnel, plusieurs modélisations mathématiques ont mis en évidence un effet positif de la réduction de la durée de traitement antibiotique sur la résistance bactérienne.7-9
Diminuer l’exposition aux antibiotiques par la réduction des durées de traitement devient un moyen reconnu pour lutter contre l’émergence de résistances bactériennes.
La définition des durées minimales de traitement antibiotique pour les infections les plus fréquentes fait ainsi partie des thèmes prioritaires de recherche pour combattre la résistance bactérienne.10
D’un point de vue global (One Health), diminuer la consommation d’antibiotiques devrait diminuer leur production et par conséquent la quantité éliminée dans l’environnement, ce qui pourrait augmenter le bénéfice attendu de ces réductions.
Guillemot et al. ont montré que la prise d’un traitement de plus de cinq jours par bêtalactamines est associé, chez l’enfant, à une augmentation de la prévalence du portage de pneumocoque de sensibilité diminuée.5
Par ailleurs, Chastres et al., dans un essai randomisé en double aveugle réalisé au cours des pneumonies acquises sous ventilation mécanique, comparant huit jours versus quinze jours d’antibiothérapie, ont montré que l’efficacité est identique, mais, chez les patients présentant une récidive, la proportion de bactéries multirésistantes est significativement plus importante dans le bras quinze jours que dans le groupe huit jours (62,3 % versus 42,1 % ; p = 0,04).6 Ce résultat met en évidence l’intérêt individuel d’une durée courte d’antibiothérapie.
À l’échelon populationnel, plusieurs modélisations mathématiques ont mis en évidence un effet positif de la réduction de la durée de traitement antibiotique sur la résistance bactérienne.7-9
Diminuer l’exposition aux antibiotiques par la réduction des durées de traitement devient un moyen reconnu pour lutter contre l’émergence de résistances bactériennes.
La définition des durées minimales de traitement antibiotique pour les infections les plus fréquentes fait ainsi partie des thèmes prioritaires de recherche pour combattre la résistance bactérienne.10
D’un point de vue global (One Health), diminuer la consommation d’antibiotiques devrait diminuer leur production et par conséquent la quantité éliminée dans l’environnement, ce qui pourrait augmenter le bénéfice attendu de ces réductions.
S’affranchir des événements indésirables
L’objectif principal des études sur les durées de traitement est de s’assurer de l’absence d’infériorité d’efficacité du traitement court, prérequis indispensable. Ces essais ne sont pas conçus pour mettre en évidence la réduction potentielle de survenue d’événements indésirables, qui est rare. Ils n’ont donc pas la puissance nécessaire permettant de mettre cet effet en évidence.
Seules les études réalisées sur des bases de données de grande dimension permettent d’évaluer l’impact de la durée de traitement antibiotique sur la survenue d’effets indésirables.
Dans une étude multicentrique incluant les patients ayant bénéficié d’une chirurgie et ayant reçu une antibioprophylaxie planifiée, le taux d’infections du site opératoire (ISO) n’était pas corrélé à la durée de l’antibioprophylaxie.11 Cependant, le sur-risque d’insuffisance rénale et d’infection à Clostridioides difficile (ICD) postopératoire augmente pour chaque jour supplémentaire d’antibioprophylaxie.
Au cours d’une étude prospective de cohorte ayant étudié les effets indésirables liés à l’exposition aux fluoroquinolones, une étude cas-témoins nichée a été réalisée.12 Elle a mis en évidence que la durée croissante d’exposition aux fluoroquinolones est associée à une augmentation du risque d’anévrisme aortique et de dissection.
Seules les études réalisées sur des bases de données de grande dimension permettent d’évaluer l’impact de la durée de traitement antibiotique sur la survenue d’effets indésirables.
Dans une étude multicentrique incluant les patients ayant bénéficié d’une chirurgie et ayant reçu une antibioprophylaxie planifiée, le taux d’infections du site opératoire (ISO) n’était pas corrélé à la durée de l’antibioprophylaxie.11 Cependant, le sur-risque d’insuffisance rénale et d’infection à Clostridioides difficile (ICD) postopératoire augmente pour chaque jour supplémentaire d’antibioprophylaxie.
Au cours d’une étude prospective de cohorte ayant étudié les effets indésirables liés à l’exposition aux fluoroquinolones, une étude cas-témoins nichée a été réalisée.12 Elle a mis en évidence que la durée croissante d’exposition aux fluoroquinolones est associée à une augmentation du risque d’anévrisme aortique et de dissection.
Diminuer les coûts de prise en charge
Réduire la consommation d’antibiotiques de quelques jours, au cours des infections bactériennes fréquentes, conduit à des économies importantes au niveau national même si les antibiotiques sont des médicaments peu onéreux. À titre d’exemple, ils représentent environ 12 % de l’ensemble des coûts hospitaliers d’un patient pris en charge pour une pneumonie aiguë communautaire [9 à 21 % du coût total de prise en charge], soit environ 0,2 milliard d’euros par an au niveau européen.17,18
Par ailleurs, les économies potentielles réalisées par la réduction de la durée de traitement doivent prendre en compte la diminution des effets indésirables, associés à une exposition prolongée aux antibiotiques, qui peuvent représenter un coût important.
Par ailleurs, les économies potentielles réalisées par la réduction de la durée de traitement doivent prendre en compte la diminution des effets indésirables, associés à une exposition prolongée aux antibiotiques, qui peuvent représenter un coût important.
Faisabilité et données cliniques
Plusieurs données cliniques récentes de bonne qualité ont permis de valider des durées courtes de traitement antibiotique. Des modifications de recommandation ont donc été effectuées par la Société de pathologie infectieuse de langue française (SPILF)19, et la Haute Autorité de santé (HAS) a édité des recommandations de bonne pratique et des fiches de synthèse pour les infections bactériennes courantes (tableau 1 ).20
Les principales données disponibles peuvent être classées par type d’infection (tableau 2 ).
Les principales données disponibles peuvent être classées par type d’infection (
Infections des voies urinaires
Historiquement, entre 1950 et 1970, la durée de traitement des pyélonéphrites aiguës était de quarante-deux jours. Mais, depuis, différentes études plaident pour un traitement plus court.
Un premier essai randomisé en double aveugle réalisé par Talan et al. a comparé sept jours de ciprofloxacine à quatorze jours de triméthoprime et sulfaméthoxazole chez 255 patientes.21 Les auteurs ont mis en évidence une différence significative de guérison à quatre et onze jours après la fin du traitement, en faveur de la ciprofloxacine, que les critères soient cliniques ou microbiologiques.
Plus récemment, un essai randomisé multicentrique de non-infériorité réalisé en double aveugle versus placebo, par Sandberg et al., a comparé un traitement de sept jours versus quatorze par ciprofoxacine dans les pyélonéphrites aiguës de la femme.22 Cet essai a été réalisé en Suède dans 21 centres, chez des patientes non enceintes, ambulatoires ou hospitalisées. Étaient exclues les patientes avec un examen cytobactériologique des urines (ECBU) négatif ou ayant un micro-organisme résistant aux fluoroquinolones. Le critère principal était la guérison clinique entre J10 et J14 après la fin du traitement. La non-infériorité a été atteinte en matière de guérison clinique et microbiologique (97 % vs 96 % avec un intervalle de confiance [IC] de 95 %).
Les recommandations françaises prônent un traitement de cinq à sept jours par fluoroquinolones ou céphalosporines de 3e génération par voie parentérale en cas de pyélonéphrite non compliquée, et de dix jours en cas d’utilisation d’une autre classe antibiotique et/ou de pyélonéphrite compliquée.23
Concernant les infections urinaires masculines, un essai randomisé récent comparant sept jours à quatorze jours d’antibiothérapie a démontré la non-infériorité du traitement court pour les infections non fébriles.24
En revanche, un essai français multicentrique versus placebo au cours des infections urinaires masculines fébriles (PROSTASHORT) comparant sept et quatorze jours de traitement par ofloxacine a retrouvé une différence significative, avec davantage d’échecs dans le groupe traitement court.25 Ces deux résultats permettent de différencier deux pathologies : l’infection urinaire masculine non fébrile, pour laquelle un traitement de sept jours est suffisant, et l’infection urinaire masculine fébrile, nécessitant quatorze jours d’antibiothérapie.
Un premier essai randomisé en double aveugle réalisé par Talan et al. a comparé sept jours de ciprofloxacine à quatorze jours de triméthoprime et sulfaméthoxazole chez 255 patientes.21 Les auteurs ont mis en évidence une différence significative de guérison à quatre et onze jours après la fin du traitement, en faveur de la ciprofloxacine, que les critères soient cliniques ou microbiologiques.
Plus récemment, un essai randomisé multicentrique de non-infériorité réalisé en double aveugle versus placebo, par Sandberg et al., a comparé un traitement de sept jours versus quatorze par ciprofoxacine dans les pyélonéphrites aiguës de la femme.22 Cet essai a été réalisé en Suède dans 21 centres, chez des patientes non enceintes, ambulatoires ou hospitalisées. Étaient exclues les patientes avec un examen cytobactériologique des urines (ECBU) négatif ou ayant un micro-organisme résistant aux fluoroquinolones. Le critère principal était la guérison clinique entre J10 et J14 après la fin du traitement. La non-infériorité a été atteinte en matière de guérison clinique et microbiologique (97 % vs 96 % avec un intervalle de confiance [IC] de 95 %).
Les recommandations françaises prônent un traitement de cinq à sept jours par fluoroquinolones ou céphalosporines de 3e génération par voie parentérale en cas de pyélonéphrite non compliquée, et de dix jours en cas d’utilisation d’une autre classe antibiotique et/ou de pyélonéphrite compliquée.23
Concernant les infections urinaires masculines, un essai randomisé récent comparant sept jours à quatorze jours d’antibiothérapie a démontré la non-infériorité du traitement court pour les infections non fébriles.24
En revanche, un essai français multicentrique versus placebo au cours des infections urinaires masculines fébriles (PROSTASHORT) comparant sept et quatorze jours de traitement par ofloxacine a retrouvé une différence significative, avec davantage d’échecs dans le groupe traitement court.25 Ces deux résultats permettent de différencier deux pathologies : l’infection urinaire masculine non fébrile, pour laquelle un traitement de sept jours est suffisant, et l’infection urinaire masculine fébrile, nécessitant quatorze jours d’antibiothérapie.
Infections de la peau et des tissus mous
Concernant les infections de la peau et des tissus mous, deux essais de non-infériorité de phase III ont permis de valider une durée de traitement de six jours qui avait été comparée à une durée de dix jours.26,27
Un autre essai a comparé cinq jours de lévofloxacine à dix jours chez les patients présentant une amélioration clinique ; il n’a pas retrouvé de différence.28
Un autre essai a comparé cinq jours de lévofloxacine à dix jours chez les patients présentant une amélioration clinique ; il n’a pas retrouvé de différence.28
Pneumonies
Les infections respiratoires basses représentent une part importante des indications de prescription antibiotique.
Concernant les pneumonies communautaires non prises en charge en réanimation, une méta-analyse conduite par Li et al. portant sur les durées de traitement par monothérapie de fluoroquinolones ou de bêtalactamines a analysé quinze études concernant 2 796 patients.29 Les auteurs concluent qu’un traitement inférieur ou égal à sept jours n’est pas inférieur à un traitement de plus de sept jours, que le critère soit la guérison clinique, la mortalité ou l’éradication microbiologique.
En 2019, l’Infectious Diseases Society of America (IDSA) et l’American Thoracic Society (ATS) ont recommandé une durée minimale de cinq jours de traitement antibiotique et, en cas d’infection à pneumocoque, de poursuivre soixante-douze heures après l’apyrexie, ce qui suggère l’importance de la réponse au traitement comme facteur prédictif de la durée nécessaire.30
Chez l’adulte, un essai randomisé multicentrique de non-infériorité en double aveugle a été réalisé.31 En étaient exclus les patients immunodéprimés, les cas de pneumonie sévère avec un pneumonia severity index (PSI) supérieur à 110, les patients pris en charge en réanimation et les cas de pneumonies d’allure atypique ou les empyèmes. En cas d’évolution favorable à soixante-douze heures de traitement par amoxicilline parentérale, les patients étaient randomisés et traités soit par cinq jours de placebo, soit par cinq jours d’amoxicilline. Au total, sur les 186 patients inclus, 121 ont été randomisés, 70 % avaient un PSI entre 1 et 3, 31 % des cas étaient une infection à pneumocoque dont 14 % étaient bactériémiques. Le critère principal était la guérison clinique à J10 sans traitement antibiotique additionnel. La non-infériorité a été démontrée. Cette étude souligne la possibilité d’arrêter le traitement quand le patient ne présente plus de signes cliniques d’infection. La rapidité de la réponse est l’élément essentiel permettant de préjuger de la durée de traitement nécessaire.
Récemment, un essai français multicentrique randomisé versus placebo (essai PTC) a comparé un traitement antibiotique de trois jours par bêtalactamines versus un traitement de huit jours chez les patients hospitalisés pour pneumonie aiguë communautaire et présentant les critères de stabilité à J3.32 Cet essai réalisé dans une population comorbide et d’âge médian de 73 ans a démontré la non-infériorité d’un traitement d’une durée de trois jours. Les patients immunodéprimés étaient exclus. La durée de traitement antibiotique pour les patients non stables à J3 reste à préciser.
En conclusion, une durée d’antibiothérapie inférieure à cinq jours est suffisante pour certains patients. Il est essentiel d’identifier des critères de réponse favorable qui permettraient de définir une durée de traitement adaptée à chacun.
Concernant les pneumonies communautaires non prises en charge en réanimation, une méta-analyse conduite par Li et al. portant sur les durées de traitement par monothérapie de fluoroquinolones ou de bêtalactamines a analysé quinze études concernant 2 796 patients.29 Les auteurs concluent qu’un traitement inférieur ou égal à sept jours n’est pas inférieur à un traitement de plus de sept jours, que le critère soit la guérison clinique, la mortalité ou l’éradication microbiologique.
En 2019, l’Infectious Diseases Society of America (IDSA) et l’American Thoracic Society (ATS) ont recommandé une durée minimale de cinq jours de traitement antibiotique et, en cas d’infection à pneumocoque, de poursuivre soixante-douze heures après l’apyrexie, ce qui suggère l’importance de la réponse au traitement comme facteur prédictif de la durée nécessaire.30
Chez l’adulte, un essai randomisé multicentrique de non-infériorité en double aveugle a été réalisé.31 En étaient exclus les patients immunodéprimés, les cas de pneumonie sévère avec un pneumonia severity index (PSI) supérieur à 110, les patients pris en charge en réanimation et les cas de pneumonies d’allure atypique ou les empyèmes. En cas d’évolution favorable à soixante-douze heures de traitement par amoxicilline parentérale, les patients étaient randomisés et traités soit par cinq jours de placebo, soit par cinq jours d’amoxicilline. Au total, sur les 186 patients inclus, 121 ont été randomisés, 70 % avaient un PSI entre 1 et 3, 31 % des cas étaient une infection à pneumocoque dont 14 % étaient bactériémiques. Le critère principal était la guérison clinique à J10 sans traitement antibiotique additionnel. La non-infériorité a été démontrée. Cette étude souligne la possibilité d’arrêter le traitement quand le patient ne présente plus de signes cliniques d’infection. La rapidité de la réponse est l’élément essentiel permettant de préjuger de la durée de traitement nécessaire.
Récemment, un essai français multicentrique randomisé versus placebo (essai PTC) a comparé un traitement antibiotique de trois jours par bêtalactamines versus un traitement de huit jours chez les patients hospitalisés pour pneumonie aiguë communautaire et présentant les critères de stabilité à J3.32 Cet essai réalisé dans une population comorbide et d’âge médian de 73 ans a démontré la non-infériorité d’un traitement d’une durée de trois jours. Les patients immunodéprimés étaient exclus. La durée de traitement antibiotique pour les patients non stables à J3 reste à préciser.
En conclusion, une durée d’antibiothérapie inférieure à cinq jours est suffisante pour certains patients. Il est essentiel d’identifier des critères de réponse favorable qui permettraient de définir une durée de traitement adaptée à chacun.
Infections ostéoarticulaires
Les infections ostéoarticulaires comprennent diverses entités dont les arthrites, les ostéites chroniques et les ostéomyélites, les spondylodiscites et les infections sur matériel orthopédique, notamment les prothèses.
Dans cette indication, les traitements antibiotiques sont de longue durée, de six à douze semaines, et à fortes doses. Ces pathologies touchent essentiellement des personnes âgées fragiles et sensibles aux effets indésirables des antibiotiques (par exemple ICD, intolérance neurologique ou risque vasculaire sous fluoroquinolone). Le raccourcissement de la durée de traitement antibiotique représente un enjeu important pour cette population vulnérable.
Chez l’enfant, un essai randomisé réalisé sur douze mois portant sur 130 cas d’arthrites documentées par ponction, dont 12 % avaient été opérées, a comparé une durée d’antibiothérapie de dix jours versus trente jours sans retrouver de différence en matière de guérison.33
Concernant les infections sur prothèse, un essai randomisé multicentrique réalisé en ouvert a comparé six à douze semaines de traitement antibiotique lors des infections sur prothèse de genou et hanche (essai DATIPO : durée d’antibiothérapie [six versus douze semaines] pour le traitement des infections sur prothèses ostéoarticulaires).34 La randomisation a été stratifiée sur la stratégie chirurgicale et le suivi a été d’un an. Cet essai a mis en évidence une différence significative, avec davantage d’échecs dans le bras six semaines de traitement.
À propos des spondylodiscites, un autre essai français, multicentrique, prospectif, randomisé a comparé six à douze semaines de traitement antibiotique efficace dans les spondylodiscites à pyogènes documenté chez les patients non immunodéprimés sans présence de matériel. Il s’agissait d’un essai de non-infériorité ouvert avec une évaluation en aveugle par un comité de validation indépendant afin de pallier ce biais. Cet essai a permis de recruter 375 patients. Les caractéristiques de la population de l’étude étaient superposables à celles de la littérature concernant cette pathologie. Les analyses en intention de traiter (ITT) et en perprotocole (PP) n’ont pas retrouvé de différence significative en matière de guérison. En outre, l’évolution n’a pas été significativement différente concernant la douleur ni le taux de protéine C-réactive (CRP) tout au long du suivi, quelle que soit la durée du traitement antibiotique. Cette étude a permis de conclure que six semaines de traitement antibiotique suffisent probablement en cas de spondylodiscite à pyogènes dans cette population non immunodéprimée. Les conclusions de cet essai ont été reprises dans les recommandations américaines sur les spondylodiscites, qui prônent une seule durée de traitement antibiotique de six semaines dans cette indication.35
Dans cette indication, les traitements antibiotiques sont de longue durée, de six à douze semaines, et à fortes doses. Ces pathologies touchent essentiellement des personnes âgées fragiles et sensibles aux effets indésirables des antibiotiques (par exemple ICD, intolérance neurologique ou risque vasculaire sous fluoroquinolone). Le raccourcissement de la durée de traitement antibiotique représente un enjeu important pour cette population vulnérable.
Chez l’enfant, un essai randomisé réalisé sur douze mois portant sur 130 cas d’arthrites documentées par ponction, dont 12 % avaient été opérées, a comparé une durée d’antibiothérapie de dix jours versus trente jours sans retrouver de différence en matière de guérison.33
Concernant les infections sur prothèse, un essai randomisé multicentrique réalisé en ouvert a comparé six à douze semaines de traitement antibiotique lors des infections sur prothèse de genou et hanche (essai DATIPO : durée d’antibiothérapie [six versus douze semaines] pour le traitement des infections sur prothèses ostéoarticulaires).34 La randomisation a été stratifiée sur la stratégie chirurgicale et le suivi a été d’un an. Cet essai a mis en évidence une différence significative, avec davantage d’échecs dans le bras six semaines de traitement.
À propos des spondylodiscites, un autre essai français, multicentrique, prospectif, randomisé a comparé six à douze semaines de traitement antibiotique efficace dans les spondylodiscites à pyogènes documenté chez les patients non immunodéprimés sans présence de matériel. Il s’agissait d’un essai de non-infériorité ouvert avec une évaluation en aveugle par un comité de validation indépendant afin de pallier ce biais. Cet essai a permis de recruter 375 patients. Les caractéristiques de la population de l’étude étaient superposables à celles de la littérature concernant cette pathologie. Les analyses en intention de traiter (ITT) et en perprotocole (PP) n’ont pas retrouvé de différence significative en matière de guérison. En outre, l’évolution n’a pas été significativement différente concernant la douleur ni le taux de protéine C-réactive (CRP) tout au long du suivi, quelle que soit la durée du traitement antibiotique. Cette étude a permis de conclure que six semaines de traitement antibiotique suffisent probablement en cas de spondylodiscite à pyogènes dans cette population non immunodéprimée. Les conclusions de cet essai ont été reprises dans les recommandations américaines sur les spondylodiscites, qui prônent une seule durée de traitement antibiotique de six semaines dans cette indication.35
Infections intra-abdominales
Un essai multicentrique portant sur 518 patients présentant une infection intra-abdominale compliquée a comparé une durée fixe de quatre jours de traitement antibiotique versus une durée maximale de dix jours (après au moins deux jours d’apyrexie), une fois la source de l’infection contrôlée.36 L’âge moyen de la population était de 52 ans. L’origine de l’infection était colique dans 34 % des cas, intestinale dans 14 % et appendiculaire dans 14 %. Il n’a pas été retrouvé de différence entre les deux bras en matière d’échec, de reprise chirurgicale ou de décès.
Une durée de quatre jours semble ainsi suffisante dans les infections intra-abdominales dont la source est contrôlée.
Un travail français a comparé huit jours à quinze jours d’antibiothérapie au cours des péritonites postopératoires sévères prises en charge en réanimation, dont environ 30 % à Enterobacterales sécrétrices de bactéries productrices de bêtalactamases à spectre élargi (BLSE).37 Aucune différence d’efficacité n’a été retrouvée quel que soit le critère étudié.
Une durée de quatre jours semble ainsi suffisante dans les infections intra-abdominales dont la source est contrôlée.
Un travail français a comparé huit jours à quinze jours d’antibiothérapie au cours des péritonites postopératoires sévères prises en charge en réanimation, dont environ 30 % à Enterobacterales sécrétrices de bactéries productrices de bêtalactamases à spectre élargi (BLSE).37 Aucune différence d’efficacité n’a été retrouvée quel que soit le critère étudié.
Une durée courte d’antibiothérapie n’est pas toujours possible
Malgré la tendance générale à réduire la durée de traitement antibiotique des pathologies infectieuses, des essais randomisés sont nécessaires pour valider des durées de traitement courtes, en fonction des indications et du terrain. Or, récemment, plusieurs essais ont montré les limites des indications au traitement antibiotique court, comme les essais DATIPO (infections sur prothèse ostéo-articulaires comparant six versus douze semaines) et PROSTASHORT (infections urinaires masculines fébriles comparant sept à quatorze jours).
Enfin, les durées de traitements antibiotiques sont étudiées dans des populations immunocompétentes ne permettant pas de tirer de conclusion directe chez les patients immunodéprimés.
Enfin, les durées de traitements antibiotiques sont étudiées dans des populations immunocompétentes ne permettant pas de tirer de conclusion directe chez les patients immunodéprimés.
Réduire globalement l’exposition aux antibiotiques
À l’heure de l’augmentation des résistances bactériennes, réduire la durée de traitement antibiotique des infections bactériennes permet de diminuer de manière importante l’exposition antibiotique populationnelle et donc l’émergence de résistances bactériennes.
Mais réduire la durée de traitement antibiotique comporte aussi d’autres intérêts, comme la diminution de l’incidence des effets indésirables, du coût de prise en charge, l’amélioration de l’observance ainsi que la limitation de l’impact sur l’environnement, dans une logique « One Health ».
Réduire et individualiser la durée en définissant des critères d’arrêt de l’antibiothérapie devrait être un élément essentiel de la politique de bon usage antibiotique. Au cours des pneumonies aiguës communautaires, les critères de stabilité clinique peuvent être utilisés pour décider de l’arrêt de l’antibiothérapie.
Définir des critères d’arrêt clinique est un concept innovant permettant d’individualiser la durée de traitement et de limiter l’exposition antibiotique au minimum suffisant et nécessaire.
Mais réduire la durée de traitement antibiotique comporte aussi d’autres intérêts, comme la diminution de l’incidence des effets indésirables, du coût de prise en charge, l’amélioration de l’observance ainsi que la limitation de l’impact sur l’environnement, dans une logique « One Health ».
Réduire et individualiser la durée en définissant des critères d’arrêt de l’antibiothérapie devrait être un élément essentiel de la politique de bon usage antibiotique. Au cours des pneumonies aiguës communautaires, les critères de stabilité clinique peuvent être utilisés pour décider de l’arrêt de l’antibiothérapie.
Définir des critères d’arrêt clinique est un concept innovant permettant d’individualiser la durée de traitement et de limiter l’exposition antibiotique au minimum suffisant et nécessaire.
Références
1. O’Neill J. Antimicrobial resistance: Tackling a crisis for the health and wealth of nations. The Review on Antimicrobial Resistance. 2014. https://vu.fr/ddnGF
2. Rice LB. The Maxwell Finland Lecture: For the duration-rational antibiotic administration in an era of antimicrobial resistance and Clostridium difficile. Clin Infect Dis 2008;46(4):491-6.
3. Goossens H, Ferech M, Vander Stichele R, Elseviers M, ESAC Project Group. Outpatient antibiotic use in Europe and association with resistance: A cross-national database study. Lancet 2005;365(9459):579-87.
4. de Lastours V, Fantin B. Impact of fluoroquinolones on human microbiota. Focus on the emergence of antibiotic resistance. Future Microbiol 2015;10(7):1241-55.
5. Guillemot D, Carbon C, Balkau B, Geslin P, Lecoeur H, Vauzelle-Kervroëdan F, et al. Low dosage and long treatment duration of beta-lactam: Risk factors for carriage of penicillin-resistant Streptococcus pneumoniae. JAMA 1998;279(5):365-70.
6. Chastre J, Wolff M, Fagon J-Y, Chevret S, Thomas Franck, Wermert D, et al. Comparison of 8 vs 15 days of antibiotic therapy for ventilator-associated pneumonia in adults: A randomised trial. JAMA 2003;290(19):2588-98.
7. Pauperio F, Ganusov V, Gjini E. Mathematical modeling links benefits of short and long antibiotic treatment to details of infection. bioRxiv 2019:555334.
8. Geli P, Laxminarayan R, Dunne M, Smith DL. One-Size-Fits-All? Optimizing treatment duration for bacterial infections. Brusic V, ed. PLoS One 2012;7(1):e29838.
9. D’Agata EMC, Magal P, Olivier D, Ruan S, Webb GF. Modeling antibiotic resistance in hospitals: The impact of minimizing treatment duration. J Theor Biol 2007;249(3):487-99.
10. Infectious Diseases Society of America (IDSA). Combating antimicrobial resistance: Policy recommendations to save lives. Clin Infect Dis 2011;52(suppl 5):S397-S428.
11. Branch-Elliman W, O’Brien W, Strymish J, Itani K, Wyatt C, Gupta K. Association of duration and type of surgical prophylaxis with antimicrobial-associated adverse events. JAMA Surg 2019;154(7):590-8.
12. Dong YH, Chang CH, Wang JL, Wu LC, Lin JW, Toh S. Association of infections and use of fluoroquinolones with the risk of aortic aneurysm or aortic dissection. JAMA Intern Med 2020;180(12):1587-95.
13. Wexler AG, Bao Y, Whitney JC, Bobay LM, Xavier JB, Schofield WB, et al. Human symbionts inject and neutralize antibacterial toxins to persist in the gut. Proc Natl Acad Sci 2016;113(13):3639-44.
14. Ray K, Bobard A, Danckaert A, Paz-Haftel I, Clair C, Ehsani S, et al. Tracking the dynamic interplay between bacterial and host factors during pathogen-induced vacuole rupture in real time. Cell Microbiol 2010;12(4):545-56.
15. Chatzidaki-Livanis M, Geva-Zatorsky N, Comstock LE. Bacteroides fragilis type VI secretion systems use novel effector and immunity proteins to antagonize human gut Bacteroidales species. Proc Natl Acad Sci 2016;113(13):3627-32.
16. Baggs J, Jernigan JA, Halpin AL, Epstein L, Hatfield KM, McDonald LC. Risk of subsequent sepsis within 90 days after a hospital stay by type of antibiotic exposure. Clin Infect Dis 2018;66(7):1004-12.
17. European Respiratory Society (ERS). Acute lower respiratory infections. In: Gibson GJ, Loddenkemper R, Sibille Y, Lundbäck B, eds. The European Lung White Book. European R. ; 2013.
18. Welte T, Torres A, Nathwani D. Clinical and economic burden of community-acquired pneumonia among adults in Europe. Thorax 2012;67(1):71-9.
19. Gauzit R, Castan B, Bonnet E, Bru JP, Cohen R, Diamantis S, et al. Anti-infectious treatment duration: The SPILF and GPIP French guidelines and recommendations. Infect Dis Now 2021;51(2):114-39.
20. Haute Autorité de santé (HAS). Choix et durées d’antibiothérapie préconisées dans les infections bactériennes courantes. Août 2021, mise à jour juillet 2024. https://vu.fr/aHFJz
21. Talan DA, Stamm WE, Hooton TM, Moran GJ, Burke T, Iravani A, et al. Comparison of ciprofloxacin (7 days) and trimethoprim-sulfamethoxazole (14 days) for acute uncomplicated pyelonephritis in women: A randomized trial. JAMA 2000;283(12):1583-90.
22. Sandberg T, Skoog G, Hermansson AB, Kahlmeter G, Kuylenstierna N, Lannergård A, et al. Ciprofloxacin for 7 days versus 14 days in women with acute pyelonephritis: A randomised, open-label and double-blind, placebo-controlled, non-inferiority trial. Lancet 2012;380(9840):484-90.
23. Société de pathologie infectieuse de langue française (SPILF). Diagnostic et antibiothérapie des infections urinaires bactériennes communautaires de l’adulte. Mise au point. 2015. https://vu.fr/KsgBx
24. Drekonja DM, Trautner B, Amundson C, Kuskowski M, Johnson JR. Effect of 7 vs 14 days of antibiotic therapy on resolution of symptoms among afebrile men with urinary tract infection; A randomised clinical trial. JAMA 2021;326(4):324-31.
25. Antibiotic treatment for 7 days versus 14 days in patients with acute male urinary tract infection (PROSTASHORT). 2015. https://vu.fr/qpOou
26. Prokocimer P, De Anda C, Fang E, Mehra P, Das A. Tedizolid phosphate vs linezolid for treatment of acute bacterial skin and skin structure infections. JAMA 2013;309(6):559-69.
27. Moran GJ, Fang E, Corey GR, Das AF, De Anda C, Prokocimer P, et al. Tedizolid for 6 days versus linezolid for 10 days for acute bacterial skin and skin-structure infections (ESTABLISH-2): A randomised, double-blind, phase 3, non-inferiority trial. Lancet Infect Dis 2014;14(8):696-705.
28. Hepburn MJ, Dooley DP, Skidmore PJ, Ellis MW, Starnes WF, Hasewinkle WC. Comparison of short-course (5 days) and standard (10 days) treatment for uncomplicated cellulitis. Arch Intern Med 2004;164(15):1669-74.
29. Li JZ, Winston LG, Moore DH, Bent S. Efficacy of short-course antibiotic regimens for community-acquired pneumonia: A meta-analysis. Am J Med 2007;120(9):783-90.
30. Metlay JP, Waterer GW, Long AC, Anzueto A, Brozek J, Crothers K, et al. Diagnosis and treatment of adults with community-acquired pneumonia. An official clinical practice guideline of the American Thoracic Society and Infectious Diseases Society of America. Am J Respir Crit Care Med 2019;200(7):e45-e67.
31. el Moussaoui R, de Borgie CAJM, van den Broek P, Hustinx WN, Bresser P, van den Berk GEL, et al. Effectiveness of discontinuing antibiotic treatment after three days versus eight days in mild to moderate-severe community acquired pneumonia: Randomised, double blind study. BMJ 2006;332(7554):1355.
32. Dinh A, Ropers J, Duran C, Davido B, Deconinck L, Matt M, et al. Discontinuing β-lactam treatment after 3 days for patients with community-acquired pneumonia in non-critical care wards (PTC): A double-blind, randomised, placebo-controlled, non-inferiority trial. Lancet 2021;397(10280):1195-203.
33. Peltola H, Pääkkönen M, Kallio P, Kallio MJT, Osteomyelitis-Septic Arthritis (OM-SA) Study Group. Prospective, randomized trial of 10 days versus 30 days of antimicrobial treatment, including a short-term course of parenteral therapy, for childhood septic arthritis. Clin Infect Dis 2009;48(9):1201-10.
34. Bernard L, Arvieux C, Brunschweiler B, Touchais S, ansart S, Bru JP, et al. Antibiotic therapy for 6 or 12 weeks for prosthetic joint infection. N Engl J Med 2021;384(21):1991-2001.
35. Berbari EF, Kanj SS, Kowalski TJ, Darouiche RO, Widmer AF, Schmitt SK, et al. Executive summary:2015 Infectious Diseases Society of America (IDSA) clinical practice guidelines for the diagnosis and treatment of native vertebral osteomyelitis in adults. Clin Infect Dis 2015;61(6):859-63.
36. Sawyer RG, Claridge JA, Nathens AB, Rotstein OD, Duane TM, Evans HL, et al. Trial of short-course antimicrobial therapy for intraabdominal infection. N Engl J Med 2015;372(21):1996-2005.
37. Montravers P, Tubach F, Lescot T, Veber B, Esposito-Farèse M, Seguin P, et al. Short-course antibiotic therapy for critically ill patients treated for postoperative intra-abdominal infection: The DURAPOP randomised clinical trial. Intensive Care Med 2018;44(3):300-10.
2. Rice LB. The Maxwell Finland Lecture: For the duration-rational antibiotic administration in an era of antimicrobial resistance and Clostridium difficile. Clin Infect Dis 2008;46(4):491-6.
3. Goossens H, Ferech M, Vander Stichele R, Elseviers M, ESAC Project Group. Outpatient antibiotic use in Europe and association with resistance: A cross-national database study. Lancet 2005;365(9459):579-87.
4. de Lastours V, Fantin B. Impact of fluoroquinolones on human microbiota. Focus on the emergence of antibiotic resistance. Future Microbiol 2015;10(7):1241-55.
5. Guillemot D, Carbon C, Balkau B, Geslin P, Lecoeur H, Vauzelle-Kervroëdan F, et al. Low dosage and long treatment duration of beta-lactam: Risk factors for carriage of penicillin-resistant Streptococcus pneumoniae. JAMA 1998;279(5):365-70.
6. Chastre J, Wolff M, Fagon J-Y, Chevret S, Thomas Franck, Wermert D, et al. Comparison of 8 vs 15 days of antibiotic therapy for ventilator-associated pneumonia in adults: A randomised trial. JAMA 2003;290(19):2588-98.
7. Pauperio F, Ganusov V, Gjini E. Mathematical modeling links benefits of short and long antibiotic treatment to details of infection. bioRxiv 2019:555334.
8. Geli P, Laxminarayan R, Dunne M, Smith DL. One-Size-Fits-All? Optimizing treatment duration for bacterial infections. Brusic V, ed. PLoS One 2012;7(1):e29838.
9. D’Agata EMC, Magal P, Olivier D, Ruan S, Webb GF. Modeling antibiotic resistance in hospitals: The impact of minimizing treatment duration. J Theor Biol 2007;249(3):487-99.
10. Infectious Diseases Society of America (IDSA). Combating antimicrobial resistance: Policy recommendations to save lives. Clin Infect Dis 2011;52(suppl 5):S397-S428.
11. Branch-Elliman W, O’Brien W, Strymish J, Itani K, Wyatt C, Gupta K. Association of duration and type of surgical prophylaxis with antimicrobial-associated adverse events. JAMA Surg 2019;154(7):590-8.
12. Dong YH, Chang CH, Wang JL, Wu LC, Lin JW, Toh S. Association of infections and use of fluoroquinolones with the risk of aortic aneurysm or aortic dissection. JAMA Intern Med 2020;180(12):1587-95.
13. Wexler AG, Bao Y, Whitney JC, Bobay LM, Xavier JB, Schofield WB, et al. Human symbionts inject and neutralize antibacterial toxins to persist in the gut. Proc Natl Acad Sci 2016;113(13):3639-44.
14. Ray K, Bobard A, Danckaert A, Paz-Haftel I, Clair C, Ehsani S, et al. Tracking the dynamic interplay between bacterial and host factors during pathogen-induced vacuole rupture in real time. Cell Microbiol 2010;12(4):545-56.
15. Chatzidaki-Livanis M, Geva-Zatorsky N, Comstock LE. Bacteroides fragilis type VI secretion systems use novel effector and immunity proteins to antagonize human gut Bacteroidales species. Proc Natl Acad Sci 2016;113(13):3627-32.
16. Baggs J, Jernigan JA, Halpin AL, Epstein L, Hatfield KM, McDonald LC. Risk of subsequent sepsis within 90 days after a hospital stay by type of antibiotic exposure. Clin Infect Dis 2018;66(7):1004-12.
17. European Respiratory Society (ERS). Acute lower respiratory infections. In: Gibson GJ, Loddenkemper R, Sibille Y, Lundbäck B, eds. The European Lung White Book. European R. ; 2013.
18. Welte T, Torres A, Nathwani D. Clinical and economic burden of community-acquired pneumonia among adults in Europe. Thorax 2012;67(1):71-9.
19. Gauzit R, Castan B, Bonnet E, Bru JP, Cohen R, Diamantis S, et al. Anti-infectious treatment duration: The SPILF and GPIP French guidelines and recommendations. Infect Dis Now 2021;51(2):114-39.
20. Haute Autorité de santé (HAS). Choix et durées d’antibiothérapie préconisées dans les infections bactériennes courantes. Août 2021, mise à jour juillet 2024. https://vu.fr/aHFJz
21. Talan DA, Stamm WE, Hooton TM, Moran GJ, Burke T, Iravani A, et al. Comparison of ciprofloxacin (7 days) and trimethoprim-sulfamethoxazole (14 days) for acute uncomplicated pyelonephritis in women: A randomized trial. JAMA 2000;283(12):1583-90.
22. Sandberg T, Skoog G, Hermansson AB, Kahlmeter G, Kuylenstierna N, Lannergård A, et al. Ciprofloxacin for 7 days versus 14 days in women with acute pyelonephritis: A randomised, open-label and double-blind, placebo-controlled, non-inferiority trial. Lancet 2012;380(9840):484-90.
23. Société de pathologie infectieuse de langue française (SPILF). Diagnostic et antibiothérapie des infections urinaires bactériennes communautaires de l’adulte. Mise au point. 2015. https://vu.fr/KsgBx
24. Drekonja DM, Trautner B, Amundson C, Kuskowski M, Johnson JR. Effect of 7 vs 14 days of antibiotic therapy on resolution of symptoms among afebrile men with urinary tract infection; A randomised clinical trial. JAMA 2021;326(4):324-31.
25. Antibiotic treatment for 7 days versus 14 days in patients with acute male urinary tract infection (PROSTASHORT). 2015. https://vu.fr/qpOou
26. Prokocimer P, De Anda C, Fang E, Mehra P, Das A. Tedizolid phosphate vs linezolid for treatment of acute bacterial skin and skin structure infections. JAMA 2013;309(6):559-69.
27. Moran GJ, Fang E, Corey GR, Das AF, De Anda C, Prokocimer P, et al. Tedizolid for 6 days versus linezolid for 10 days for acute bacterial skin and skin-structure infections (ESTABLISH-2): A randomised, double-blind, phase 3, non-inferiority trial. Lancet Infect Dis 2014;14(8):696-705.
28. Hepburn MJ, Dooley DP, Skidmore PJ, Ellis MW, Starnes WF, Hasewinkle WC. Comparison of short-course (5 days) and standard (10 days) treatment for uncomplicated cellulitis. Arch Intern Med 2004;164(15):1669-74.
29. Li JZ, Winston LG, Moore DH, Bent S. Efficacy of short-course antibiotic regimens for community-acquired pneumonia: A meta-analysis. Am J Med 2007;120(9):783-90.
30. Metlay JP, Waterer GW, Long AC, Anzueto A, Brozek J, Crothers K, et al. Diagnosis and treatment of adults with community-acquired pneumonia. An official clinical practice guideline of the American Thoracic Society and Infectious Diseases Society of America. Am J Respir Crit Care Med 2019;200(7):e45-e67.
31. el Moussaoui R, de Borgie CAJM, van den Broek P, Hustinx WN, Bresser P, van den Berk GEL, et al. Effectiveness of discontinuing antibiotic treatment after three days versus eight days in mild to moderate-severe community acquired pneumonia: Randomised, double blind study. BMJ 2006;332(7554):1355.
32. Dinh A, Ropers J, Duran C, Davido B, Deconinck L, Matt M, et al. Discontinuing β-lactam treatment after 3 days for patients with community-acquired pneumonia in non-critical care wards (PTC): A double-blind, randomised, placebo-controlled, non-inferiority trial. Lancet 2021;397(10280):1195-203.
33. Peltola H, Pääkkönen M, Kallio P, Kallio MJT, Osteomyelitis-Septic Arthritis (OM-SA) Study Group. Prospective, randomized trial of 10 days versus 30 days of antimicrobial treatment, including a short-term course of parenteral therapy, for childhood septic arthritis. Clin Infect Dis 2009;48(9):1201-10.
34. Bernard L, Arvieux C, Brunschweiler B, Touchais S, ansart S, Bru JP, et al. Antibiotic therapy for 6 or 12 weeks for prosthetic joint infection. N Engl J Med 2021;384(21):1991-2001.
35. Berbari EF, Kanj SS, Kowalski TJ, Darouiche RO, Widmer AF, Schmitt SK, et al. Executive summary:2015 Infectious Diseases Society of America (IDSA) clinical practice guidelines for the diagnosis and treatment of native vertebral osteomyelitis in adults. Clin Infect Dis 2015;61(6):859-63.
36. Sawyer RG, Claridge JA, Nathens AB, Rotstein OD, Duane TM, Evans HL, et al. Trial of short-course antimicrobial therapy for intraabdominal infection. N Engl J Med 2015;372(21):1996-2005.
37. Montravers P, Tubach F, Lescot T, Veber B, Esposito-Farèse M, Seguin P, et al. Short-course antibiotic therapy for critically ill patients treated for postoperative intra-abdominal infection: The DURAPOP randomised clinical trial. Intensive Care Med 2018;44(3):300-10.