Le reflux gastro-œsophagien (RGO) désigne le passage intermittent ou permanent d’un contenu gastrique dans l’œsophage. Physiologique, il est bref et essentiellement post-prandial. Il devient pathologique lorsque les reflux, fréquents et/ou prolongés, induisent des symptômes et/ou des lésions endoscopiques. Un Français sur dix en souffrirait.
Affirmer le diagnostic
Le diagnostic de RGO est clinique et repose sur la présence de pyrosis et de régurgitations.
La clinique d’abord, mais pas toujours suffisante
La coexistence de ces symptômes et l’absence de signes d’alarme (encadré) permet de retenir le diagnostic de RGO comme le plus probable et donc de traiter d’emblée le patient. Cependant, la spécificité des symptômes typiques de RGO n’est que de 70 % et celle d’un test thérapeutique aux inhibiteurs de la pompe à protons (IPP) de 44 %. Ainsi, en se fondant sur la clinique uniquement, un grand nombre de patients atteints d’autres pathologies – et en particulier de pyrosis fonctionnel – sont traités à tort pour un RGO.
Deuxième étape : endoscopie œso-gastro-duodénale
Lorsque l’on cherche à établir un diagnostic de RGO, l’endoscopie œso-gastro-duodénale (EOGD) est la deuxième étape. Là encore, il s’agit d’un test diagnostique peu performant puisqu’environ 60 % des patients atteints de RGO authentique ont une EOGD normale (c’est-à-dire sans signe endoscopique de complication du RGO).
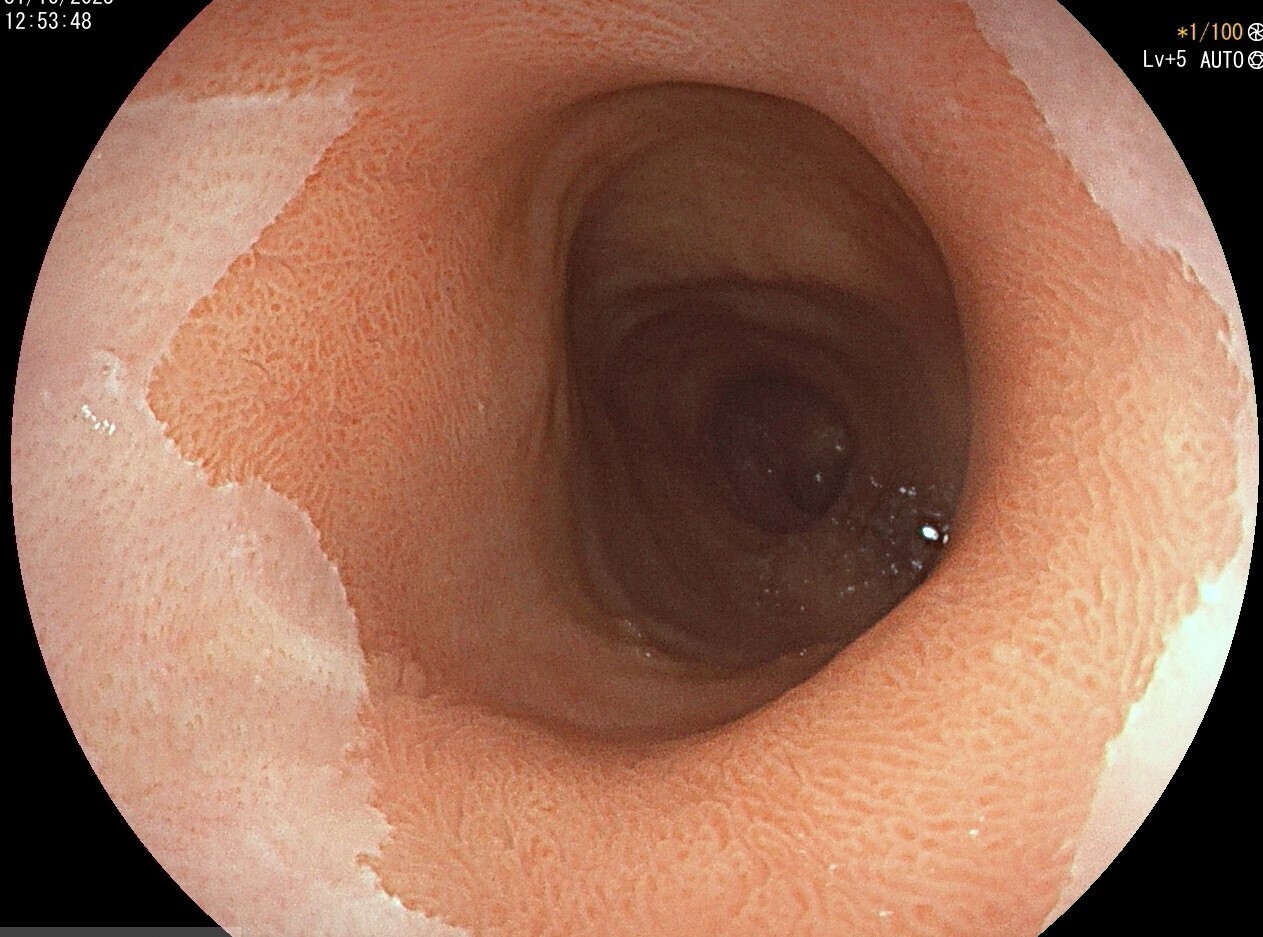
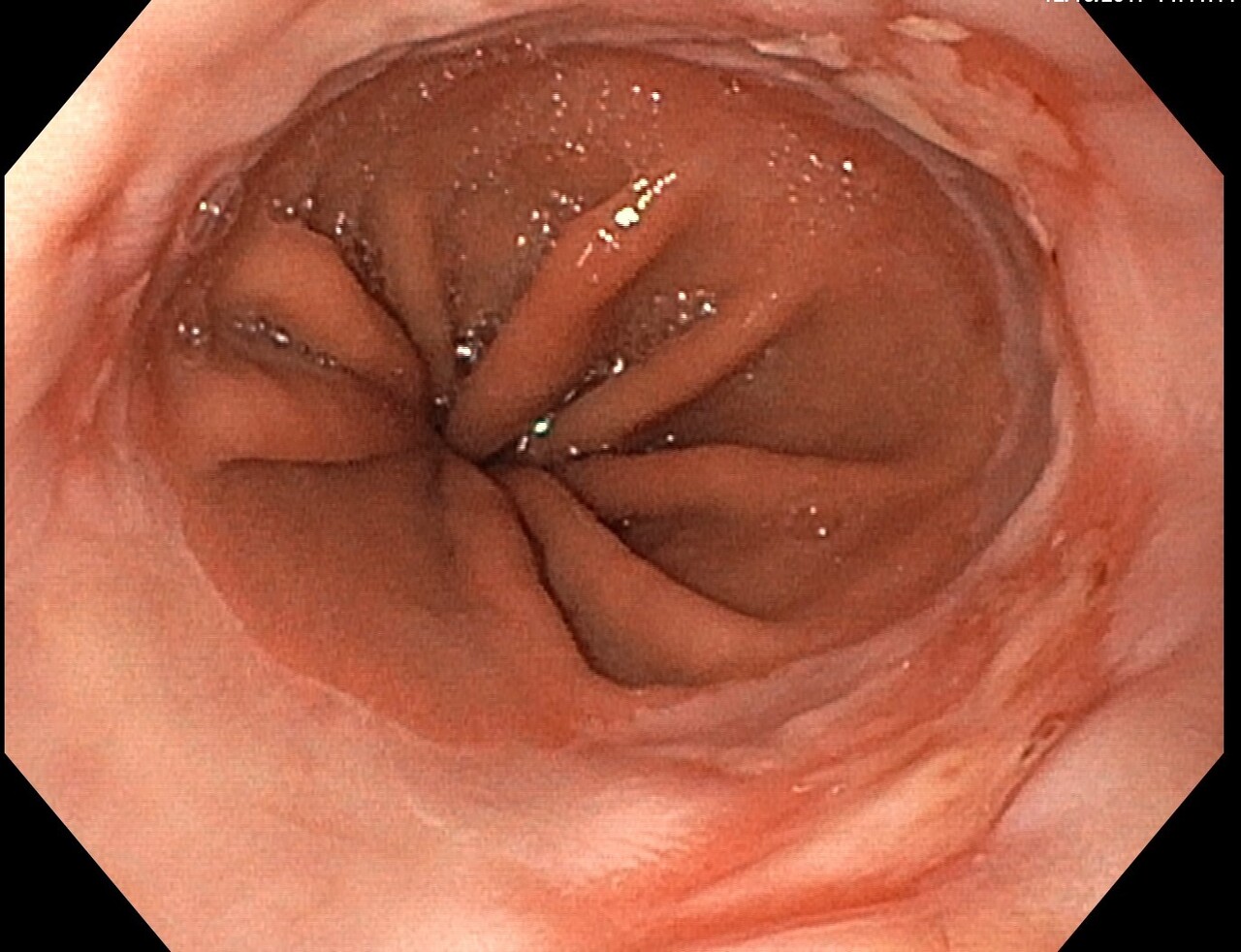
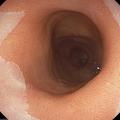
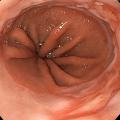
L’EOGD est néanmoins un outil diagnostique facilement disponible qui permet de rechercher des signes indirects de RGO, comme une hernie hiatale, ou des signes de complication du RGO, comme une œsophagite peptique, un œsophage de Barrett (anciennement appelé endobrachyœsophage) [fig. 1] ou une sténose peptique (fig. 2).
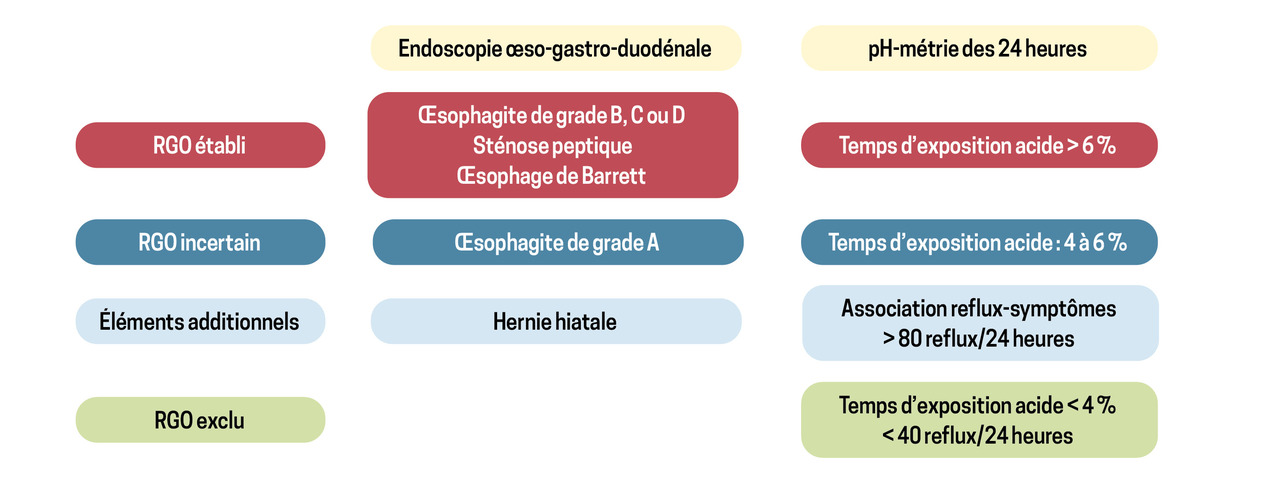
D’après le consensus international de Lyon- 2 définissant les critères de RGO,1 la présence d’une complication endoscopiquement décelable du RGO permet d’affirmer le diagnostic et justifie un traitement médicamenteux, ou plus rarement chirurgical (fig. 3). Ceci a son importance, notamment chez les patients ayant des signes atypiques de RGO (toux, gêne cervicale, douleurs thoraciques pseudoangineuses).
L’EOGD permet également d’éliminer des diagnostics différentiels du RGO, notamment les sténoses œsophagiennes, tissulaires, voire tumorales, ou celles liées à des spasmes musculaires dans le cadre de troubles moteurs.
Au total, l’EOGD est justifiée :
- pour faire le diagnostic du reflux chez les patients ayant des signes atypiques ;
- pour rechercher un diagnostic différentiel en cas de signes d’alarme, de résistance au traitement ou de rechute à l’arrêt du traitement ;
- pour dépister des complications du RGO chez les « reflueurs » de 50 ans et plus et ayant un ou plusieurs facteurs de risque d’adénocarcinome œsophagien suivants : sexe masculin, origine européenne, obésité, tabagisme, antécédent familial au premier degré d’œsophage de Barrett2 ou d’adénocarcinome œsophagien.
La pH-métrie permet de conclure en cas d’EOGD normale
Lorsque l’on suspecte un RGO mais que l’EOGD est normale, documenter le RGO impose de réaliser une pH-métrie des 24 heures après arrêt des antiacides. Cet examen permet d’évaluer si le temps d’exposition de l’œsophage distal à l’acide est supérieur à 6 % du temps de l’enregistrement – seuil définissant le RGO pathologique –, de calculer le nombre d’épisodes de RGO par 24 heures (pathologique au-delà de 80 par 24 heures) et d’établir une corrélation entre les symptômes rapportés et les épisodes de RGO.
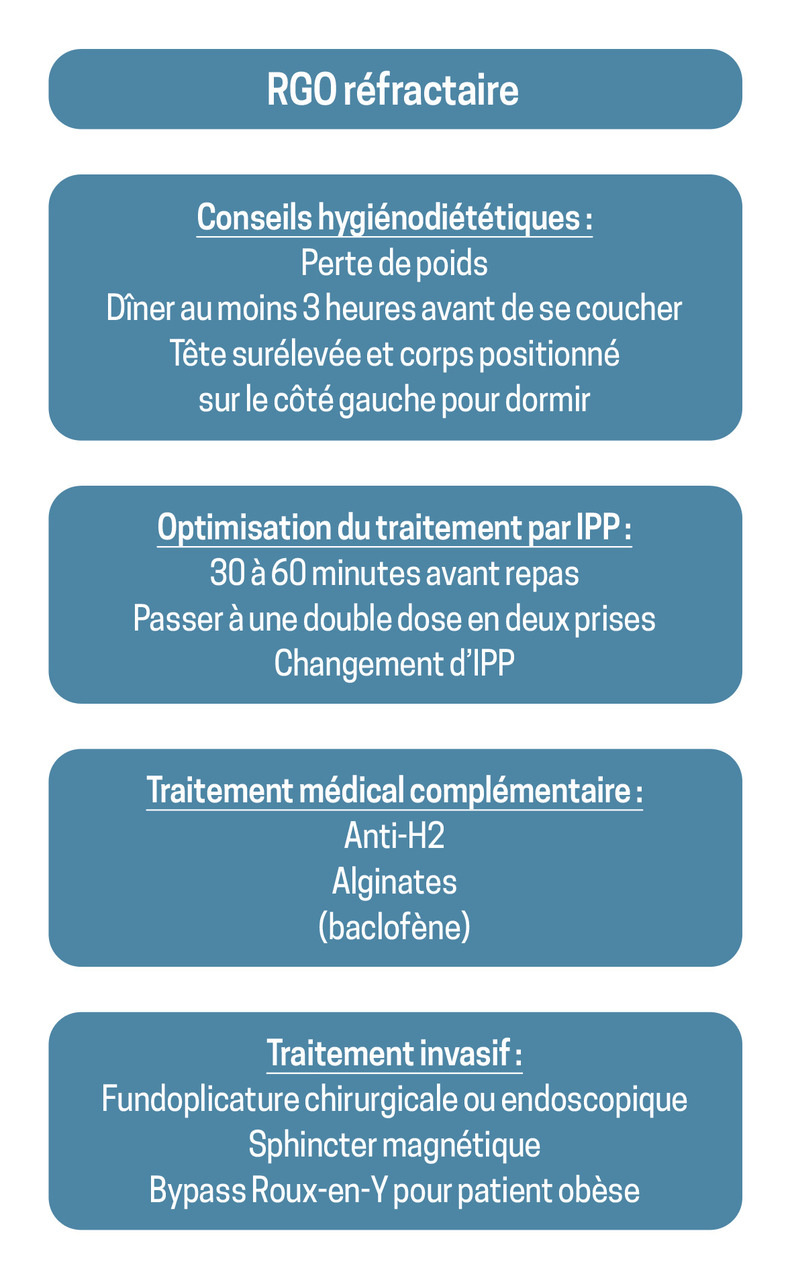
Outre les symptômes atypiques de RGO, la principale indication de la pH-métrie est le « RGO réfractaire », c’est-à-dire des symptômes de RGO ne répondant pas à des doubles doses d’IPP et pour lesquels une prise en charge chirurgicale est envisagée.
Plusieurs diagnostics différentiels
La spécificité des symptômes dits « typiques » du RGO n’est pas de 100 % : ainsi, au-delà des sténoses œsophagiennes, bénignes ou malignes (rapidement détectées par l’EOGD en raison de signes cliniques d’alarme tels que la dysphagie), des diagnostics différentiels doivent être évoqués, en particulier en cas de symptômes de RGO réfractaires au traitement bien conduit par IPP. Ces diagnostics, qui vont de l’achalasie du sphincter inférieur de l’œsophage – identifiée par la manométrie œsophagienne – au pyrosis fonctionnel – identifié par la pH-métrie des 24 heures –, sont listés dans le tableau.
Œsophagite à éosinophiles
L’œsophagite à éosinophiles est une maladie allergique de la muqueuse œsophagienne, prédominant chez l’homme jeune atopique, et typiquement révélée par des impactions alimentaires et des épisodes de dysphagie. Chez l’enfant, les symptômes sont fréquemment intriqués avec des symptômes d’inconfort rétrosternal mimant un RGO. Le seuil doit donc être très bas pour adresser au gastroentérologue un jeune reflueur dont les symptômes récidivent à l’arrêt des IPP, en vue d’une EOGD avec biopsies œsophagiennes.
Pyrosis fonctionnel
Tout comme la dyspepsie fonctionnelle au niveau de l’estomac ou le trouble fonctionnel intestinal au niveau de l’intestin grêle et du côlon, le pyrosis fonctionnel peut mimer en tout point un RGO authentique. Il est exceptionnel qu’un RGO authentique ne réponde pas au traitement par IPP. Les troubles fonctionnels œsophagiens sont probablement au moins aussi prévalents que le RGO authentique.
La gêne pharyngée chronique, quand bien même elle est associée à un « érythème » à l’examen ORL, n’est quasiment jamais liée à un RGO authentique ; elle s’apparente probablement à un trouble fonctionnel de cette région. Par conséquent, ce symptôme n’est généralement pas amélioré par les traitements du RGO.
La prise en charge de ces troubles fonctionnels, le plus souvent par les gastroentérologues, fait appel à des traitements de l’hypersensibilité digestive de type antidépresseurs (tricycliques ou inhibiteurs de la recapture de la sérotonine) ou à des approches non médicamenteuses (relaxation, hypnose, psychothérapie…).
La prise en charge dépend de la fréquence des symptômes
Mesures hygiénodiététiques
Les mesures hygiénodiététiques recommandées pour prévenir le RGO sont bien moins nombreuses que celles que s’imposent la plupart des patients. Il s’agit principalement de diminuer la pression intra-abdominale par la perte de poids (ce qui s’associe souvent à une alimentation moins copieuse et moins riche en graisses), de respecter un intervalle d’au moins trois heures entre la fin du dîner et le coucher afin de laisser l’estomac se vider (la vidange complète de l’estomac se fait généralement en quatre heures), et des mesures posturales comme le fait de dormir sur le côté gauche ou de surélever la tête du lit.
La consommation excessive de café ou de thé peut diminuer le tonus du sphincter inférieur de l’œsophage, les repas excessifs en quantité ou trop riches en graisses ralentissent la vidange gastrique et augmenter la pression intra-abdominale. En revanche, la plupart des aliments perçus au goût comme acides et donc souvent considérés par les patients comme à éviter ne le sont pas. Au contraire, cette stratégie aboutit à des régimes restrictifs qui enferment le patient dans ses symptômes et dans son trouble.
Enfin, il faut rappeler que ces mesures ont essentiellement un intérêt chez les patients qui n’ont pas de traitement ou qui ont un traitement discontinu. De fait, l’effet des IPP est bien supérieur à celui de ces mesures préventives.
Traitements médicamenteux disponibles
Les traitements pharmacologiques du RGO sont les suivants :
- les antiacides, principalement des sels d’aluminium ou le bicarbonate de sodium ;
- les alginates, qui forment un film anti-reflux au-dessus du contenu gastrique et doivent être pris après le repas – et non avant – pour bien fonctionner ;
- les anti-histaminiques de type anti-H2 (famotidine, ranitidine, cimétidine) ;
- les inhibiteurs de la pompe à protons (oméprazole, ésoméprazole, pantoprazole…) ;
- les inhibiteurs compétitifs des canaux potassiques (vonoprazan), aussi efficaces que les IPP, mais non disponibles en France.3
Stratégie thérapeutique par paliers
En cas de symptômes occasionnels (moins de 2 ou 3 épisodes par semaine), il est possible de proposer l’adoption des règles hygiénodiététiques et un traitement au coup par coup par antiacides ou alginates.
En cas de symptômes plurihebdomadaires ou quotidiens, un traitement continu pendant au moins un mois par IPP se justifie. En cas d’inefficacité, les IPP sont augmentés à double dose (soit 40 mg d’oméprazole ou 80 mg d’ésoméprazole), des alginates au coucher peuvent être ajoutés, surtout en cas de régurgitations ou de toux.
Les prokinétiques gastriques peuvent également être proposés dans cette indication avant le dîner, mais se pose alors la question de leur sécurité d’emploi sur le long terme.
Les antihistaminiques de type anti-H2 sont, quant à eux, utilisés dans les cas exceptionnels d’allergie ou d’intolérance aux IPP, ou en complément des IPP à double dose si les symptômes ou l’œsophagite peptique persistent.
Le baclofène a une efficacité pharmacologique et clinique démontrée sur le RGO. Mais, en pratique, il est rarement prescrit en raison de ses effets indésirables neurologiques (somnolence).
Si la posologie recommandée des IPP dans le RGO non compliqué est la demi-dose pendant quatre semaines, la question d’un RGO réfractaire aux IPP, et donc d’un éventuel traitement chirurgical du RGO, ne peut se poser que chez un patient ayant déjà suivi un traitement par IPP à double dose pendant au moins huit semaines sans amélioration significative.
La démarche thérapeutique est décrite dans la figure 4.
Quand adresser au chirurgien ?
En cas de RGO réfractaire authentifié
En théorie, le traitement chirurgical – qui repose en 2024 sur une fundoplicature partielle postérieure dite de Toupet – est indiqué en cas de RGO prouvé et réfractaire dans ses manifestations cliniques ou endoscopiques (œsophagite sévère).
Cependant, les patients authentiquement réfractaires aux IPP sont extrêmement rares, et une évaluation objective par EOGD et pH-métrie des 24 heures permet chez la plupart de ces patients de retenir le diagnostic de pyrosis fonctionnel et non de RGO réfractaire.
En revanche, les patients ayant des régurgitations chroniques invalidantes restent de bons candidats à un traitement chirurgical, dans la mesure où les IPP sont d’un moindre secours dans cette situation clinique. Il faut toutefois retenir que le traitement chirurgical n’est ni efficace à 100 %, ni définitif, ni – et surtout – dépourvu de complications (jusqu’à 11 % de dysphagie et 40 % de ballonnement abdominal dans les suites, en lien avec le montage antireflux).
Par ailleurs, l’âge moyen d’inclusion des patients dans les études chirurgicales du RGO est de 50 ans, et l’inclusion de patients de plus de 70 ans est exceptionnelle. Il n’est donc pas usuel, même devant un RGO réfractaire documenté, d’envisager un traitement chirurgical du RGO au-delà de 70 ans.
Une alternative aux IPP au long cours ?
Concernant tous les autres patients reflueurs non réfractaires, pour qui se pose la question de la chirurgie antireflux pour remplacer un traitement par IPP, il convient de rappeler l’équivalence démontrée entre le traitement par IPP au long cours et le traitement chirurgical du reflux : taux de contrôle symptomatique de 93 % contre 90 % (p = 0,25) à trois ans respectivement, dans un essai randomisé contrôlé en double aveugle ayant inclus près de 400 patients.4 Il convient également de rappeler l’excellent profil de tolérance des IPP au long cours : une abondante littérature a suggéré des associations pathologiques (infections à Clostridioides difficile, gastroentérites bactériennes, pullulation microbienne du grêle, pneumopathies infectieuses, insuffisance rénale chronique, fractures osseuses, démence, infarctus du myocarde) sans jamais cependant établir de rapport de causalité.5,6
Ainsi, la prise d’IPP, lorsqu’elle est indiquée et efficace, doit être encouragée. Le choix d’une option thérapeutique chirurgicale par peur de la prise prolongée des IPP apparaît déraisonnable.
Drapeaux rouges : les signes d’alarme du reflux gastro-œsophagien
Les drapeaux rouges du reflux gastro-œsophagien sont d’abord les signes d’alarme qui doivent faire réaliser une EOGD avant même d’envisager un test thérapeutique. Ces critères, précisés par la Haute Autorité de santé en 2001, incluent :
- un âge supérieur à 50 ans : le RGO est une pathologie qui débute chez l’enfant et le jeune adulte. Un début des symptômes après 50 ans est inhabituel et doit faire redouter un diagnostic différentiel, en particulier une sténose œsophagienne, notamment d’origine tumorale ;
- un amaigrissement : souvent, le patient qui consulte pour des symptômes de reflux est en surpoids ou obèse, l’excès alimentaire et l’obésité abdominale augmentant le risque de RGO. Quand il est de poids normal, il fractionne spontanément les repas et grignote au fil de la journée, pour éviter la réplétion gastrique complète qui favorise le reflux. Il est, en revanche, tout à fait inhabituel qu’un patient évite la prise alimentaire et/ou maigrisse s’il est atteint de RGO ;
- une dysphagie : bien que de nombreux reflueurs rapportent une dysphagie occasionnelle en lien avec leur hernie hiatale ou un péristaltisme œsophagien inefficace, la dysphagie pose toujours l’indication d’une EOGD rapide ;
- une hémorragie digestive ou une anémie ferriprive : il est ici question d’éliminer un cancer de l’œsophage mais également une œsophagite sévère qui pourrait nécessiter un traitement par IPP spécifique tant par la dose (double) que par la durée (8 semaines en théorie, souvent au long cours en pratique).
Que dire à vos patients ?
Le RGO est une maladie chronique et fluctuante dans le temps : débuter un traitement pour quelques mois à l’occasion de symptômes majorés dans une période de stress ou de prise de poids ne signifie pas qu’il devra être poursuivi à vie.
Il n’y a aucun lien entre la sévérité des symptômes et la présence de lésions œsophagiennes en endoscopie : la moitié des patients reflueurs ont une endoscopie œso-gastro-duodénale normale.
Les règles hygiénodiététiques et les topiques ou les alginates à la demande peuvent suffire en cas de symptômes épisodiques. Cependant, une cure de traitement par IPP à demi-dose au moins quatre semaines est indiquée en cas de symptômes plurihebdomadaires.
La sécurité d’emploi des IPP et la morbidité de la chirurgie du RGO justifient de ne pas envisager une cure chirurgicale du reflux si les symptômes sont bien contrôlés sous traitement médicamenteux.
2. Weusten B, Bisschops R, Dinis-Ribeiro M, et al. Diagnosis and management of Barrett esophagus: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2023;55(12):1124-46.
3. Abdel-Aziz Y, Metz DC, Howden CW. Review article: Potassium-competitive acid blockers for the treatment of acid-related disorders. Aliment Pharmacol Ther 2021;53(7):794-809.
4. Galmiche JP, Hatlebakk J, Attwood S, et al. Laparoscopic antireflux surgery vs esomeprazole treatment for chronic GERD: The LOTUS randomized clinical trial. JAMA 2011;305(19):1969-77.
5. Attwood SE, Ell C, Galmiche JP, et al. Long-term safety of proton pump inhibitor therapy assessed under controlled, randomised clinical trial conditions: Data from the SOPRAN and LOTUS studies. Aliment Pharmacol Ther 2015;41(11):1162-74.
6. Salvo EM, Ferko NC, Cash SB,et al. Umbrella review of 42 systematic reviews with meta-analyses: The safety of proton pump inhibitors. Aliment Pharmacol Ther 202;54(2):129-43.

 Encadrés
Encadrés