Parmi les causes de règles pathologiques, en dehors de l’endométriose, les ménorragies (ou saignements utérins abondants [SUA]), doivent être dépistées, car elles altèrent significativement la qualité de vie des femmes, depuis la ménarche jusqu’à la ménopause.1 Elles entraînent des comorbidités agissant sur leur santé globale.2 Les SUA constituent notamment la première cause d’anémie ferriprive chez les femmes en âge de procréer. Cependant, ces manifestations sont encore mal prises en charge. Les raisons en sont nombreuses : l’une des plus importantes est la difficulté pour les femmes à juger de l’abondance de leurs règles. Une enquête européenne a montré que 46 % des femmes touchées n’avaient jamais consulté pour cette raison.3 Le fait que les menstruations soient physiologiques ne facilite pas la prise en charge, car leur caractère hémorragique doit d’abord être évalué, puis exploré, afin de mettre en place les traitements les plus adaptés ; et ce, même chez les jeunes filles, pour lesquelles les SUA peuvent être liés à une immaturité de l’axe hypothalamo-hypophysaire dans les deux à cinq ans après la puberté.
Récemment, des recommandations nationales et internationales sur les explorations à réaliser et les traitements disponibles, dans le cadre d’une prise en charge multidisciplinaire, permettent de ne pas laisser ces patientes dans une errance diagnostique et thérapeutique.4,5
Cet article concerne les saignements d’origine utérine en dehors de la grossesse ; les hémorragies génitales basses (vulvaires, vaginales, cervicales) et les métrorragies en cours de grossesse ne sont pas abordées.
Évaluation des SUA
Les SUA correspondent à des anomalies du cycle menstruel, qu’ils soient trop abondants (supérieurs à 80 mL), trop prolongés (plus de 7 jours) ou trop fréquents (durée des cycles inférieure à 21 jours).
Leur prévalence, comprise entre 10 et 30 %, varie en fonction de l’évaluation clinique et des perceptions socioculturelles.
La première étape de la prise en charge consiste à évaluer ces SUA. Différents scores semi-quantitatifs sont disponibles. Le score de Higham (fig. 1), largement recommandé car le plus ancien, reste peu utilisé. Il est, en effet, peu adapté à l’évolution des types de protections utilisées (cups, culottes menstruelles).6 Un score de Higham supérieur à 100 définit des SUA, mais ce n’est pas le seul critère en l’absence d’anémie ou de carence martiale : la présence de douleurs associées, l’impact sur la vie sociale, scolaire, professionnelle et/ou sexuelle doivent aussi être pris en considération.
Causes des SUA
Les causes varient en fonction de l’âge. Il en existe deux grands types (tableau).7
Causes liées à des anomalies structurelles
Les causes organiques, dont l’acronyme est PALM, regroupent les polypes, l’adénomyose (endométriose utérine), les léiomyomes et les origines malignes. Ces pathologies utérines sont rarissimes chez les jeunes filles et surviennent surtout après l’âge de 30 ans.
Causes non liées à des anomalies structurelles
Les autres causes répondent à l’acronyme COEIN, regroupant la coagulopathie, la dysfonction ovarienne, la pathologie endométriale, les origines iatrogènes et les causes non identifiées.
Dans 10 % des cas, une maladie hémorragique héréditaire (MHH) peut être dépistée : par ordre de prévalence, il peut s’agir d’une maladie de Willebrand de type quantitatif (type 1 ou 3) ou de type qualitatif selon l’anomalie fonctionnelle du facteur Willebrand (2A, 2B, 2M, 2N), ou d’une hémophilie mineure A ou B chez les femmes conductrices à taux bas. Beaucoup plus rarement, un autre déficit hémorragique rare homozygote (déficit en F [facteur]VII, FXI, FII, FV, FX, FXIII, déficit combiné en FV et FVIII, afibrinogénémie) est possible. La prévalence d’une MHH peut être néanmoins plus élevée (30 %) chez les adolescentes.8
Parmi les pathologies endocriniennes à rechercher – bien que rares –, l’hypothyroïdie peut se traduire par des hyperménorrhées (13 à 22 %). Le syndrome des ovaires polykystiques (SOPK) par dysovulation doit être recherché devant une obésité et un hirsutisme associés.
Des SUA peuvent également être liés à la prise d’anticoagulant, soit lors de l’introduction, soit en cours de traitement. Les femmes sous anticoagulants oraux directs auraient des SUA dans 20 à 40 % des cas, impactant de façon péjorative leur qualité de vie.9 Une recherche étiologique doit être néanmoins conduite systématiquement, les SUA révélant fréquemment une pathologie gynécologique.
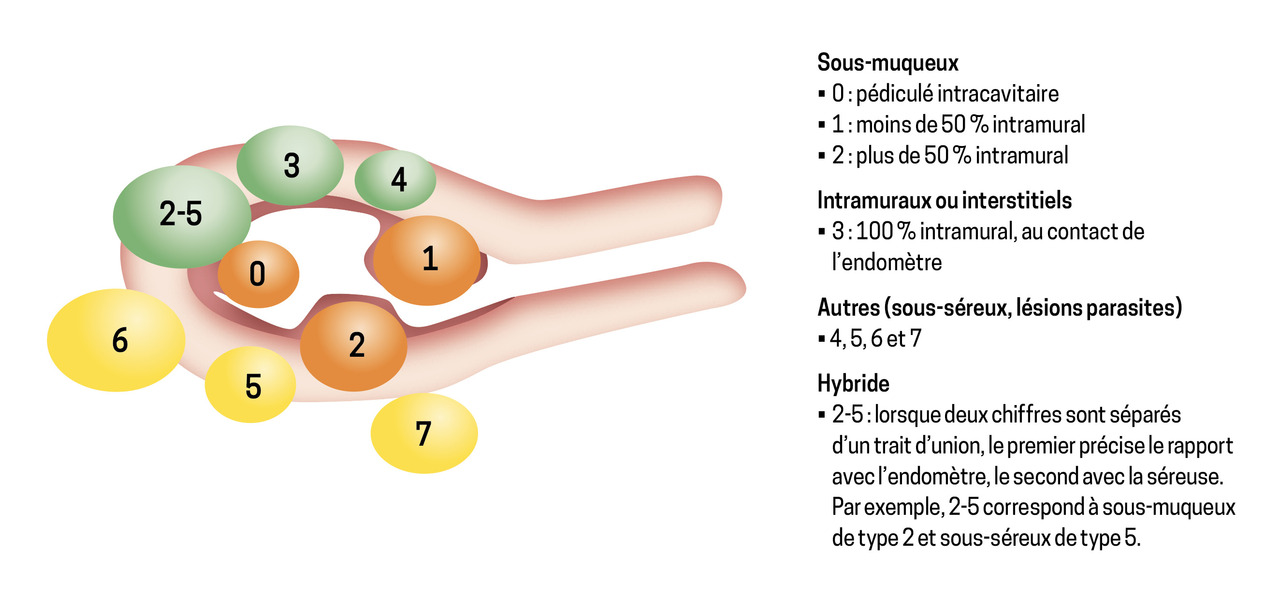
Parmi les léiomyomes, myomes ou fibromes, la classification FIGO en différencie huit types selon leur localisation anatomique dans la paroi utérine. Ils peuvent être sous-muqueux (0, 1, 2), intramural à 100 % (3) ou autre (4, 5, 6, 7) [fig. 2]. Seuls les fibromes avec une composante intracavitaire peuvent être responsables de règles abondantes (fibromes de types 0, 1, 2, 3).
Lorsque aucune cause n’est mise en évidence, on parle de SUA fonctionnels.
Quel bilan réaliser en première intention ?
Aux Hospices civils de Lyon, un hôpital de jour spécifiquement dédié a été créé ; il permet aux patientes de bénéficier d’un bilan sanguin complet, d’une imagerie utérine (échographie en première intention), d’une consultation gynécologique et d’une consultation d’hémostase.
Les SUA sont quantifiés (score de Higham). Puis l’interrogatoire doit permettre de préciser les antécédents gynécologiques, la parité, le mode de contraception, les traitements en cours, les antécédents hémorragiques personnels provoqués et/ou spontanés et les antécédents familiaux. La réalisation d’un examen gynécologique n’est pas indispensable.
Quel que soit l’âge, un bilan doit ensuite être proposé.
Échographie
La réalisation d’une échographie endovaginale ou uniquement pelvienne permet de rechercher une cause organique. Les recommandations du Collège national des gynécologues et obstétriciens français (CNGOF) publiées en 2023 précisent que l’imagerie par résonance magnétique (IRM) pelvienne ne doit pas être systématique. Elle doit être réalisée en deuxième intention, en cas de douleurs associées ; elle permet d’éliminer une endométriose et/ou de cartographier des myomes avant un traitement soit chirurgical, soit par radiologie interventionnelle.4
Bilan biologique
Un bilan biologique est d’autant plus pertinent que les SUA sont apparus dès la puberté.
Il comprend les examens suivants :
- hémogramme et dosage de la ferritinémie pour évaluer l’anémie et/ou la carence martiale ;
- taux de prothrombine (TP), temps de céphaline activé (TCA), fibrinogène, facteur VIII, facteur Willebrand (antigène et activité [VWF : Ag ; VWF : Act]) et taux de plaquettes (les tests standards ne dépistent pas les déficits modérés et la maladie de Willebrand de type 2) ;
- dosage de la thyréostimuline (TSH) ;
- bilan hormonal, à la recherche d’une hyperœstrogénie (obésité, hirsutisme) en cas de suspicion de SOPK (taux de LH supérieur à celui de la FSH, testostérone augmentée…).
Traitements médicamenteux
À l’issue de ce bilan étiologique, il convient de proposer sans délai des traitements individualisés dans le cadre d’une prise en charge multidisciplinaire, largement recommandée dans plusieurs protocoles nationaux de diagnostic et de soins (PNDS).
Dans tous les cas, il s’agit de proposer aux femmes les traitements les mieux adaptés en fonction des causes gynécologiques et/ou sanguines, de leur âge et de leur souhait.
L’expérience lyonnaise a montré que chez 450 femmes, dans 60 % des cas, il n’existe pas de cause gynécologique ni de déficit héréditaire en facteur de coagulation. Dans la majorité des cas, des traitements symptomatiques et/ou hormonaux individualisés ont été proposés en expliquant leurs bénéfices/risques.
Traitement de la carence martiale
Le premier traitement est bien sûr celui de l’anémie et/ou de la carence martiale. L’administration per os est à privilégier, mais 20 à 40 % des patients prenant du fer par voie orale se plaignent de nausées, vomissements, constipation et d’un goût métallique indésirable.10 Dans ce cas, un schéma posologique avec une prise matinale un jour sur deux ou un changement de spécialité pharmaceutique peut être proposé, avant d’envisager le recours à une administration intraveineuse.10 On réserve, en effet, la voie intraveineuse aux anémies profondes et aux cas d’inefficacité ou d’intolérance. L’administration est alors réalisée soit en milieu hospitalier, soit à domicile (HAD).Le traitement martial doit s’intégrer dans une stratégie thérapeutique complète. Et le diagnostic d’anémie chronique ne doit pas être retenu sans le diagnostic et le traitement des SUA.
Antalgiques
Les antalgiques et/ou anti-inflammatoires sont prescrits en cas de syndrome douloureux. Des antalgiques de type flurbiprofène ou acide méfénamique peuvent être associés en cas de dysménorrhées fréquentes chez les adolescentes (elles concernent en moyenne trois adolescentes sur quatre). La présence de SUA favorise la survenue de dysménorrhées. Elles sont essentiellement dues à un excès de production de prostaglandines (sous l’action de la progestérone) et souvent liées à des cycles dysovulatoires. Ceci explique l’efficacité habituelle des molécules anti-inflammatoires. La présence de dysménorrhées aggravant fortement l’impact des SUA sur la qualité de vie, ces classes thérapeutiques ne doivent pas être proscrites systématiquement (y compris pour les femmes atteintes de MHH), même si elles peuvent provoquer des anomalies plaquettaires fonctionnelles associées ou non à une aggravation de la symptomatologie hémorragique.
Traitement antifibrinolytique
L’association à un traitement antifibrinolytique de type acide tranéxamique est fortement recommandée, pendant toute la durée des règles abondantes.12 Il existe peu de contre-indications : épilepsie, antécédents thrombotiques artériels.Son utilisation en cas d’épisode thrombotique veineux récent et chez les patientes sous anticoagulant n’est cependant pas recommandée.
Traitements hormonaux
En dehors de ses contre-indications, un traitement hormonal est fortement recommandé pour toutes les femmes ayant des SUA lorsque aucune cause gynécologique n’a été mise en évidence ou après un éventuel traitement chirurgical.13 Malgré ces recommandations, la prescription d’un traitement hormonal fait actuellement l’objet de réticence et/ou de rejet par un certain nombre de femmes. Il convient donc de disposer d’un arsenal thérapeutique large pour adapter les traitements de façon individualisée en fonction de l’âge, des antécédents personnels ou familiaux (thromboses), du désir de grossesse...
Une réévaluation régulière de l’efficacité et des intolérances est indispensable, car les SUA peuvent évoluer tout au long de la vie génitale.
On distingue :
- les contraceptions œstroprogestatives (COP) dont la prise peut être orale ou non. Le choix dépend de la composition en progestatif et en éthinylestradiol, de l’âge de la patiente, de son poids et de la tolérance. La prise en continu est indiquée dans les SUA dans le but d’obtenir une aménorrhée secondaire. Dans les premiers mois d’une prise en continu, l’apparition de spottings nécessite un arrêt du traitement pendant quatre à sept jours avant une reprise en continu. Les nouvelles molécules à base d’œstrogènes naturels sont également indiquées dans les SUA, car elles diminuent le flux ou la durée des règles. Il s’agit de molécules contenant du valérate d’estradiol ou de l’hémihydrate d’estradiol ;
- les pilules microprogestatives, qui se prescrivent en continu. Elles sont une option en cas de SUA, mais le risque principal d’échec est la survenue de métrorragies et de spottings chez environ un tiers des patientes, et une tolérance inférieure aux COP (humeur, poids, libido…) ;
- les macroprogestatifs seuls. La prescription d’acétate de chlormadinone et de nomégestrol est soumise à des restrictions (risque accru de méningiomes). L’autorisation de mise sur le marché (AMM) est maintenue dans certaines indications et les traitements doivent alors être les plus courts possible ; le rapport bénéfice-risque doit être réévalué au moins une fois par an. En cas de traitement prolongé, une surveillance par IRM cérébrale est recommandée.
Le diénogest, progestatif hybride, puissant, atrophiant pour l’endomètre, utilisé en continu, possède un effet sur les molécules pro-inflammatoires et inhibe l’angiogenèse, d’où son intérêt dans l’endométriose et l’adénomyose. Chez les adolescentes, l’étude VISADO a montré que son utilisation était associée à une diminution modérée de la déminéralisation osseuse rachidienne, régressant à l’arrêt du traitement.14
Le dispositif intra-utérin (DIU) au lévonorgestrel est un traitement de choix dans les ménorragies fonctionnelles ou en cas d’adénomyose utérine. Dans 16 à 20 % des cas, une aménorrhée secondaire est décrite après un an d’utilisation.15
Attention, le DIU au cuivre et les implants ne sont pas recommandés chez les patientes avec des SUA, ni pour les patientes ayant un déficit en facteur de coagulation héréditaire ou acquis.
Différentes techniques chirurgicales
Les traitements chirurgicaux sont proposés en cas d’inefficacité, de contre-indications et/ou de mauvaise tolérance des traitements hormonaux, en fonction des causes mises en évidence. Différentes méthodes sont disponibles, de l’embolisation des artères utérines en radiologie interventionnelle aux traitements chirurgicaux conservateurs de première ou de deuxième génération tels que la thermocoagulation de l’endomètre (ballonnet chauffé à 80 °C ou système de radiofréquence). Les myomectomies peuvent être réalisées par hystéroscopie, par cœlioscopie, par voie robotique ou par laparotomie en fonction du nombre et de la localisation des fibromes. L’hystérectomie par voie cœlioscopique, ou cœlioscopie robot-assistée, par voie vaginale ou par laparotomie, est proposée en dernier recours en cas d’échec des traitements conservateurs.
Le choix de la technique chirurgicale dépend de la cause des saignements, de l’âge de la patiente, du désir de grossesse, du souhait de conserver ou non l’utérus et doit faire l’objet d’une information éclairée.
Les techniques de résection endométriale ou de thermodestruction, indiquées dans l’adénomyose ou les SUA fonctionnels, ne sont pas compatibles avec un désir de grossesse.
Si l’indication de myomectomie ou polymyomectomie est retenue, elle est réalisée dans la mesure du possible par voie minimale invasive (cœlioscopique ou robotique) en raison d’une moindre morbidité par rapport à l’abord laparotomique.Si l’indication d’hystérectomie est retenue, elle est réalisée si possible par voie minimale invasive (vaginale, cœlioscopique ou robotique) en raison d’une moindre morbidité par rapport à la laparotomie, et l’ovariectomie ne doit pas être proposée (prévention de la ménopause chirurgicale induite).
Cas particulier des maladies hémorragiques héréditaires
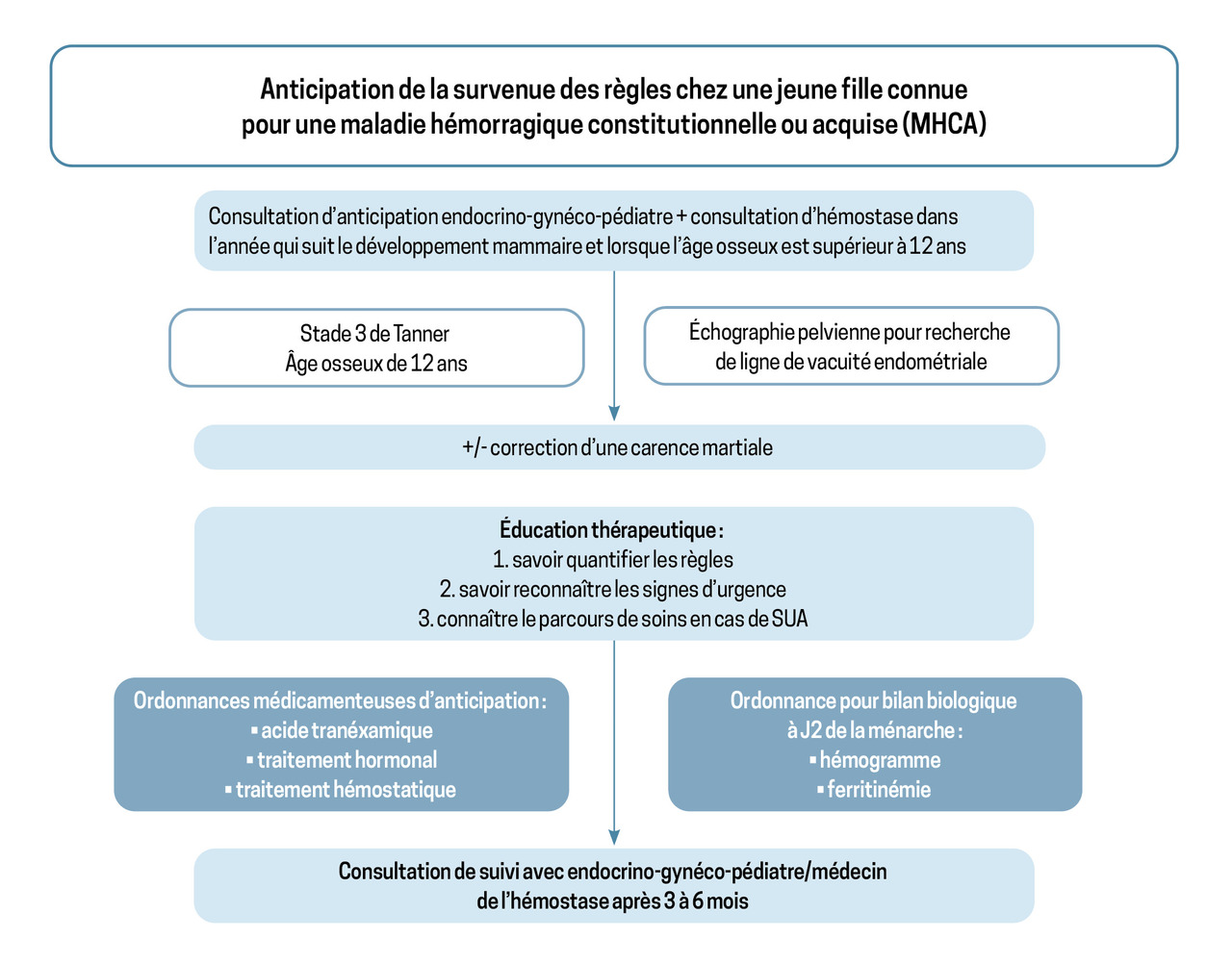
En cas de maladie hémorragique héréditaire, les SUA représentent les premières manifestations hémorragiques et sont rapportées jusqu’à 80 % des jeunes filles ; elles ont un retentissement sur la qualité de vie.16 Lorsque la MHH est mise en évidence avant la survenue de la ménarche, le PNDS sur les SUA chez la jeune femme atteinte de maladies hémorragiques rares constitutionnelles ou acquises (MHCA), publié en novembre 2022, recommande d’anticiper les premières règles par une collaboration gynécologue-hématologue et de proposer une éducation de la jeune fille et de ses parents (consultation permettant de délivrer les ordonnances pour les différents traitements, avec comme consigne de se procurer les traitements en amont, la conduite à tenir en cas de survenue de la ménarche, à l’oral et par écrit, avec les coordonnées des différents médecins intervenants).17 L’évaluation précoce des SUA permet de diminuer les délais de recours aux soins, d’adapter le traitement hormonal et/ou de proposer un traitement antihémorragique spécifique, de traiter l’éventuelle anémie aigüe ou chronique et ainsi d’améliorer la qualité de vie (fig. 3).
De façon générale, la recherche systématique d’anomalies du bilan d’hémostase a pour objectif de dépister majoritairement un déficit modéré en facteur Willebrand compte tenu de sa prévalence dans la population générale.4 Dans l’expérience lyonnaise (cohorte de 450 femmes), 9,2 % des femmes avaient un déficit modéré (VWF : Act 40 %) et seulement 0,7 % un déficit plus sévère (VWF : Act 30 %).
Enfin, même en présence d’une MHH, les autres causes de SUA doivent être recherchées de manière systématique, car celle-ci n’est finalement que rarement responsable des SUA.
Que dire à vos patientes ?
Des règles abondantes ayant un retentissement sur la qualité de vie et sur la vie sociale doivent amener à consulter.
Le panel de traitements hormonaux disponibles permet de proposer des molécules adaptées à chaque femme en fonction des contre-indications, de l’âge, des intolérances et du désir de grossesse.
Les techniques conservatrices de type thermocoagulation doivent être proposées avant l’hystérectomie en dernier recours.
Liens utiles
Agence nationale de sécurité des médicaments et des produits de santé (ANSM). Situations pour lesquelles l’utilisation de Lutenyl/Lutéran peut être envisagée ou non au regard du rapport bénéfice/risque, et conduite à tenir. Décembre 2021. http ://bit.ly/4mO9b3P
Haute Autorité de santé (HAS). Contraception chez la femme adulte et de l’adolescente en âge de procréer (hors post-partum et post-IVG). Septembre 2019. https ://bit.ly/4kAHYBH
HAS. Protocole national de diagnostic et de soins (PNDS) Saignements utérins abondants (SUA) chez la jeune femme atteinte de maladies hémorragiques rares constitutionnelles ou acquises (MHCA). Novembre 2022. https ://bit.ly/449JxAw
HAS. PNDS Maladie de Willebrand. Février 2021. https ://bit.ly/4kT8FBa
World Health Organization (WHO). WHO guideline on use of ferritin concentrationsto assess iron status in individuals and populations. 2020. https ://bit.ly/4mUxs9N
Pap-pediatrie.fr. Métrorragies de l’adolescente. Mai 2017. https ://bit.ly/4mWxeyT
Hospices civils de Lyon. Règles abondantes. Juin 2024. https ://www.chu-lyon.fr/regles-abondantes
Réseau Hémogyn. Reconnaître et soigner les pathologies liées aux règles abondantes chez la femme. https ://hemogyn.fr/
2. Wright TS, Cygan PH. Closing the diagnostic gap in adolescents and young adult women with bleeding disorders: Missed opportunities. Obstet Gynecol 2023;42(2):251-6.
3. Fraser IS, Mansour D, Breymann C, et al. Prevalence of heavy menstrual bleeding and experiences of affected women in a European patient survey. Int J Gynecol Obstet 2015;128(3):196-200.
4. Brun JL, Plu-Bureau G, Huchon C, et al. Management of women with abnormal uterine bleeding: Clinical practice guidelines of the French National College of Gynaecologists and Obstetricians (CNGOF). Eur J Obstet Gynecol Reprod Biol 2023;288:90-107.
5. Connell NT, Flood VH, Brignardello-Petersen R, et al. ASH ISTH NHF WFH 2021 guidelines on the management of von Willebrand disease. Blood Adv 2021;5(1):301-25.
6. Higham JM, O’Brien PM, Shaw RW. Assessment of menstrual blood loss using a pictorial chart. Br J Obstet Gynaecol 1990;97(8):734-9.
7. Jain V, Munro MG, Critchley HOD. Contemporary evaluation of women and girls with abnormal uterine bleeding: FIGO systems 1 and 2. Int J Gynecol Obstet 2023;162(S2):29-42.
8. Zia A, Jain S, Kouides P, et al. Bleeding disorders in adolescents with heavy menstrual bleeding in a multicenter prospective US cohort. Haematologica 2020;105(7):1969-76.
9. Hassan N, Schapkaitz E, Rhemtula H, et al. Incidence and impact on quality of life of heavy menstrual bleeding in women on oral anticoagulant therapy. Clin Appl Thromb Hemost 2024;30:10760296241281366.
10. Tolkien Z, Stecher L, Mander AP, et al. Ferrous sulfate supplementation causes significant gastrointestinal side-effects in adults: A systematic review and meta-analysis. PLoS One 2015;10(2):e0117383.
11. Rugeri L, Fruchou Y, Brodbeck C, et al. Evaluation of coagulation disorders and iron deficiency in women with heavy menstrual bleeding. Int J Gynaecol Obstet. 2025 Online ahead of print.
12. Jahanfar S, Mortazavi J, Lapidow A, et al. Assessing the impact of hormonal contraceptive use on menstrual health among women of reproductive age. A systematic review. Eur J Contracept Reprod Health Care 2024;29(5):193-223.
13. VanderMeulen H, Tang GH, Sholzberg M. Tranexamic acid for management of heavy vaginal bleeding: Barriers to access and myths surrounding its use. Res Pract Thromb Haemost 2024;8(3):102389.
14. Ebert AD, Dong L, Merz M, et al. Dienogest 2 mg daily in the treatment of adolescents with clinically suspected endometriosis: The VISanne study to assess safety in ADOlescents. J Pediatr Adolesc Gynecol 2017;30(5):560-7.
15. Sergison JE, Maldonado LY, Gao X, et al. Levonorgestrel intrauterine system associated amenorrhea: A systematic review and metaanalysis. Am J Obstet Gynecol 2019;220(5):440-8.
16. De Wee EM, Knol HM, Mauser-Bunschoten EP, et al. Gynaecological and obstetric bleeding in moderate and severe von Willebrand disease. Thromb Haemost 2011;106(5):885-92.
17. HAS. PNDS. Saignements utérins abondants (SUA) chez la femme atteinte de maladies hémorragiques rares constitutionnelles ou acquises (MHCA). Toulouse ; Novembre 2022. https://bit.ly/4kYjPVl
18. HAS. Traitements médicamenteux des fibromes utérins. 24 novembre2022. https://bit.ly/3SHTzmb

 Encadrés
Encadrés