La rémission d’une maladie est définie, de manière générale, comme un état ou une période durant laquelle l’activité de la maladie est faible ou nulle ; elle peut être spontanée ou le résultat d’une thérapie.1 Le terme de rémission n’implique pas la guérison de la maladie, qui nécessite le retour à un état physiopathologique normal et l’absence de symptômes de la maladie sans traitement continu.2 Plus subtilement, la rémission de l’asthme diffère également du contrôle de la maladie : le contrôle implique généralement des symptômes récents minimes, l’absence d’exacerbation et la stabilité de la fonction pulmonaire ; la rémission correspond à une absence plus durable de symptômes, avec l’élimination des exacerbations nécessitant des corticostéroïdes systémiques et une stabilisation de la fonction pulmonaire, idéalement associée à la disparition de l’inflammation.1 Les patients dont l’asthme est bien contrôlé peuvent être considérés au fil du temps comme étant en rémission.
Outre la rémission spontanée pouvant survenir au cours de l’enfance, les innovations récentes dans le traitement de l’asthme, notamment les biothérapies, ont permis de passer d’un simple contrôle de la maladie à une perspective de plus en plus réaliste d’induction d’une véritable rémission.2
Rémission spontanée au cours de l’enfance
De nombreuses études ont évalué l’incidence de la rémission spontanée dans l’asthme de l’enfant, avec des résultats extrêmement variables en fonction des populations étudiées et des définitions à la fois de l’asthme et de la rémission.
Dans la cohorte historique de Tucson, parmi les enfants ayant présenté des épisodes sifflants avant l’âge de 3 ans, 60 % étaient entrés en rémission avant l’âge de 6 ans.3
La cohorte MAS (Melbourne Asthma Study) fait état d’un taux de rémission similaire pour la population d’enfants ayant des sifflements exclusivement viro-induits, la majorité de ces rémissions ayant eu lieu avant l’âge de 10 ans.4
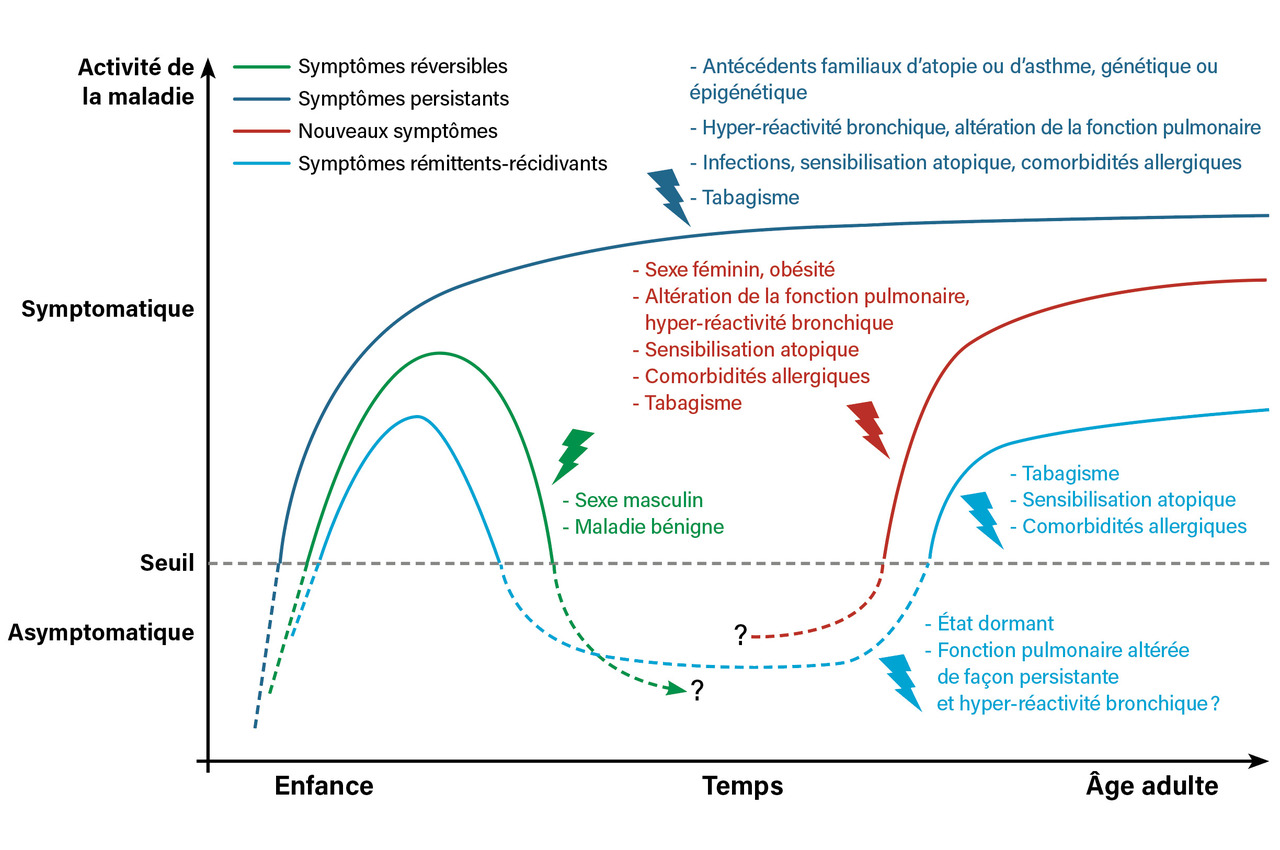
Les facteurs de risque de persistance de l’asthme au cours de l’enfance ont été bien établis :5,6 exposition au tabac dans la petite enfance, sensibilisation allergique précoce (avant l’âge de 3 ans) aux pneumallergènes domestiques (acariens, animaux) et/ou aux trophallergènes, atopie parentale, existence d’une obstruction ou d’une hyper-réactivité bronchique aux explorations fonctionnelles respiratoires (EFR), fréquence élevée des symptômes.
De multiples études de cohorte ont ainsi montré que le phénotype « sifflements épisodiques viro-induits » est de bon pronostic, évoluant vers la rémission ou des symptômes légers à l’âge de 5 ans.3,7,8 Néanmoins, ce phénotype précoce et très spécifique, qui n’est pas étiqueté comme de l’asthme par les Anglo-Saxons, pourrait relever d’une autre physiopathologie.9
Rémission à l’adolescence ou à l’âge adulte
L’étude CAMP (Childhood Asthma Management Program), incluant uniquement des enfants ayant un asthme léger à modéré (avec hyper-réactivité bronchique prouvée par un test à la métacholine), a montré que la rémission de l’asthme à l’adolescence est rare (seulement 6 % dans cette cohorte), l’asthme léger étant deux fois plus susceptible d’évoluer favorablement que l’asthme modéré.10 Les patients n’ayant ni sensibilisation ni exposition allergénique au domicile (chats, chiens, acariens, blattes et moisissures) avaient trois fois plus de chance d’avoir une rémission de leur asthme. Une fonction respiratoire conservée et un degré d’hyper-réactivité bronchique moindre étaient également associés à un plus fort taux de rémission.
La cohorte MAS fournit également des données évolutives de l’enfance à l’âge adulte : parmi les enfants ayant un diagnostic d’asthme à l’âge de 7 ans, 47 % étaient en rémission à 50 ans (asymptomatiques, sans traitement de fond).4
En pratique, plus l’asthme est sévère dans l’enfance, souvent associé à une polymorbidité allergique et à une inflammation éosinophilique, plus le risque de persistance à l’âge adulte est élevé. Si les sifflements légers viro-induits n’évoluent généralement pas vers l’asthme au cours de l’enfance ou de l’adolescence, ils pourraient être liés à un risque accru de bronchopneumopathie chronique obstructive (BPCO) à l’âge adulte, surtout si la fonction respiratoire est pathologique en période néonatale.11
Rechute de l’asthme après la rémission clinique
La rémission clinique n’est pas systématiquement accompagnée par une rémission fonctionnelle, ouvrant la voie à de possibles rechutes.
Dans une étude néerlandaise, plus de la moitié des patients en rémission à l’âge adulte après un asthme dans l’enfance présentaient encore une altération de la fonction respiratoire ou une hyper-réactivité bronchique,12 ce qui suggère que la rémission des symptômes n’implique pas systématiquement la rémission de la pathologie sous-jacente.
L’étude néo-zélandaise Dunedin Multidisciplinary Health and Development Study, qui a évalué les symptômes d’asthme dans une population suivie de 9 à 26 ans, rapporte un taux de rémission de 27 % (défini comme l’absence de symptômes). Mais, parmi ces patients, près de la moitié ont rechuté avant l’âge de 26 ans, avec comme principaux facteurs de risque la sensibilisation aux acariens, l’hyper-réactivité bronchique et la précocité des premiers symptômes.13 Chez les patients non atopiques, le risque de rechute a été particulièrement associé au tabagisme actif.14
La rémission pourrait donc correspondre à un état dormant de l’asthme, qui n’exclut pas la récidive des symptômes,15 puisque les anomalies de la fonction respiratoire semblent précéder l’asthme16,17 et persister en rémission.12 Ainsi, de nombreux patients vivent des années sans symptômes et rechutent plus tard dans la vie, ce qui montre bien l’importance des études de cohorte sur le très long terme, ainsi que le risque de surestimer les taux de rémission sur la base d’évaluations à un seul temps donné (figure).9
Asthme sévère un jour, asthme sévère toujours ?
Avant les biothérapies
Dans la cohorte MAS,4 les enfants ayant un asthme considéré comme sévère à l’âge de 7 ans avaient le plus faible taux de rémission à l’âge adulte, taux non nul cependant (15 %).
La cohorte CAMP montre également que l’asthme sévère tend à persister, et à rester sévère : environ la moitié des patients ayant un asthme sévère à la fin de l’adolescence gardent un profil similaire à l’âge adulte. En analyse multivariée, les facteurs de risque de sévérité persistante étaient la diminution du rapport volume expiratoire maximal par seconde sur capacité vitale forcée (VEMS/CVF) post-bronchodilatateur et le tabagisme maternel pendant la grossesse.18 Les interventions visant à préserver la fonction pulmonaire pourraient ainsi prévenir la progression de la maladie.18
Rémission des asthmes sévères sous biothérapies
L’avènement des biothérapies a permis des avancées majeures dans le traitement de l’asthme, faisant émerger un nouveau concept de rémission sous traitement. Cette nouvelle définition de la rémission s’inspire de celle en vigueur dans les maladies inflammatoires, qui implique un contrôle total et prolongé sous traitement. En 2023, le consensus rassemblant American College of Allergy, Asthma and Immunology (ACAAI), American Academy of Allergy, Asthma & Immunology (AAAAI), American Thoracic Society (ATS)19 définit la rémission sous biothérapie comme l’absence de crise sévère (et donc de corticothérapie systémique), l’absence d’absentéisme scolaire ou d’arrêt de travail durant l’année passée, une fonction pulmonaire stable et optimisée (avec au moins deux mesures dans l’année), des scores de contrôle favorables (ACT > 20, AirQ 2 et ACQ 0,75) sur l’année (avec au moins deux mesures), des symptômes nécessitant la prise ponctuelle de traitement de secours au maximum une fois par mois, un traitement de fond comprenant des doses faibles à moyennes de corticostéroïdes inhalés.
De fait, chez certains patients, l’évolution sous biothérapie est spectaculaire, faisant émerger les termes de « super-répondeurs » ou « réponse complète » ; environ un tiers des patients sous biothérapies correspondent à cette définition (tableau).20 Cette forme de rémission sous traitement devient le nouvel objectif des traitements dans l’asthme sévère, et donc un critère de jugement dans les études cliniques.
Ainsi, dans l’étude VOYAGE,21 la rémission clinique a été évaluée sous biothérapie (dupilumab) et a montré une proportion significativement plus élevée d’enfants en rémission clinique dans le groupe traité que dans le groupe placebo.
Néanmoins, il reste à déterminer si ces thérapeutiques modifient les mécanismes physiopathologiques sous-jacents, et si elles doivent être poursuivies à vie ou peuvent être interrompues après une durée à préciser.15 En effet, la rechute à l’arrêt de la biothérapie semble moins fréquente si la durée de traitement est prolongée.22
Un autre élément crucial est, sans doute, le délai d’instauration de ces thérapeutiques, en particulier avant l’installation du remodelage tissulaire. Obtenue précocement par la mise en place rapide d’une biothérapie adaptée à un asthme précisément phénotypé,23 la rémission de l’asthme, et donc l’interruption des processus physiopathologiques, pourrait modifier l’évolution à long terme de la pathologie, permettant alors une rémission complète. À ce titre, le dupilumab, seule biothérapie à bénéficier à l’heure actuelle d’une autorisation de mise sur le marché (AMM) chez le nourrisson (dans l’indication dermatite atopique), a permis de réduire l’apparition attendue de nouvelles pathologies atopiques, ouvrant la voie à une possible modification de la marche atopique.24
Rémission durable possible pour certains phénotypes
Les études à long terme ont révélé différentes trajectoires évolutives de l’asthme depuis la petite enfance jusqu’à l’âge adulte.
L’association entre la sévérité de l’asthme, la sensibilisation allergique et le risque de persistance de l’asthme est bien établie.
À l’inverse, un asthme intermittent ou léger, à facteurs déclenchants infectieux, avec une fonction respiratoire conservée, sans sensibilisation allergique ni environnement défavorable, a significativement plus de chances d’entrer en rémission au cours de l’enfance ou de l’adolescence. Ces trajectoires temporelles pourraient refléter différents endophénotypes, comme le démontrent les différences dans les facteurs de risque associés.9
La persistance de l’inflammation et de l’hyper-réactivité bronchique, voire le remodelage des voies respiratoires, rend la rémission spontanée de l’asthme fragile et parfois transitoire.
Néanmoins, les biothérapies et la personnalisation du traitement en fonction du phénotype ont permis des avancées majeures, ouvrant la voie à une rémission durable pour certains patients, sous réserve d’un phénotypage précis de l’asthme.
2. Lugogo NL, Mohan A, Akuthota P, et al. Are we ready for asthma remission as a clinical outcome? CHEST 2023;164(4):831–4.
3. Martinez FD, Wright AL, Taussig LM, et al. Asthma and wheezing in the first six years of life. N Engl J Med 1995;332(3):133–8.
4. Tai A, Tran H, Roberts M, et al. Outcomes of childhood asthma to the age of 50 years. J Allergy Clin Immunol 2014;133(6):1572-8.e3.
5. Phelan PD, Robertson CF, Olinsky A. The Melbourne Asthma Study: 1964-1999. J Allergy Clin Immunol 2002;109(2):189–94.
6. Henderson J, Granell R, Heron J, et al. Associations of wheezing phenotypes in the first 6 years of life with atopy, lung function and airway responsiveness in mid-childhood. Thorax 2008 ;63(11):974–80.
7. Just J, Bourgoin‐Heck M, Amat F. Clinical phenotypes in asthma during childhood. Clin Experimental Allergy 2017;47(7):848–55.
8. Spycher BD, Silverman M, Pescatore AM, et al. Comparison of phenotypes of childhood wheeze and cough in 2 independent cohorts. J Allergy Clin Immunol 2013;132(5):1058–67.
9. Bisgaard H, Bønnelykke K. Long-term studies of the natural history of asthma in childhood. J Allergy Clin Immunol 2010;126(2):187–97; quiz 198–9.
10. Covar RA, Strunk R, Zeiger RS, et al. Predictors of remitting, periodic, and persistent childhood asthma. J Allergy Clin Immunol 2010;125(2):359-66.e3.
11. Bush A. COPD: A pediatric disease. COPD . 2008;5(1):53–67.
12. Vonk JM. Childhood factors associated with asthma remission after 30 year follow up. Thorax 2004 ;59(11):925–9.
13. Sears MR, Greene JM, Willan AR, et al. A longitudinal, population-based, cohort study of childhood asthma followed to adulthood. N Engl J Med 2003 9;349(15):1414–22.
14. Strachan DP, Butland BK, Anderson HR. Incidence and prognosis of asthma and wheezing illness from early childhood to age 33 in a national British cohort. BMJ 1996 ;312(7040):1195–9.
15. Fuchs O, Bahmer T, Rabe KF, et al. Asthma transition from childhood into adulthood. The Lancet Respiratory Medicine 2017;5(3):224–34.
16. Håland G, Carlsen KCL, Sandvik L, et al. Reduced lung function at birth and the risk of asthma at 10 years of age. N Engl J Med 2006 ;355(16):1682–9.
17. Young S, Arnott J, O’Keeffe P,et al. The association between early life lung function and wheezing during the first 2 years of life. Eur Respir J 2000 1;15(1):151–7.
18. Izadi N, Baraghoshi D, Curran-Everett D, et al. Factors associated with persistence of severe asthma from late adolescence to early adulthood. Am J Respir Crit Care Med 2021 ;204(7):776–87.
19. Blaiss M, Oppenheimer J, Corbett M, et al. Consensus of an American College of Allergy, Asthma, and Immunology, American Academy of Allergy, Asthma, and Immunology, and American Thoracic Society workgroup on definition of clinical remission in asthma on treatment. Annals of Allergy, Asthma & Immunology 2023;131(6):782–5.
20. Upham JW, Le Lievre C, Jackson DJ, et al. Defining a severe asthma super-responder: Findings from a delphi process. J Allergy Clin Immunol: In Practice 2021;9(11):3997–4004.
21. Bacharier LB, Maspero JF, Katelaris CH, et al. Dupilumab in children with uncontrolled moderate-to-severe asthma. N Engl J Med 2021;385(24):2230–40.
22. Deschildre A, Roussel J, Drumez E, et al. Omalizumab discontinuation in children with severe allergic asthma: An observational real-life study. Allergy 2019;74(5):999–1003.
23. Lommatzsch M. Remission in asthma. Current Opinion in Pulmonary Medicine 2024;30(3):325–9.
24. Geba GP, Li D, Xu M, et al. Attenuating the atopic march: Meta-analysis of the dupilumab atopic dermatitis database for incident allergic events. J Allergy Clin Immunol 2023;151(3):756–66.