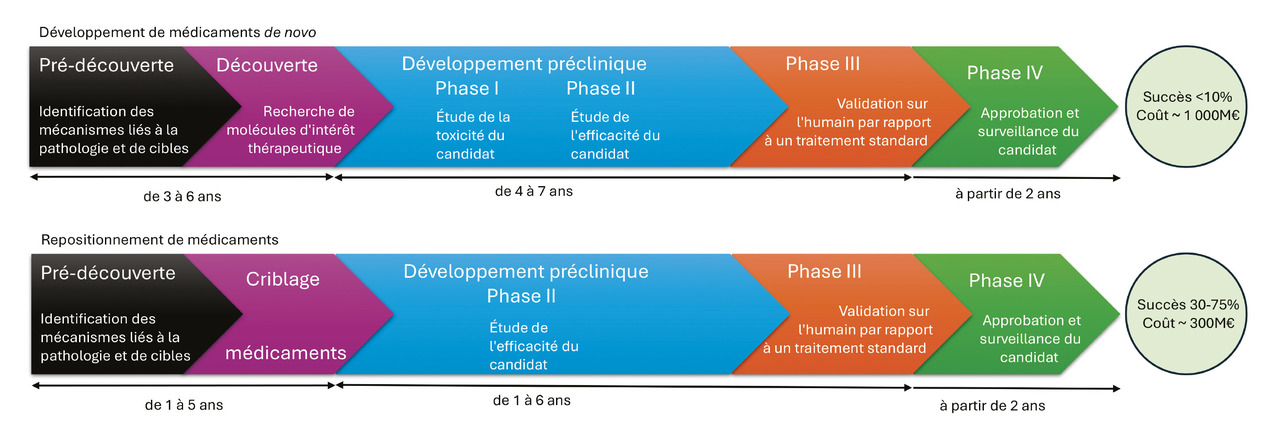
Réunir les prérequis pour obtenir une autorisation de mise sur le marché de nouveaux agents thérapeutiques est un processus de plus en plus coûteux et long. Ce coût croissant impose des pressions significatives sur les patients, les systèmes de santé et l’industrie pharmaceutique. La découverte de nouveaux médicaments, de la recherche à leur commercialisation, suit généralement cinq étapes principales :
- une phase de prédécouverte au cours de laquelle des recherches fondamentales sont effectuées pour comprendre les mécanismes à l’origine des pathologies et proposer des cibles et des voies thérapeutiques possibles ;
- pendant la phase de découverte de médicaments, les scientifiques recherchent des molécules (petites molécules chimiques ou produits biologiques) qui interfèrent ou guérissent la pathologie étudiée ou, du moins, en atténuent les symptômes ;
- puis les phases de développement préclinique se concentrent sur la clarification du mode d’action des médicaments à l’essai, l’étude de leur toxicité potentielle, la validation de leur efficacité sur divers modèles cellulaires ou animaux ;
- le stade clinique évalue le candidat-médicament chez l’homme ;
- enfin, pendant la phase de révision, d’approbation et de surveillance post-commercialisation, parfois appelée « phase IV », au cours de laquelle le médicament est approuvé ou non, sont identifiés de potentiels nouveaux effets indésirables et/ou interactions avec des médicaments et sont éventuellement modifiées les notices d’utilisation.1 D’après les dernières estimations, le coût de l’ensemble de ces étapes varie de 500 millions à 2 milliards d’euros, selon le domaine thérapeutique, avec des coûts moyens autour du milliard d’euros.2 De plus, le processus nécessite souvent de dix à quinze ans pour obtenir l’approbation réglementaire. Au cours du développement, environ 90 % des médicaments ne parviennent pas à obtenir l’approbation réglementaire, un échec pouvant survenir à chaque étape du processus.3,4 Les échecs résultent principalement de problèmes de toxicité et/ou d’une efficacité insuffisante.5 Compte tenu de la complexité et du coût des approches de découverte de médicaments de novo, d’autres stratégies sont explorées.
Qu’est-ce que le repositionnement de médicaments ?
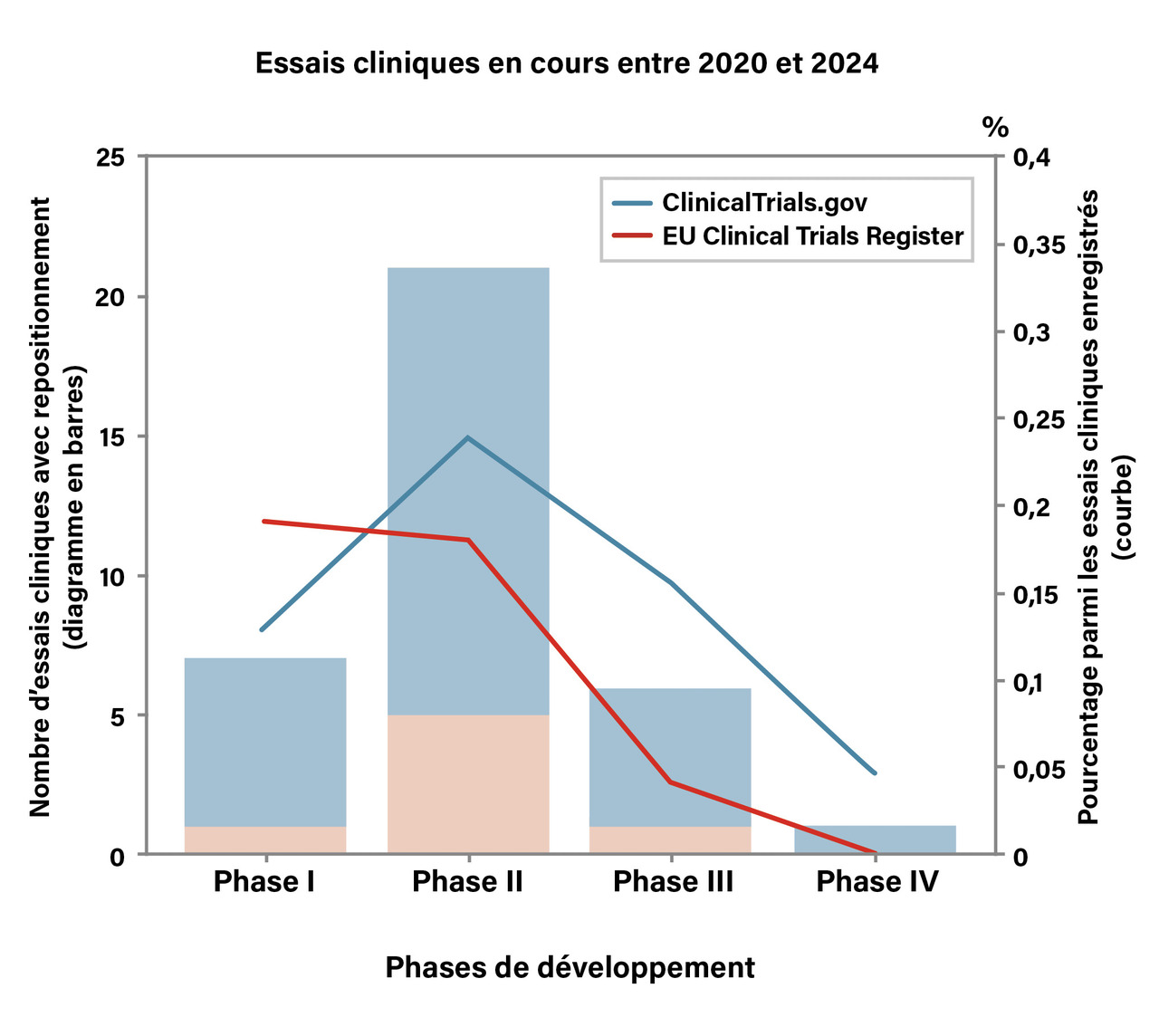
Il s’agit d’une stratégie qui consiste à utiliser un médicament déjà commercialisé ou dont le développement a été interrompu pour le traitement d’une maladie différente de l’indication d’origine. Cette démarche est motivée par l’observation empirique qu’un grand nombre de facteurs causaux peuvent être communs à plusieurs pathologies et que beaucoup de médicaments ont des effets multiples et peuvent agir sur plusieurs cibles ou voies moléculaires différentes. Le terme de repositionnement peut être utilisé strictement, en se limitant aux médicaments autorisés sur le marché actuellement ou historiquement, mais peut aussi être plus largement appliqué et inclure le « sauvetage » de composés qui ont été testés en phase préclinique ou clinique, puis abandonnés sans avoir été mis sur le marché. Ces efforts de repositionnement semblent avoir été significativement encouragés lors de la pandémie de Covid- 19 : la proportion d’essais cliniques en cours comportant un repositionnement de médicaments a doublé entre la période 2016 - 2019 et 2020 - 2024, passant de 0,08 à 0,16 % des essais cliniques enregistrés dans la même période.6 En décomposant selon les phases de développement (fig. 1), on observe que la plus grande proportion d’essais cliniques incluant un repositionnement est en phase II. Toutefois, pour l’instant, peu des médicaments repositionnés par des approches d’apprentissage automatique ou une autre stratégie ont abouti à une mise sur le marché. Seul un petit nombre d’essais cliniques enregistrés porte sur des médicaments issus de repositionnement. Ainsi, parmi les 8 838 essais de phase II en cours entre 2020 et 2024 rapportés dans la base de données ClinicalTrials.gov, seule une vingtaine porte sur des médicaments repositionnés (fig. 1).
Quels sont les avantages du repositionnement ?
L’approbation réglementaire du médicament repositionné pour une nouvelle indication est plus rapide, car elle s’appuie sur les informations précliniques et cliniques préexistantes (tableau, fig. 2).7 En effet, la nature du principe actif candidat ainsi que les données de sécurité associées, telles que les niveaux de dose et les informations sur l’exposition à la molécule, sont au moins en partie déjà disponibles. Théoriquement, cela permet de réduire les coûts de développement (par exemple, pour tester la formulation chimique et les conditions d’administration du médicament), d’augmenter les taux d’approbation en diminuant les causes d’échec les plus fréquentes (effets secondaires indésirables, manque d’efficacité), tout en maximisant l’utilité clinique de la molécule repositionnée.
Quels sont les défis à relever ?
Malgré ces avantages, le repositionnement fait face à plusieurs défis (tableau). Par exemple, il n’y a pas de possibilité d’optimisation de la molécule thérapeutique sans perdre les avantages du repositionnement, car toute modification de la structure de l’agent thérapeutique implique une nouvelle validation complète du processus de fabrication, de la formulation chimique, ainsi que des phases de développement préclinique.
Un autre problème porte sur l’identification d’une posologie et/ou d’une formulation optimale pour la nouvelle indication, qui peut également prendre du temps et nécessiter de nouvelles investigations. En effet, des effets secondaires peuvent survenir en raison de la présence de la pathologie pour laquelle on veut fournir un nouveau traitement, ou dans les cas où les doses d’administration doivent être modifiées.
Enfin, le défi de l’investissement nécessaire pour la mise sur le marché avec la nouvelle indication dépend du statut et du périmètre de la propriété intellectuelle de la molécule repositionnée. Des réflexions sont en cours pour adapter le cadre réglementaire actuel et mettre en place des mesures d’incitation visant à promouvoir le repositionnement de médicaments, notamment pour les maladies orphelines.8 Si les sociétés pharmaceutiques trouvent un intérêt commercial à poursuivre le développement pour réutiliser des médicaments encore brevetés, elles sont moins engagées pour le développement de médicaments dont le brevet n’est plus disponible. Les établissements académiques disposés à prendre le relais pour conduire les essais pour des médicaments repositionnés sont pour l’instant confrontés à des difficultés réglementaires et financières.9
Quelques exemples de repositionnement
La majorité des médicaments repositionnés aujourd’hui sur le marché sont issus de découvertes secondaires souvent fortuites d’effets non ciblés ou d’actions initialement non connues de médicaments existants. Par exemple, le thalidomide, initialement utilisé contre les nausées matinales au cours de la grossesse, a des applications pour le traitement du myélome multiple. Le sildénafil, développé à l’origine pour l’angine de poitrine, a été repositionné pour le traitement de la dysfonction érectile.
Encouragées par ces succès, des stratégies plus rationnelles d’identification d’effet hors cible par des criblages expérimentaux et/ou in silico (NDLR : recherche effectuée au moyen de modèles informatiques) ont été développées. Par exemple, l’imatinib, un inhibiteur de tyrosine kinase ABL initialement développé contre la leucémie myéloïde chronique, a été priorisé pour son rôle d’inhibiteur de SARS-CoV- 2 par une stratégie de criblage à haut débit de médicaments sur des modèles organoïdes pulmonaires et de côlon.10 Les mécanismes d’inhibition de SARS-CoV- 2 ont été confirmés in vitro et correspondent à un effet de la molécule sur une autre cible (« off-target ») que les tyrosines kinases ABL1 et ABL2. Cependant, les essais cliniques aboutissent aujourd’hui à des conclusions plus mitigées sur son efficacité comme traitement du Covid- 19.11
Tous les laboratoires ne s’investissent pas dans le repositionnement de médicaments. Toutefois, le nombre d’équipes académiques ou du secteur privé qui travaillent pour identifier des repositionnements pertinents s’est considérablement accru ces dix dernières années. Plusieurs start-up reposent sur ces approches.
Quelles sont les techniques actuelles ?
Il existe de nombreuses méthodes pour le repositionnement, incluant des approches expérimentales et in silico. Souvent, les méthodes de criblage filtrent ou classent les composés chimiques présents dans une librairie, annotés grâce à des tests expérimentaux antérieurs. Les informations sur les structures chimiques ou 3D permettent de modéliser les interactions moléculaires pour du criblage par amarrage (en anglais docking). D’autres annotations moléculaires proviennent de modèles in vitro (cellule), in vivo (animal) ou, plus rarement, d’études cliniques sur des patients. Parfois les méthodes de criblage exploitent l’état actuel des connaissances biologiques, par exemple sur les connexions entre les voies biologiques fonctionnelles (approches de réseaux) ; ou extraient automatiquement des connexions à partir de dossiers médicaux électroniques grâce aux entrepôts de données de santé (EDS) [analyses automatiques de données observationnelles]. Les critères de criblage peuvent également varier : pour un candidat-médicament, la méthode peut prédire directement une connexion avec une pathologie à partir d’exemples d’associations médicament-maladie,12,13 ou alors prédire une affinité d’interaction avec un site d’intérêt pour la pathologie.14,15
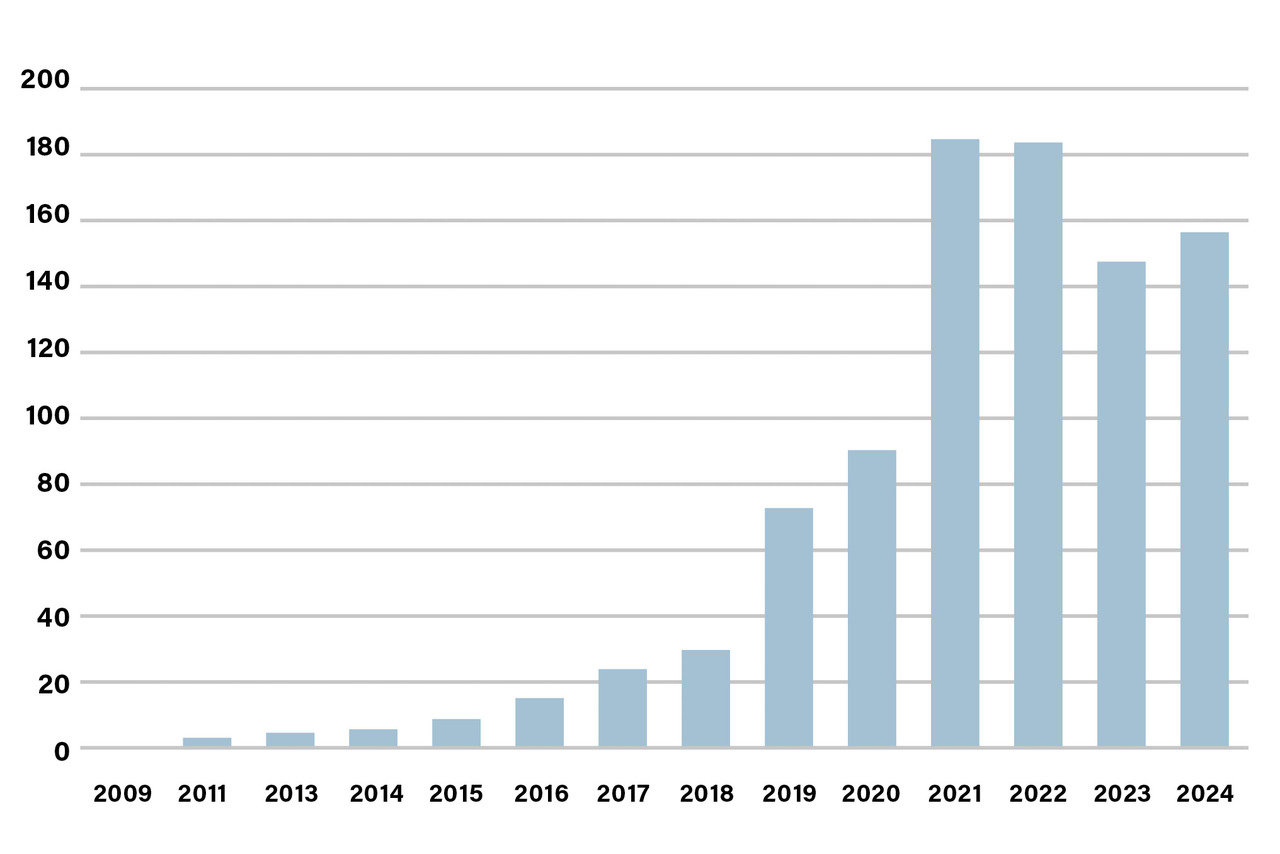
La place de l’intelligence artificielle (IA) ou de l’apprentissage machine (machine learning [ML]) dans le repositionnement est de plus en plus importante depuis 2018, avec un nombre exponentiel de publications PubMed mentionnant l’IA ou le ML dans leur titre ou résumé entre 2018 (30 études) et 2021 (184 articles, au pic de la pandémie Covid- 19), avec une stagnation aux alentours de 150 articles depuis 2021 (fig. 3). Cependant, l’évolution des méthodes d’IA, maintenant capable de créer de nouveaux contenus [IA générative] avec l’émergence récente des modèles de fondation qui permettent l’apprentissage par transfert ou diffusion) et d’approches fondées sur l’utilisation de large language models (LLM) comme GPT- 4 ou Llama- 3 offre de nouvelles perspectives au repositionnement de médicaments. Par exemple, l’ajout d’une approche d’IA générative dans Alphafold 3 permet non seulement de prédire la structure 3D de protéines à partir de leur séquence mais aussi celle de complexes protéiques avec d’autres molécules, élargissant ainsi le champ des possibles pour le criblage des médicaments existants.16
Perspectives
Dans l’ensemble, bien que le repositionnement de médicaments soit intuitivement attractif puisqu’il offre des voies plus courtes vers la clinique, les défis tout au long du processus sont considérables. Cependant, certains médicaments « partiellement repositionnés » peuvent aussi être considérés comme un point de départ pour le développement de nouveaux composés (analogues de deuxième génération) et donc accélérer et rendre plus efficace la phase de découverte. Il est également possible de combiner plusieurs médicaments approuvés pour augmenter l’efficacité du traitement thérapeutique. Le repositionnement est aussi une piste prometteuse pour une recherche de traitements plus durable, notamment pour les maladies rares ou des pathologies tropicales négligées (par exemple, le paludisme) pour lesquelles les fonds et/ou les données sont manquants.
2. Sertkaya A, Beleche T, Jessup A, et al. Costs of drug development and research and development intensity in the US, 2000-2018. JAMA Network Open 2024;7(6):e2415445.
3. Sun D, Gao W, Hu H, et al. Why 90% of clinical drug development fails and how to improve it? Acta Pharmaceutica Sinica B 2022;12(7):3049-62.
4. Burki T. A new paradigm for drug development. The Lancet Digital Health 2020;2(5):e226-e227.
5. Mouchlis VD, Afantitis A, Serra A, et al. Advances in de novo drug design: From conventional to machine learning methods. Int J Mol Sci 2021;22(4):1676.
6. ClinicalTrials.gov (https://www.clinicaltrials.gov/) et EU Clinical Trials Register (https://www.clinicaltrialsregister.eu/). Consultés le 23 septembre 2024.
7. Roessler HI, Knoers NV, van Haelst MM, et al. Drug repurposing for rare diseases. Trends Pharmacol Sci 2021;42(4):255-67.
8. Asker-Hagelberg C, Boran T, Bouygues C, et al. Repurposing of medicines in the EU: Launch of a pilot framework. Frontiers in Medicine 2022;8:817663.
9. Goossens H, Derde L, Horby P, et al. The European clinical research response to optimise treatment of patients with Covid-19: Lessons learned, future perspective, and recommendations. The Lancet Infectious Diseases 2022;22(5):e153-e158.
10. Han Y, Duan X, Yang L, et al. Identification of SARS-CoV-2 inhibitors using lung and colonic organoids. Nature 2021;589(7841):270-5.
11. Halme AL, Laakkonen S, Rutanen J, et al. Short-and long-term effects of imatinib in hospitalised Covid-19 patients: A randomised trial. J Infect 2024;89(3):106217.
12. Meng Y, Lu C, Jin M, et al. A weighted bilinear neural collaborative filtering approach for drug repositioning. Brief Bioinform 2022;23(2):bbab581.
13. Tanoli Z, Vähä-Koskela M, Aittokallio T. Artificial intelligence, machine learning, and drug repurposing in cancer. Expert Opin Drug Discov 2021;16(9):977-89.
14. Gong J, Ca C, Liu X, et al. ChemMapper: A versatile web server for exploring pharmacology and chemical structure association based on molecular 3D similarity method. Bioinform 2013;29(14):1827-9.
15. Shi XN, Li H, Yao H et al. Adapalene inhibits the activity of cyclin-dependent kinase 2 in colorectal carcinoma. Mol Med Rep 2015;12(5):6501-8.
16. Abramson, J., Adler, J., Dunger, J. et al. Accurate structure prediction of biomolecular interactions with AlphaFold 3. Nature 2024;630:493–500.