L’afflux de touristes internationaux ne cesse d’augmenter chaque année. En 2019, le nombre de voyages de la France vers l’étranger s’établissait à 53 millions, dont 6,3 millions vers l’Afrique, 3,6 millions vers l’Asie et l’Océanie et 2,3 millions vers l’Amérique.1 La mondialisation et les migrations humaines ont profondément contribué à l’émergence et à la diffusion des maladies infectieuses. Les épidémies de choléra et de méningite à méningocoques, par exemple, ont été associées à des voyageurs revenant de zones endémiques tout comme, depuis les deux dernières décennies, le risque de revenir colonisé ou infecté par une bactérie résistante aux antibiotiques.
Acquisition d’entérobactéries multirésistantes aux antibiotiques
Acquisition d’entérobactéries commensales
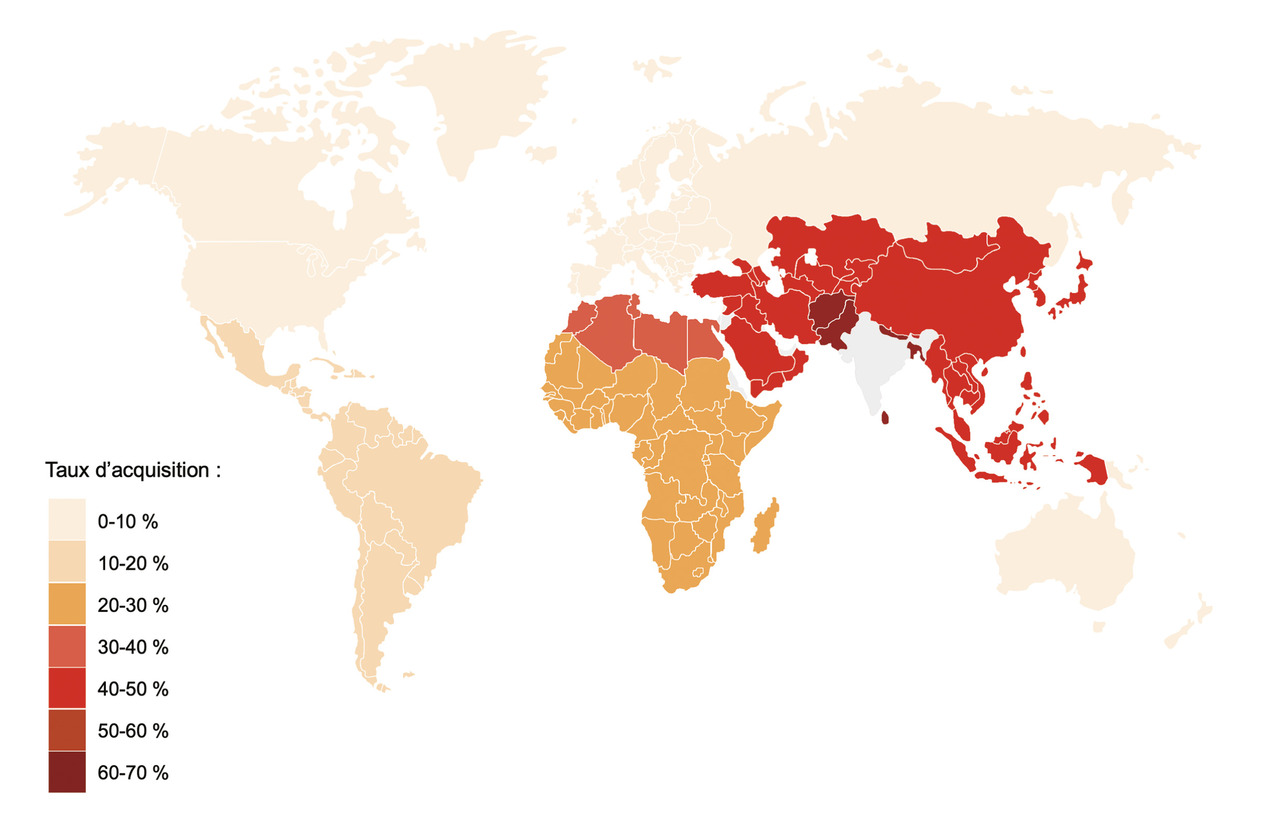
Dans les années 1990, Murray et al. décrivaient déjà l’acquisition d’Escherichia coli multirésistant chez des sujets sains et ne prenant pas d’antibiotique, après un voyage au Mexique.2 Mais la multirésistance de l’époque n’intéressait que peu la communauté scientifique, en raison du nombre d’antibiotiques qui restaient encore actifs. La pandémie d’entérobactéries productrices de bêtalactamases à spectre étendu (E-BLSE) puis celle d’entérobactéries productrices de carbapénémases (EPC) a changé la donne. En cas d’infection sévère, bien peu d’antibiotiques restent efficaces contre les E-BLSE et les EPC, regroupées sous le nom d’entérobactéries multirésistantes (EMR). La prévalence de portage d’E-BLSE est estimée à 14 % en moyenne dans le monde, avec de grandes disparités selon les régions variant de 5 % en Europe, 30 % autour du bassin méditerranéen et en Afrique à 70 % en Asie.3 Il est donc légitime d’imaginer qu’un individu voyageant d’une région à faible prévalence vers une région à prévalence élevée soit à risque d’acquérir une EMR. En 2010, une première étude montrait que 24 % des Suédois ayant voyagé à l’étranger avaient acquis une E-BLSE au cours de leur séjour, avec les taux d’acquisition les plus élevés observés chez les voyageurs revenant d’Inde (88 %) et d’Asie du Sud-Est (32 %).4 De nombreuses études ont été mises en place depuis et, même si les méthodes microbiologiques utilisées varient légèrement d’une étude à l’autre (type de milieu, enrichissement ou non, selle ou écouvillon rectal…), les observations sont assez concordantes. Une méta-analyse récente reprenant une vingtaine d’études datant de 2010 à 2019 confirme que les taux d’acquisition d’EMR les plus élevés sont observés après un séjour en Asie du Sud, avec des taux d’acquisition variant de 29 à 88 % (médiane 71 %), suivis par les séjours en Afrique du Nord (de 31 à 100 %, médiane à 42 %), dans le reste de l’Asie (de 17 à 87 %, médiane 36 %), en Afrique subsaharienne (de 0 à 58 %, médiane 21 %) et enfin en Amérique du Sud et centrale (de 0 à 33 %, médiane 12 %) [fig. 1 ].5 Il ne semble pas y avoir d’augmentation des taux d’acquisition au cours de ces dix années.
Escherichia coli est toujours l’espèce multirésistante la plus fréquemment identifiée au retour, représentant plus de 90 % des espèces isolées, loin devant Klebsiella pneumoniae ; le mécanisme associé à la multirésistance est très majoritairement la production de BLSE. Les rares études visant à rechercher l’acquisition d’EPC à l’aide d’un protocole spécifique ont permis d’observer que les taux d’acquisition restent globalement faibles (inférieurs à 1 %). Les EPC sont acquises, dans 75 % des cas, après un voyage en Asie, et les enzymes les plus fréquemment retrouvées sont NDM puis OXA-48.5 Si la dissémination communautaire des E-BLSE est maintenant bien décrite, celle des EPC, qui pourraient être la prochaine menace, est encore mal connue.
Plus récemment, la description, en Chine, du premier gène de résistance plasmidique à la colistine (mcr) a beaucoup inquiété la communauté scientifique. Plusieurs études ont donc investigué le risque d’acquisition, après un voyage, de bactéries résistantes à la colistine et porteuses du gène mcr. Les taux d’acquisition varient de 1 à 10 %, avec des méthodologies souvent très hétérogènes selon les études, les taux plus élevés étant observés après un séjour en Asie du Sud-Est.6
Escherichia coli est toujours l’espèce multirésistante la plus fréquemment identifiée au retour, représentant plus de 90 % des espèces isolées, loin devant Klebsiella pneumoniae ; le mécanisme associé à la multirésistance est très majoritairement la production de BLSE. Les rares études visant à rechercher l’acquisition d’EPC à l’aide d’un protocole spécifique ont permis d’observer que les taux d’acquisition restent globalement faibles (inférieurs à 1 %). Les EPC sont acquises, dans 75 % des cas, après un voyage en Asie, et les enzymes les plus fréquemment retrouvées sont NDM puis OXA-48.5 Si la dissémination communautaire des E-BLSE est maintenant bien décrite, celle des EPC, qui pourraient être la prochaine menace, est encore mal connue.
Plus récemment, la description, en Chine, du premier gène de résistance plasmidique à la colistine (mcr) a beaucoup inquiété la communauté scientifique. Plusieurs études ont donc investigué le risque d’acquisition, après un voyage, de bactéries résistantes à la colistine et porteuses du gène mcr. Les taux d’acquisition varient de 1 à 10 %, avec des méthodologies souvent très hétérogènes selon les études, les taux plus élevés étant observés après un séjour en Asie du Sud-Est.6
Facteurs de risque d’acquisition des EMR
La dernière méta-analyse parue montre que le principal facteur d’acquisition reste la région visitée avec un risque majeur après un séjour en Asie du Sud (odds ratio [OR] = 14,1). Les deux autres facteurs de risque sont directement liés à des altérations du microbiote intestinal, favorisant l’implantation de bactéries exogènes. Le premier est l’apparition d’une diarrhée ou de troubles gastro-intestinaux pendant le voyage (OR = 2) ; le second est la prise d’antibiotiques pendant le voyage (OR = 2,8) qui, outre une altération du microbiote, entraîne une sélection des EMR au sein du microbiote intestinal.5 Comparées aux autres classes d’antibiotiques, les fluoroquinolones sont associées au risque le plus élevé d’acquisition d’E-BLSE (OR = 4,7).7
D’autres facteurs de risque ont été retrouvés, de façon inconstante selon les études, comme la durée et le type de voyage (avec un voyage « sac à dos » considéré comme plus à risque), le type de nourriture consommée pendant le voyage ainsi que le fait d’être de sexe masculin et d’avoir un âge élevé.
Quelques facteurs protecteurs ont également été relevés, comme le fait de se laver les mains avant un repas.5
D’autres facteurs de risque ont été retrouvés, de façon inconstante selon les études, comme la durée et le type de voyage (avec un voyage « sac à dos » considéré comme plus à risque), le type de nourriture consommée pendant le voyage ainsi que le fait d’être de sexe masculin et d’avoir un âge élevé.
Quelques facteurs protecteurs ont également été relevés, comme le fait de se laver les mains avant un repas.5
Délai d’acquisition, durée de portage et infections au retour
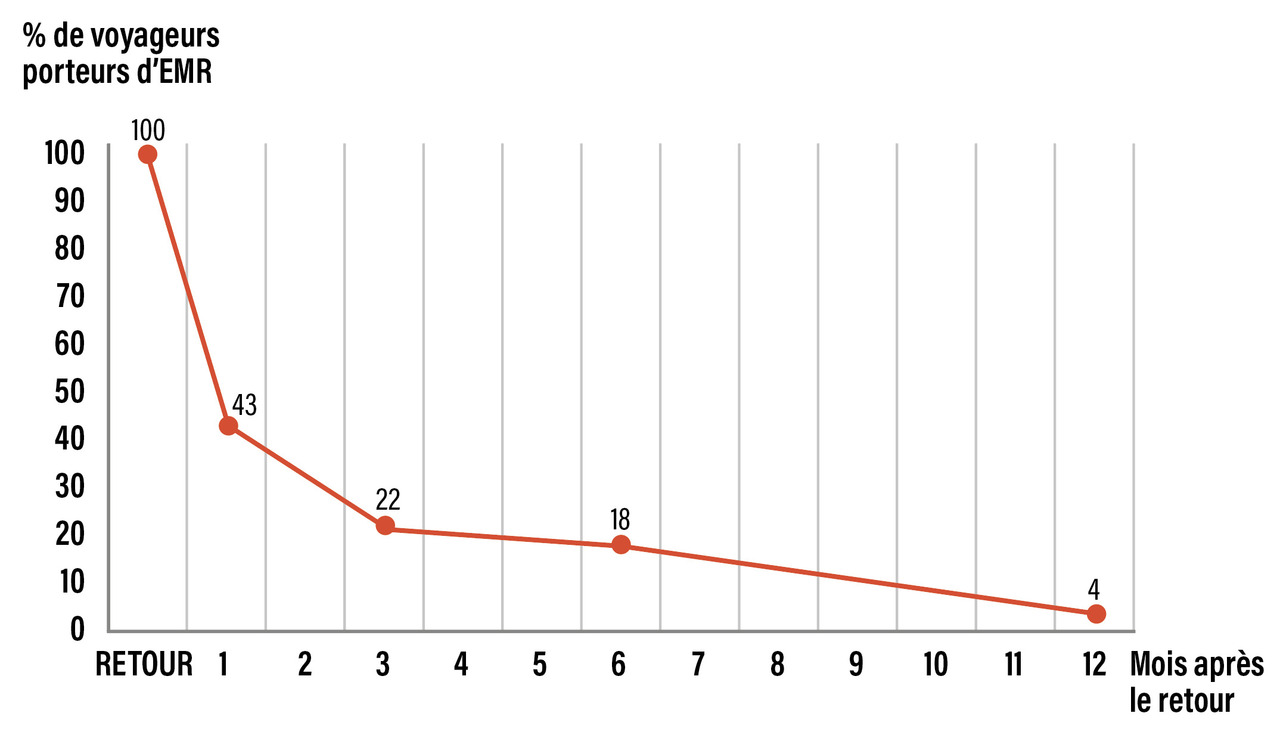
Une étude visant à étudier la dynamique d’acquisition d’EMR au cours du voyage montre que celle-ci a lieu en moyenne la première semaine du séjour, les taux de colonisation atteignant ensuite un plateau.8 Le pourcentage médian de voyageurs encore porteurs d’EMR un, trois, six et douze mois après leur retour est respectivement de 43 %, 22 %, 18 % et 4 %. (fig. 2 ).5
Une étude française montre que, trois mois après le retour d’un voyage en zone tropicale, la prévalence de portage au sein de la population des voyageurs est évaluée autour de 5 %, soit celle de la population générale.9 La persistance de portage pendant plus de trois mois peut être due à l’acquisition de souches d’E. coli possédant des facteurs génétiques leur conférant un avantage pour coloniser le microbiote.10 S’il est bien connu qu’un voyage à l’étranger est un facteur de risque d’infection, essentiellement urinaire à E-BLSE, l’incidence de telles infections au retour d’un voyage n’a jamais pu être déterminée de façon précise en raison du faible nombre de participants inclus pour mesurer ce paramètre.
Une étude française montre que, trois mois après le retour d’un voyage en zone tropicale, la prévalence de portage au sein de la population des voyageurs est évaluée autour de 5 %, soit celle de la population générale.9 La persistance de portage pendant plus de trois mois peut être due à l’acquisition de souches d’E. coli possédant des facteurs génétiques leur conférant un avantage pour coloniser le microbiote.10 S’il est bien connu qu’un voyage à l’étranger est un facteur de risque d’infection, essentiellement urinaire à E-BLSE, l’incidence de telles infections au retour d’un voyage n’a jamais pu être déterminée de façon précise en raison du faible nombre de participants inclus pour mesurer ce paramètre.
Transmission à la famille et en milieu hospitalier au retour de voyage
De rares études ont investigué la transmission des EMR acquises du voyageur vers un autre membre du foyer ; elles ont estimé un taux de transmission de 9 à 12 %.5 Cependant, aucune étude n’a utilisé de méthode de typage suffisamment discriminante pour affirmer la transmission. Pour rechercher une colonisation par une bactérie hautement résistante aux antibiotiques (BHRe), les recommandations du Haut Conseil de la santé publique (HCSP) de 2019 proposent de dépister, lors de toute admission dans un établissement de santé, les patients ayant séjourné à l’étranger depuis moins de trois mois en fonction du pays visité, et ce afin d’éviter une circulation de ces bactéries au sein des établissements hospitaliers (tableau ).11
Types d’infection à bactéries multirésistantes
Diarrhées infectieuses
Les maladies du péril fécal constituent le principal problème de santé chez les voyageurs pendant leur séjour comme au retour, avec au premier chef les diarrhées aiguës, qui touchent de 20 à 60 % des voyageurs selon les destinations. Outre le fait de constituer un facteur de risque d’acquisition d’EMR, ces épisodes diarrhéiques peuvent être la conséquence d’infections dues à des entérobactéries pathogènes de l’homme, comme les shigelles, les salmonelles ou différents pathotypes d’E. coli. Le Centre de référence britannique des entéropathogènes rapporte que les E. coli entéropathogènes, isolés de 275 prélèvements recueillis entre 2015 et 2017 dans les sept jours suivant un voyage à l’étranger, sont, pour 48 % d’entre eux, producteurs de BLSE et présentent dans 53 % des cas une diminution de sensibilité aux fluoroquinolones, pourcentages s’élevant respectivement à 64 % et 66 % pour les souches entéro-agrégatives (EAEC). Parmi ces dernières, deux souches, isolées au retour d’un séjour au Pakistan, sont également productrices de la carbapénémase OXA-181.12
Les shigelloses, dues en particulier à Shigella sonnei ou flexneri, prévalentes sur l’ensemble du globe, sont responsables de syndromes dysentériques potentiellement sévères. Et l’émergence en Europe depuis 2015 de souches de Shigella sonnei extrêmement résistantes aux antibiotiques, dites XDR (productrices de BLSE et résistantes à la ciprofloxacine et à l’azithromycine), est à ce titre préoccupante. Ces souches, initialement originaires d’Asie du Sud-Est, ont diffusé par le biais des voyages et sont maintenant associées à une transmission autochtone et communautaire, en particulier au sein de la population homosexuelle masculine. Le Centre national de référence français rapporte que, parmi les 444 souches de Shigella sonnei analysées en 2021, 29 % sont résistantes aux céphalosporines de 3e génération (C3G), 42 % à la ciprofloxacine, 38 % à l’azithromycine et 22 % présentent le phénotype XDR.13
Les shigelloses, dues en particulier à Shigella sonnei ou flexneri, prévalentes sur l’ensemble du globe, sont responsables de syndromes dysentériques potentiellement sévères. Et l’émergence en Europe depuis 2015 de souches de Shigella sonnei extrêmement résistantes aux antibiotiques, dites XDR (productrices de BLSE et résistantes à la ciprofloxacine et à l’azithromycine), est à ce titre préoccupante. Ces souches, initialement originaires d’Asie du Sud-Est, ont diffusé par le biais des voyages et sont maintenant associées à une transmission autochtone et communautaire, en particulier au sein de la population homosexuelle masculine. Le Centre national de référence français rapporte que, parmi les 444 souches de Shigella sonnei analysées en 2021, 29 % sont résistantes aux céphalosporines de 3e génération (C3G), 42 % à la ciprofloxacine, 38 % à l’azithromycine et 22 % présentent le phénotype XDR.13
Fièvre typhoïde à Salmonella typhi XDR
Salmonella enterica sérovar typhi, responsable de la fièvre typhoïde, est très prévalente dans les pays à ressources limitées, en particulier en Asie du Sud, où elle est responsable d’une morbi-mortalité importante. Les souches de S. typhi ont acquis au cours des années une résistance croissante aux antibiotiques, les souches multirésistantes, c’est-à-dire résistantes aux antibiotiques de première ligne (ampicilline, chloramphénicol, cotrimoxazole), ont remplacé progressivement les souches sensibles, puis sont devenues dans certaines régions, comme l’Asie du Sud et de l’Est, résistantes aux quinolones.14
En 2016, on a vu émerger dans la province de Sindh au Pakistan une souche clonale d’haplotype 58 XDR, résistante aux C3G (par présence d’une BLSE de type CTX-M-15) et aux fluoroquinolones, qui a donné lieu à des infections d’importation dans d’autres continents.14 Chez les voyageurs, les données de surveillance du réseau international GeoSentinel ont identifié, entre 2018 et 2021, 17 cas (dont 11 enfants) de fièvre typhoïde à Salmonella typhi XDR, toutes au retour du Pakistan, où les patients étaient allés rendre visite à leur famille, un seul ayant reçu le vaccin typhoïdique au préalable.15 Ces souches restent à ce jour sensibles à l’azithromycine, dernier antibiotique oral disponible, bien que des résistances à cet antibiotique aient été décrites dès 2013 au Bangladesh, indépendamment du profil XDR.14
En 2016, on a vu émerger dans la province de Sindh au Pakistan une souche clonale d’haplotype 58 XDR, résistante aux C3G (par présence d’une BLSE de type CTX-M-15) et aux fluoroquinolones, qui a donné lieu à des infections d’importation dans d’autres continents.14 Chez les voyageurs, les données de surveillance du réseau international GeoSentinel ont identifié, entre 2018 et 2021, 17 cas (dont 11 enfants) de fièvre typhoïde à Salmonella typhi XDR, toutes au retour du Pakistan, où les patients étaient allés rendre visite à leur famille, un seul ayant reçu le vaccin typhoïdique au préalable.15 Ces souches restent à ce jour sensibles à l’azithromycine, dernier antibiotique oral disponible, bien que des résistances à cet antibiotique aient été décrites dès 2013 au Bangladesh, indépendamment du profil XDR.14
Infections sexuellement transmissibles
Si l’on excepte les shigelloses, qui constituent une infection sexuellement transmissible (IST) pour les hommes ayant des relations sexuelles avec des hommes (HSH), la principale préoccupation concerne Neisseria gonorrhoeae, dont les souches résistantes peuvent être acquises à l’occasion d’un voyage, notamment en Asie ou dans certains pays d’Europe, les comportements des voyageurs étant propices à l’acquisition de telles bactéries.16 Au cours du temps, des résistances à tous les traitements de première ligne ont été observées. En 2015, un clone résistant à la ceftriaxone, dénommé FC428, a émergé en Asie du Sud-Est et s’est diffusé dans plusieurs autres pays. Les souches de ce clone restaient sensibles à l’azithromycine. Mais, en 2018, plusieurs souches résistantes à la ceftriaxone et à l’azithromycine, non reliées génétiquement, ont été décrites, certaines ayant été acquises en Asie du Sud-Est.17 En 2018, le pourcentage de résistance des souches de gonocoque isolées en Europe était respectivement de 51,3 %, 8 %, et 0,04 % pour la ciprofloxacine, l’azithromycine, et la ceftriaxone, avec de grandes disparités entre les pays.16
Infections cutanées à Staphylococcus aureus résistant à la méticilline
Dans les années 2000, aux États-Unis, des souches clonales de Staphylococcus aureus résistants à la méticilline (Sarm), hypervirulentes en raison, entre autres, de la production de la leucocidine de Panton-Valentine (PVL) se sont rapidement propagées et ont été responsables de nombreuses épidémies, particulièrement au sein de communautés fermées comme les établissements carcéraux.18
Une étude, menée entre 2011 et 2016 chez 564 voyageurs européens revenant de voyage avec une infection de la peau et des tissus mous, montre que dans 67 % des cas les lésions sont dues à S. aureus, dont 14 % sont des Sarm. Parmi ces derniers, 84 % sont sécréteurs de la PVL et un tiers appartiennent à un des clones pandémiques majeurs, dont la souche USA300. La prévalence de la résistance à la méticilline varie selon la région visitée, plus élevée au retour d’Amérique latine (28 %) et d’Asie du Sud et du Sud-Est (15 %) qu’au retour d’Afrique subsaharienne (4 %). Un peu plus de la moitié des Sarm sont corésistants à au moins un agent oral de deuxième ligne (cotrimoxazole, ciprofloxacine, tétracycline, clindamycine et érythromycine). Une transmission secondaire dans l’entourage est suspectée dans près d’un tiers des cas.19 Une étude récente, menée entre 2018 et 2019 dans un service de médecine des voyages de Berlin, visant à étudier l’acquisition d’une colonisation nasale à Sarm chez 196 voyageurs en bonne santé, n’a pu identifier qu’un seul porteur au retour.20
Une étude, menée entre 2011 et 2016 chez 564 voyageurs européens revenant de voyage avec une infection de la peau et des tissus mous, montre que dans 67 % des cas les lésions sont dues à S. aureus, dont 14 % sont des Sarm. Parmi ces derniers, 84 % sont sécréteurs de la PVL et un tiers appartiennent à un des clones pandémiques majeurs, dont la souche USA300. La prévalence de la résistance à la méticilline varie selon la région visitée, plus élevée au retour d’Amérique latine (28 %) et d’Asie du Sud et du Sud-Est (15 %) qu’au retour d’Afrique subsaharienne (4 %). Un peu plus de la moitié des Sarm sont corésistants à au moins un agent oral de deuxième ligne (cotrimoxazole, ciprofloxacine, tétracycline, clindamycine et érythromycine). Une transmission secondaire dans l’entourage est suspectée dans près d’un tiers des cas.19 Une étude récente, menée entre 2018 et 2019 dans un service de médecine des voyages de Berlin, visant à étudier l’acquisition d’une colonisation nasale à Sarm chez 196 voyageurs en bonne santé, n’a pu identifier qu’un seul porteur au retour.20
Conseils aux voyageurs : prévention de l’acquisition, dépistage au retour
Les voyages à destination des pays du Sud, dont les zones touristiques majeures sont également des zones de forte prévalence pour la résistance aux antibiotiques, constituent à la fois un risque individuel pour les voyageurs et un risque collectif en favorisant leur dissémination à travers le monde. Les voyageurs doivent donc être informés de ce risque et suivre des conseils d’hygiène, mais aussi limiter au minimum l’utilisation d’antibiotiques pendant leur voyage et informer de leur séjour à leur retour en cas d’infection, pour adapter le cas échéant un traitement antibiotique présomptif, ou en cas d’hospitalisation pour dépister tout portage de BHRe (tableau ).21
Références
1. Enquête mobilité des personnes 2018-2019. Comment les Français voyagent-ils en 2019 ? Site du ministère de la Transition écologique et de la Cohésion des territoires. 17 septembre 2021. https://vu.fr/ISIYT
2. Murray BE, Mathewson JJ, DuPont HL, Ericsson CD, Reves RR. Emergence of resistant fecal Escherichia coli in travelers not taking prophylactic antimicrobial agents. Antimicrob Agents Chemother 1990;34(4):515‑8.
3. Woerther PL, Burdet C, Chachaty E, Andremont A. Trends in human fecal carriage of extended-spectrum β-lactamases in the community: Toward the globalization of CTX-M. Clin Microbiol Rev 2013;26(4):744‑58.
4. Tängdén T, Cars O, Melhus A, Löwdin E. Foreign travel is a major risk factor for colonization with Escherichia coli producing CTX-M-type extended-spectrum beta-lactamases: A prospective study with Swedish volunteers. Antimicrob Agents Chemother 2010;54(9):3564‑8.
5. Voor In ’t Holt AF, Mourik K, Beishuizen B, van der Schoor AS, Verbon A, Vos MC, et al. Acquisition of multidrug-resistant Enterobacterales during international travel: A systematic review of clinical and microbiological characteristics and meta-analyses of risk factors. Antimicrob Resist Infect Control 2020;9(1):71.
6. Rondinaud E, Clermont O, Petitjean M, Ruppe E, Esposito-Farèse M, Nazimoudine A, et al. Acquisition of Enterobacterales carrying the colistin resistance gene mcr following travel to the tropics. J Travel Med 2022;taac141.
7. Wuerz TC, Kassim SS, Atkins KE. Acquisition of extended-spectrum beta-lactamase-producing Enterobacteriaceae (ESBL-PE) carriage after exposure to systemic antimicrobials during travel: Systematic review and meta-analysis. Travel Med Infect Dis 2020;37:101823.
8. Schaumburg F, Sertic SM, Correa-Martinez C, Mellmann A, Köck R, Becker K. Acquisition and colonization dynamics of antimicrobial-resistant bacteria during international travel: A prospective cohort study. Clin Microbiol Infect 2019;25(10):1287.e1-.e7.
9. Ruppe E, Armand-Lefèvre L, Estellat C, Consigny PH, El Mniai A, Boussadia Y, et al. High rate of acquisition but short duration of carriage of multidrug-resistant enterobacteriaceae after travel to the tropics. Clin Infect Dis 2015;61(4):593‑600.
10. Armand-Lefevre L, Rondinaud E, Desvillechabrol D, Mullaert J, Clermont O, Petitjean M, et al. Dynamics of extended-spectrum beta-lactamase-producing Enterobacterales colonization in long-term carriers following travel abroad. Microb Genom 2021;7(7):000576.
11. Haut Conseil de la santé publique. Actualisation des recommandations relatives à la maîtrise de la diffusion des bactéries hautement résistantes aux antibiotiques émergentes (BHRe). Décembre 2019. https://vu.fr/YWhOB
12. Boxall MD, Day MR, Greig DR, Jenkins C. Antimicrobial resistance profiles of diarrhoeagenic Escherichia coli isolated from travellers returning to the UK, 2015-2017. J Med Microbiol 2020;69(7):932‑43.
13. Lefèvre S, Njamkepo E, Feldman S, Ruckly C, Carle I, Lejay-Collin M, et al. Rapid emergence of extensively drug-resistant Shigella sonnei in France. Nat Commun 2023;14(1):462.
14. da Silva KE, Tanmoy AM, Pragasam AK, Iqbal J, Sajib MSI, Mutreja A, et al. The international and intercontinental spread and expansion of antimicrobial-resistant Salmonella Typhi: A genomic epidemiology study. Lancet Microbe 2022;3(8):e567‑77.
15. Posen HJ, Wong W, Farrar DS, Campigotto A, Chan T, Barker KR, et al. Travel associated extensively drug resistant typhoid fever: A case series to inform management in non-endemic regions. J Travel Med 2022;taac086.
16. Vicente de la Cruz M de LM, Giesen C, Díaz-Menéndez M. International travels and transmission of multidrug resistant Neisseria gonorrhoeae in Europe: A systematic review. Travel Med Infect Dis 2022;49:102401.
17. Tien V, Punjabi C, Holubar MK. Antimicrobial resistance in sexually transmitted infections. J Travel Med 2020;27(1):taz101.
18. Frost I, Van Boeckel TP, Pires J, Craig J, Laxminarayan R. Global geographic trends in antimicrobial resistance: The role of international travel. J Travel Med 2019;26(8):taz036.
19. Nurjadi D, Fleck R, Lindner A, Schäfer J, Gertler M, Mueller A, et al. Import of community-associated, methicillin-resistant Staphylococcus aureus to Europe through skin and soft-tissue infection in intercontinental travellers, 2011-2016. Clin Microbiol Infect 2019;25(6):739‑46.
20. Tran DT, Winter D, Christner M, Ramharter M, Addo MM, Rolling T, et al. Less than you’d think-a prospective study on MRSA-colonization in healthy travellers. J Travel Med 2021;28(3):taaa242.
21. Haut Conseil de la santé publique. Recommandations sanitaires pour les voyageurs 2024. https://vu.fr/rJJTI
2. Murray BE, Mathewson JJ, DuPont HL, Ericsson CD, Reves RR. Emergence of resistant fecal Escherichia coli in travelers not taking prophylactic antimicrobial agents. Antimicrob Agents Chemother 1990;34(4):515‑8.
3. Woerther PL, Burdet C, Chachaty E, Andremont A. Trends in human fecal carriage of extended-spectrum β-lactamases in the community: Toward the globalization of CTX-M. Clin Microbiol Rev 2013;26(4):744‑58.
4. Tängdén T, Cars O, Melhus A, Löwdin E. Foreign travel is a major risk factor for colonization with Escherichia coli producing CTX-M-type extended-spectrum beta-lactamases: A prospective study with Swedish volunteers. Antimicrob Agents Chemother 2010;54(9):3564‑8.
5. Voor In ’t Holt AF, Mourik K, Beishuizen B, van der Schoor AS, Verbon A, Vos MC, et al. Acquisition of multidrug-resistant Enterobacterales during international travel: A systematic review of clinical and microbiological characteristics and meta-analyses of risk factors. Antimicrob Resist Infect Control 2020;9(1):71.
6. Rondinaud E, Clermont O, Petitjean M, Ruppe E, Esposito-Farèse M, Nazimoudine A, et al. Acquisition of Enterobacterales carrying the colistin resistance gene mcr following travel to the tropics. J Travel Med 2022;taac141.
7. Wuerz TC, Kassim SS, Atkins KE. Acquisition of extended-spectrum beta-lactamase-producing Enterobacteriaceae (ESBL-PE) carriage after exposure to systemic antimicrobials during travel: Systematic review and meta-analysis. Travel Med Infect Dis 2020;37:101823.
8. Schaumburg F, Sertic SM, Correa-Martinez C, Mellmann A, Köck R, Becker K. Acquisition and colonization dynamics of antimicrobial-resistant bacteria during international travel: A prospective cohort study. Clin Microbiol Infect 2019;25(10):1287.e1-.e7.
9. Ruppe E, Armand-Lefèvre L, Estellat C, Consigny PH, El Mniai A, Boussadia Y, et al. High rate of acquisition but short duration of carriage of multidrug-resistant enterobacteriaceae after travel to the tropics. Clin Infect Dis 2015;61(4):593‑600.
10. Armand-Lefevre L, Rondinaud E, Desvillechabrol D, Mullaert J, Clermont O, Petitjean M, et al. Dynamics of extended-spectrum beta-lactamase-producing Enterobacterales colonization in long-term carriers following travel abroad. Microb Genom 2021;7(7):000576.
11. Haut Conseil de la santé publique. Actualisation des recommandations relatives à la maîtrise de la diffusion des bactéries hautement résistantes aux antibiotiques émergentes (BHRe). Décembre 2019. https://vu.fr/YWhOB
12. Boxall MD, Day MR, Greig DR, Jenkins C. Antimicrobial resistance profiles of diarrhoeagenic Escherichia coli isolated from travellers returning to the UK, 2015-2017. J Med Microbiol 2020;69(7):932‑43.
13. Lefèvre S, Njamkepo E, Feldman S, Ruckly C, Carle I, Lejay-Collin M, et al. Rapid emergence of extensively drug-resistant Shigella sonnei in France. Nat Commun 2023;14(1):462.
14. da Silva KE, Tanmoy AM, Pragasam AK, Iqbal J, Sajib MSI, Mutreja A, et al. The international and intercontinental spread and expansion of antimicrobial-resistant Salmonella Typhi: A genomic epidemiology study. Lancet Microbe 2022;3(8):e567‑77.
15. Posen HJ, Wong W, Farrar DS, Campigotto A, Chan T, Barker KR, et al. Travel associated extensively drug resistant typhoid fever: A case series to inform management in non-endemic regions. J Travel Med 2022;taac086.
16. Vicente de la Cruz M de LM, Giesen C, Díaz-Menéndez M. International travels and transmission of multidrug resistant Neisseria gonorrhoeae in Europe: A systematic review. Travel Med Infect Dis 2022;49:102401.
17. Tien V, Punjabi C, Holubar MK. Antimicrobial resistance in sexually transmitted infections. J Travel Med 2020;27(1):taz101.
18. Frost I, Van Boeckel TP, Pires J, Craig J, Laxminarayan R. Global geographic trends in antimicrobial resistance: The role of international travel. J Travel Med 2019;26(8):taz036.
19. Nurjadi D, Fleck R, Lindner A, Schäfer J, Gertler M, Mueller A, et al. Import of community-associated, methicillin-resistant Staphylococcus aureus to Europe through skin and soft-tissue infection in intercontinental travellers, 2011-2016. Clin Microbiol Infect 2019;25(6):739‑46.
20. Tran DT, Winter D, Christner M, Ramharter M, Addo MM, Rolling T, et al. Less than you’d think-a prospective study on MRSA-colonization in healthy travellers. J Travel Med 2021;28(3):taaa242.
21. Haut Conseil de la santé publique. Recommandations sanitaires pour les voyageurs 2024. https://vu.fr/rJJTI