L’apparition d’un ganglion pathologique ou d’une induration sous-cutanée palpable est un motif fréquent de consultation en médecine générale. Les caractéristiques morphologiques du(ou des) ganglion(s), leur nombre et le contexte de survenue (durée d’évolution, terrain, manifestations systémiques associées) doivent faire discuter la réalisation d’examens complémentaires afin de ne pas méconnaître une origine néoplasique ou infectieuse.
Une adénopathie est un ganglion lymphatique hypertrophié résultant d’une stimulation du tissu lymphoïde. Sa taille ou sa localisation peuvent le rendre pathologique. On parle d’adénopathie généralisée ou de polyadénopathie à partir de deux localisations anatomiques distinctes. On estime habituellement qu’un ganglion devient pathologique au-delà de 1 cm de diamètre, mais cela dépend de sa localisation et de l’âge du patient : certaines adénopathies peuvent être physiologiques jusqu’à 2 cm chez l’enfant ou le jeune adulte surtout dans la région inguinale, mais sont toujours préoccupantes au-delà de 2 cm.1 Un ganglion épitrochléen est, quant à lui, considéré pathologique au-delà de 0,5 cm de diamètre.2
Une échographie est parfois nécessaire pour préciser la nature de l’induration : les adénopathies peuvent être confondues avec d’autres entités comme un lipome, un nodule sous-cutané, un neurofibrome, une hypertrophie des glandes salivaires, un nodule thyroïdien, un kyste congénital, une hidrosadénite axillaire, une hernie inguinale ou une masse vasculaire (anévrisme, artère fémorale calcifiée).
Quelles causes ?
La présence d’une adénopathie superficielle est fréquente en contexte infectieux : ce symptôme souvent bénin et spontanément résolutif en quelques semaines ne donne pas toujours lieu à une consultation médicale. En revanche, la persistance d’une masse inexpliquée est un motif fréquent de consultation. Bien qu’il existe très peu de données épidémiologiques récentes, il semble qu’une tumeur maligne est à l’origine de moins de 5 % de l’ensemble des adénopathies superficielles de l’adulte.2
Certains auteurs proposent de classer les différentes causes d’adénopathies selon l’acronyme « MIAMI », pour malignes, infectieuses, auto-immunes et inflammatoires, diverses ou rares (miscellaneous ) et iatrogènes (tableau 1).2 On pourrait ajouter à cette liste non exhaustive les nombreuses causes réactionnelles non infectieuses au cours desquelles peut s’observer une hyperplasie lymphoïde transitoire en réaction à un traumatisme local (plaie, griffure), à une dermatose inflammatoire ou à une vaccination.3 D’autres cas d’adénopathies réactionnelles ont été rapportés à la suite de la migration de particules issues de corps étrangers, comme des prothèses articulaires, du talc présent dans certains médicaments ou le silicone des implants mammaires.4
Éléments d’orientation diagnostique
La durée d’évolution – parfois difficile à préciser – et l’évaluation globale du patient sont des éléments déterminants pour orienter l’enquête étiologique. Certains auteurs ont identifié des facteurs de risque de malignité, parmi lesquels l’âge supérieur à 40 ans, le sexe masculin et d’autres caractéristiques présentées dans le tableau 2.6 - 8
Historique et chronologie de symptômes
La première étape du diagnostic consiste à réaliser un historique précis de la chronologie des symptômes, en datant l’apparition de l’adénopathie lorsque cela est possible et en recherchant des signes généraux associés, ainsi qu’un contage ou un contact avec des animaux, notamment un chat.
Une adénopathie sus-claviculaire volumineuse d’apparition semi-récente chez un patient avec altération de l’état général est très suspecte de malignité.
Au contraire, l’apparition d’une polyadénopathie en moins de deux semaines chez un patient jeune est plutôt évocatrice d’un tableau infectieux. Une poly-adénopathie peut refléter une infection à EBV (surtout si les adénopathies sont cervicales et associées à un syndrome grippal), aux mycobactéries (surtout en cas de fistulisation), une primo-infection VIH, un lymphome (consistance ferme et indolore), un lupus systémique, une sarcoïdose ou une cause médicamenteuse (réaction d’hypersensibilité retardée 10 à 15 jours après la prise).
Une adénopathie persistant plus d’un an sans modification de taille a une faible probabilité d’être néoplasique, surtout en cas d’adénopathies bilatérales. Néanmoins, un lymphome non hodgkinien indolent ou une leucémie lymphoïde chronique restent possibles.
Les arthralgies inflammatoires et les éruptions cutanées doivent faire rechercher une origine auto-immune.
Rechercher la porte d’entrée dans le système lymphatique
Il faut ensuite rechercher des signes locaux évocateurs d’une porte d’entrée infectieuse, néoplasique ou traumatique dans le territoire de drainage lymphatique, réaliser un examen de l’état dentaire en cas d’adénopathie cervicale et une inspection du revêtement cutané, à la recherche d’un mélanome ; il convient d’évaluer, s’ils existent, les facteurs de risque d’infections sexuellement transmissibles en cas d’adénopathie inguinale.
Certaines complications locales peuvent suggérer une origine infectieuse ou néoplasique : ulcération, fistulisation, abcédation, compression vasculaire loco-régionale (syndrome cave supérieure en cas d’adénopathie sus-claviculaire, œdème du membre inférieur homolatéral en cas d’adénopathie inguinale).
Bilan complémentaire orienté par la clinique
La prescription d’examens complémentaires biologiques, morphologiques, voire histologiques, est orientée par les éléments cliniques et le terrain.
Examens biologiques en deux temps
En première intention, il faut rechercher une cytopénie, une lymphocytose ou une polynucléose neutrophile, un syndrome inflammatoire et une insuffisance rénale (utile en prévision d’un scanner avec injection de produit de contraste).
D’autres analyses peuvent être proposées en seconde intention, ou d’emblée en cas d’éléments d’orientation diagnostique (tableau 3). Le dosage des lactates déshydrogénases (LDH) a une bonne valeur prédictive négative. En revanche, un taux élevé ne reflète pas toujours une cause néoplasique. L’électrophorèse des protéines sériques permet de rechercher une maladie de Waldenström et, en cas d’hypo-albuminémie, apporte un critère de dénutrition et de retentissement.
Échographie en cas de doute, scanner à double intérêt
L’échographie est souvent réalisée en première intention car il s’agit d’un examen facile d’accès, non irradiant et à faible coût. Elle est surtout utile en cas de doute diagnostique (lipome, masse vasculaire) et permet de préciser la taille du ganglion. Cependant, le résultat est très dépendant de l’opérateur et elle ne renseigne pas sur d’autres localisations éventuelles.
Un scanner d’emblée thoraco-abdomino-pelvien (TDM TAP), voire cervico-TAP, permet de rechercher de manière exhaustive des adénopathies profondes associées, nécrotiques ou non, une hépato-splénomégalie ou un processus néoplasique primitif. En cas de poly-adénopathie, cet examen peut être utile pour préciser la cible biopsique : ganglion le plus volumineux parmi les plus accessibles. En cas de doute, un scanner TEP-FDG peut être proposé ; c’est alors le ganglion le plus hypermétabolique qui est biospié.
En présence d’une adénopathie axillaire devant faire rechercher un cancer du sein, une mammographie est indiquée.
Examen anatomopathologique : deux techniques privilegiées
Quand l’analyse histologique d’un ganglion devient nécessaire, elle est le plus souvent organisée en milieu hospitalier (en service de médecine interne, hématologie ou infectiologie), sauf situations particulières telles qu’une suspicion de tumeur cutanée ou mammaire.
Plusieurs examens peuvent être envisagés :
- la cytoponction par aspiration est un examen facile d’accès et peu invasif, avec une spécificité proche de 100 % et une sensibilité d’environ 90 %.4 Néanmoins, elle est rarement effectuée de nos jours car elle ne permet pas de préciser l’architecture ganglionnaire. Il existe un risque de faux négatifs, particulièrement en cas d’atteinte partielle ou trop précoce des ganglions lymphatiques par un lymphome débutant qui pourrait alors être considéré à tort comme un lymphome de bas grade ;
- la biopsie à l’aiguille fine guidée par l’imagerie (échographie ou scanner) permet une analyse histologique complète de l’échantillon. Cependant, il existe là aussi un risque de faux négatifs, surtout en présence d’un lymphome composite, d’une nécrose ganglionnaire ou d’un échantillon insuffisant ;
- l’exérèse chirurgicale peut être intéressante en cas de ganglion volumineux ; elle offre une meilleure précision diagnostique que la biopsie à l’aiguille fine.1,10
Avant la réalisation d’une biopsie à l’aiguille ou par voie chirurgicale, une évaluation du rapport bénéfice-risque est primordiale, aidée si besoin d’une discussion pluridisciplinaire. La cible choisie doit être celle ayant le plus de chances d’apporter un diagnostic avec le moindre risque de complications liées au geste. Ainsi, une adénopathie située à proximité de structures vasculo-nerveuses doit faire l’objet d’une vigilance particulière.
Par ailleurs, le choix du laboratoire d’anatomopathologie a son importance. Par exemple, en cas de suspicion d’hémopathie maligne, l’envoi du prélèvement avec des renseignements cliniques précis dans un centre expert en hématologie est recommandé, surtout lorsque le diagnostic est complexe.
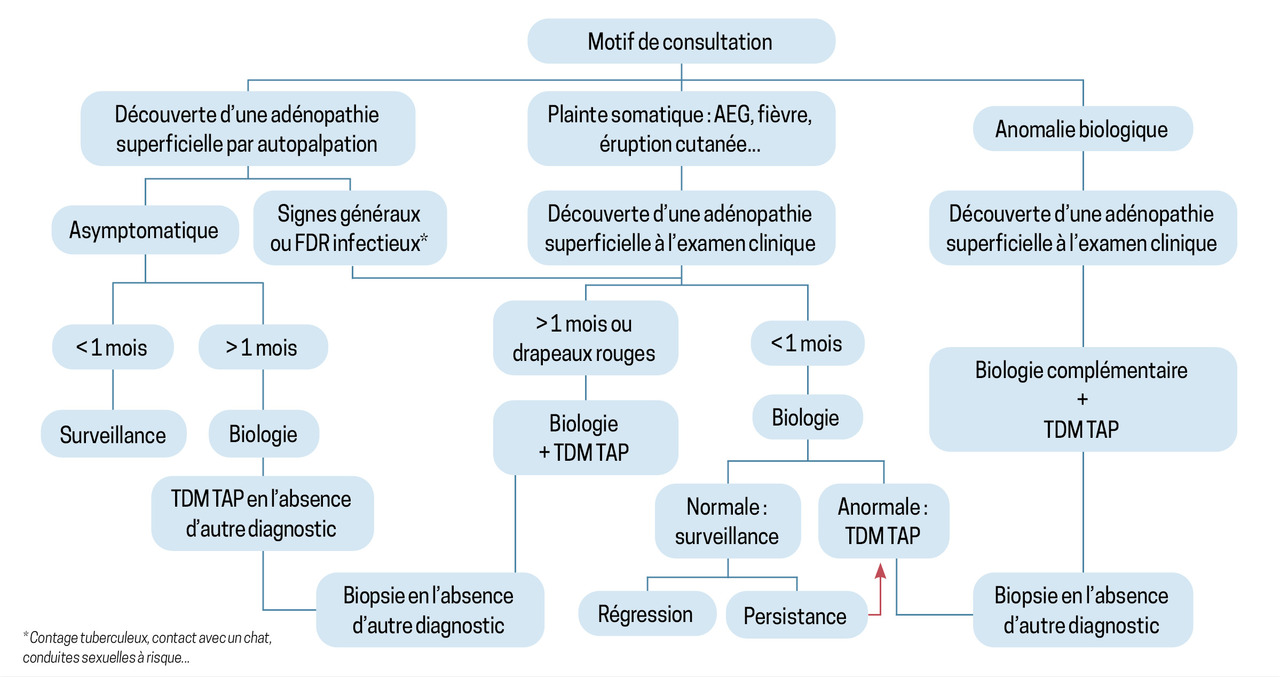
Un algorithme pour décider des explorations nécessaires
Une adénopathie peut être découverte fortuitement par autopalpation ou lors de l’examen clinique du praticien alerté par des symptômes ou anomalies biologiques. Le choix des examens d’investigation et l’ordre dans lequel les réaliser dépendent des circonstances de découverte de l’adénopathie et souvent du ressenti clinique global. Nous proposons ici un algorithme d’aide à la décision élaboré à partir de trois situations courantes en médecine générale (figure).
Une fois les examens réalisés, si la cause a été identifiée, le patient peut soit bénéficier du traitement spécifique en ambulatoire, soit être orienté vers un spécialiste, notamment en cas d’hémopathie maligne ou de cause infectieuse spécifique.
Si la cause n’est pas identifiée, la surveillance simple est parfois proposée. Cependant, si l’adénopathie persiste plus de quatre semaines sans diagnostic, une surveillance rapprochée est nécessaire. Selon le ressenti clinique et l’évolution, un second prélèvement peut être envisagé (autre site ou exérèse complète), tout en veillant à évaluer le risque lié au geste.
Dans tous les cas, l’administration d’une antibiothérapie probabiliste n’est pas recommandée sauf dans le cas d’une cause infectieuse évidente comme un érysipèle. Une corticothérapie à l’aveugle n’est pas non plus indiquée, en raison du risque de négativation d’éventuels prélèvements ultérieurs.
Que dire à vos patients ?
Il est recommandé de réaliser une autopalpation régulière des aires ganglionnaires. Il faut consulter au moindre doute.
Dès l’apparition d’un ganglion inhabituel, surtout en cas d’antécédents néoplasiques, il est nécessaire de consulter.
Une masse indolore n’est pas forcément bénigne.
La biopsie n’est pas toujours contributive et doit parfois être renouvelée.
2. Gaddey HL, Riegel AM. Unexplained Lymphadenopathy: Evaluation and Differential Diagnosis. Am Fam Physician 2016;94(11):896‑903.
3. Ali M, Elhatw A, Hegazy M, et al. The Evaluation of Lymphadenopathy in a Resource-Limited Setting. Cureus 2022;14(10):e30623.
4. Monaco SE, Khalbuss WE, Pantanowitz L. Benign non-infectious causes of lymphadenopathy: A review of cytomorphology and differential diagnosis. Diagn Cytopathol 2012;40(10):925‑38.
5. Gomes de Pinho Q, Dales JP, Macagno N, et al. Intranodal palisaded myofibroblastome: A rare cause of inguinal lymphadenopathy. Rev Med Interne 2024;45(3):138‑41.
6. Celenk F, Gulsen S, Baysal E, et al. Predictive factors for malignancy in patients with persistent cervical lymphadenopathy. Eur Arch Otorhinolaryngol 2016;273(1):251‑6.
7. Vassilakopoulos TP, Pangalis GA. Application of a Prediction Rule to Select which Patients Presenting with Lymphadenopathy Should Undergo a Lymph Node Biopsy. Medicine (Baltimore) 2000;79(5):338.
8. Chau I, Kelleher MT, Cunningham D, et al. Rapid access multidisciplinary lymph node diagnostic clinic: Analysis of 550 patients. Br J Cancer 2003;88(3):354‑61.
9. Bosch X, Coloma E, Donate C, et al. Evaluation of Unexplained Peripheral Lymphadenopathy and Suspected Malignancy Using a Distinct Quick Diagnostic Delivery Model. Medicine (Baltimore) 2014;93(16):e95.
10. Campanelli M, Cabry F, Marasca R, et al. Peripheral lymphadenopathy: Role of excisional biopsy in differential diagnosis based on a five-year experience. Minerva Chir 2019;74(3):218‑23.

 Encadrés
Encadrés