Une surdité brusque neurosensorielle idiopathique (SBNI) se définit par l’installation en moins de soixante-douze heures d’une surdité de perception caractérisée par une diminution du seuil tonal d’au moins 30 décibels sur trois fréquences audiométriques contiguës.1 - 4 Elle affecte principalement les adultes, se produit généralement de manière unilatérale et n’a pas de cause connue dans la plupart des cas. Depuis le milieu des années 2000, elle n’est plus considérée comme une urgence médicale3 et sa prise en charge thérapeutique repose essentiellement sur une corticothérapie orale et/ou locale par voie transtympanique.1 - 4 En 2019, l’American Academy of Otolaryngology-Head and Neck Surgery (AAO-HNS) a publié des recommandations sur la conduite à tenir devant une SBNI.1
Épidémiologie et particularités cliniques
L’incidence estimée de la SBNI dans les pays occidentaux varie de 5 à 30 cas pour 100 000 personnes.4,5 L’incidence réelle peut être sous-estimée en raison de la prévalence des formes partielles et de l’histoire naturelle de la maladie, avec une récupération spontanée survenant dans les deux semaines pour environ deux tiers des patients. L’incidence augmente avec l’âge, atteignant notamment un pic entre 50 et 60 ans.6 Le sex ratio est d’environ 1 pour 1.7
Si dans l’immense majorité des cas, il s’agit d’une affection unilatérale, les formes bilatérales peuvent représenter jusqu’à 8,6 % des cas de SBNI.8 Il existe des formes synchrones (surdité controlatérale apparaissant en moins de 72 heures) et des formes métachrones (surdité controlatérale apparaissant plus de 72 heures après).
Certains auteurs ne considèrent pas les formes bilatérales comme une entité pathologique distincte des SBNI unilatérales.8,9 Cependant, les SBNI bilatérales auraient un moins bon pronostic de récupération. En effet, la surdité serait plus sévère d’emblée, et ces formes seraient plus fréquemment associées à des pathologies systémiques (hypertension artérielle, maladies cardiovasculaires, maladies auto-immunes).8,9
Une physiopathologie mal connue
La physiopathologie de la SBNI reste encore mal comprise. L’hypothèse prévalente est celle d’une transsudation ou d’une exsudation du liquide endolymphatique dans l’oreille interne, résultant de divers facteurs comme des lésions vasculaires, virales ou inflammatoires. Ces événements peuvent entraîner une augmentation de la pression des fluides dans l’oreille interne, provoquant ainsi une atteinte auditive.10
Un diagnostic simple
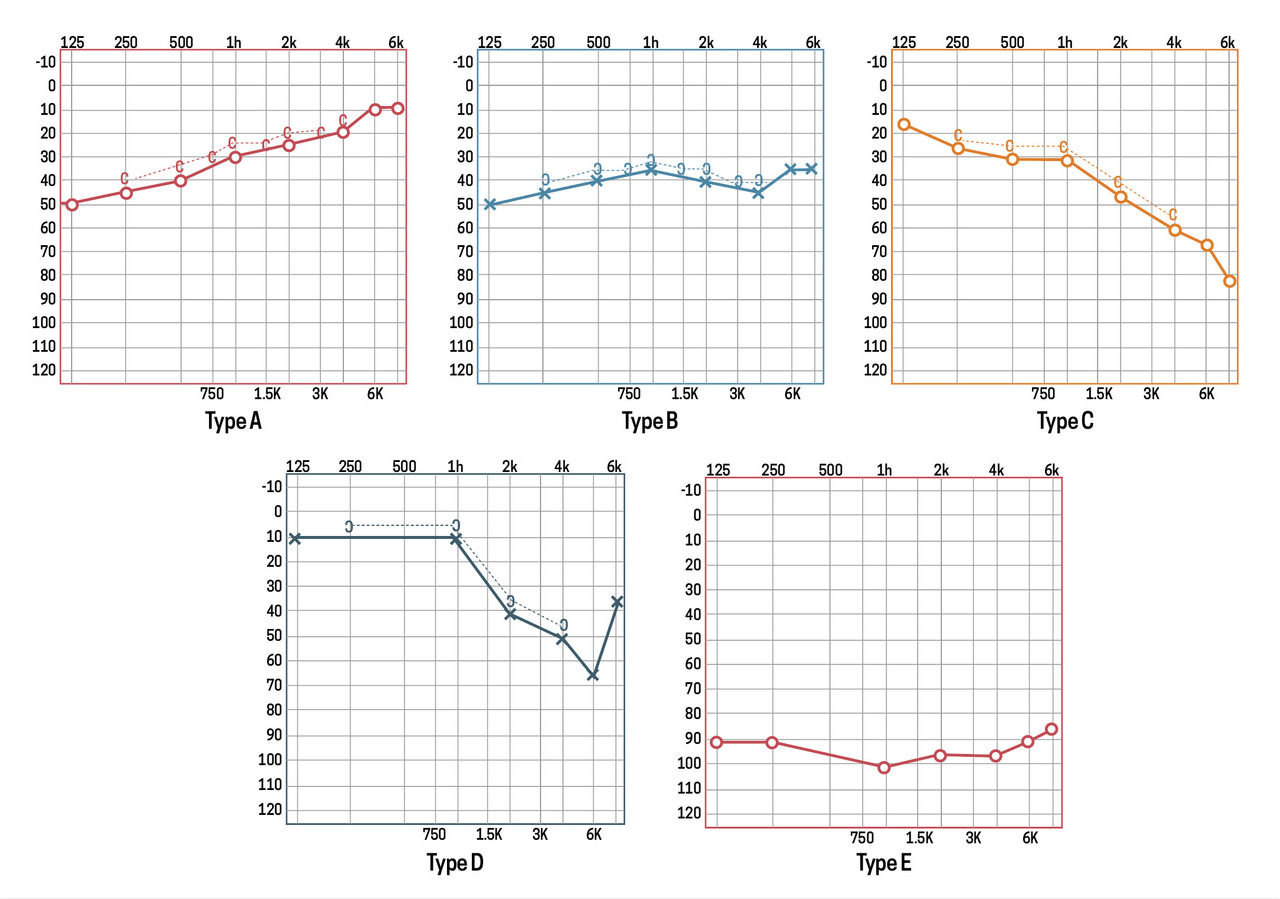
Le diagnostic de SBNI est relativement simple. Il se fait sur une audiométrie réalisée après un examen otoscopique initial normal. Il existe cinq types de SBNI en fonction de l’aspect de la courbe tonale (fig. 1).3,11
Examens de première intention
Un médecin généraliste sans formation spécifique en audiologie doit pouvoir évoquer un diagnostic de SBNI en réalisant une otoscopie et une acoumétrie au diapason, puis adresser le patient en ORL dans les quatorze jours au maximum (recommandations de l’AAO-HNS)2 pour la réalisation d’une audiométrie (tonale et vocale). Un médecin généraliste ayant une formation spécifique en audiologie ou en audiophonologie peut établir le diagnostic de SBNI s’il est équipé d’un audiomètre.
Bilan complémentaire
Une fois le diagnostic de SBNI établi, il est recommandé de faire réaliser une IRM (centrée sur les méats acoustiques internes et les angles pontocérébelleux) dans les trois mois1,2,11 et de faire réaliser des explorations fonctionnelles complémentaires à visée vestibulaire.12
Les examens vestibulaires (vidéonystagmographie avec examen vestibulaire calorique,Video Head Impulse Test et potentiels évoqués otolithiques) sont nécessaires, car 20 à 60 % des patients atteints de SBNI sont susceptibles d’avoir une atteinte vestibulaire périphérique associée.12
L’IRM encéphalique centrée sur les méats acoustiques internes est indispensable afin de ne pas méconnaître une lésion rétrocochléaire (de type schwannome vestibulaire, schwannome intralabyrinthique ou autre tumeur de l’angle ponto-cérébelleux),1,2,11 et pour éliminer une pathologie neurologique comme la sclérose en plaques. Le protocole hydrops peut être ajouté en cas de suspicion de maladie de Menière (surdité fluctuante, plénitude d’oreille, vertiges rotatoires).13
En cas de contre-indication absolue à l’IRM, un enregistrement des potentiels évoqués auditifs (PEA) du tronc cérébral peut être réalisé. Cependant, cet examen est moins sensible que l’IRM pour détecter les lésions rétrocochléaires.
L’AAO-HNS recommande également d’évaluer les otoémissions acoustiques pour différencier les atteintes endocochléaires des atteintes rétrocochléaires dans les cas de perte auditive modérée à sévère.2
Enfin, aucun bilan biologique n’est nécessaire – ni même recommandé – pour le diagnostic de SBNI.1,2
Traitement : un consensus international
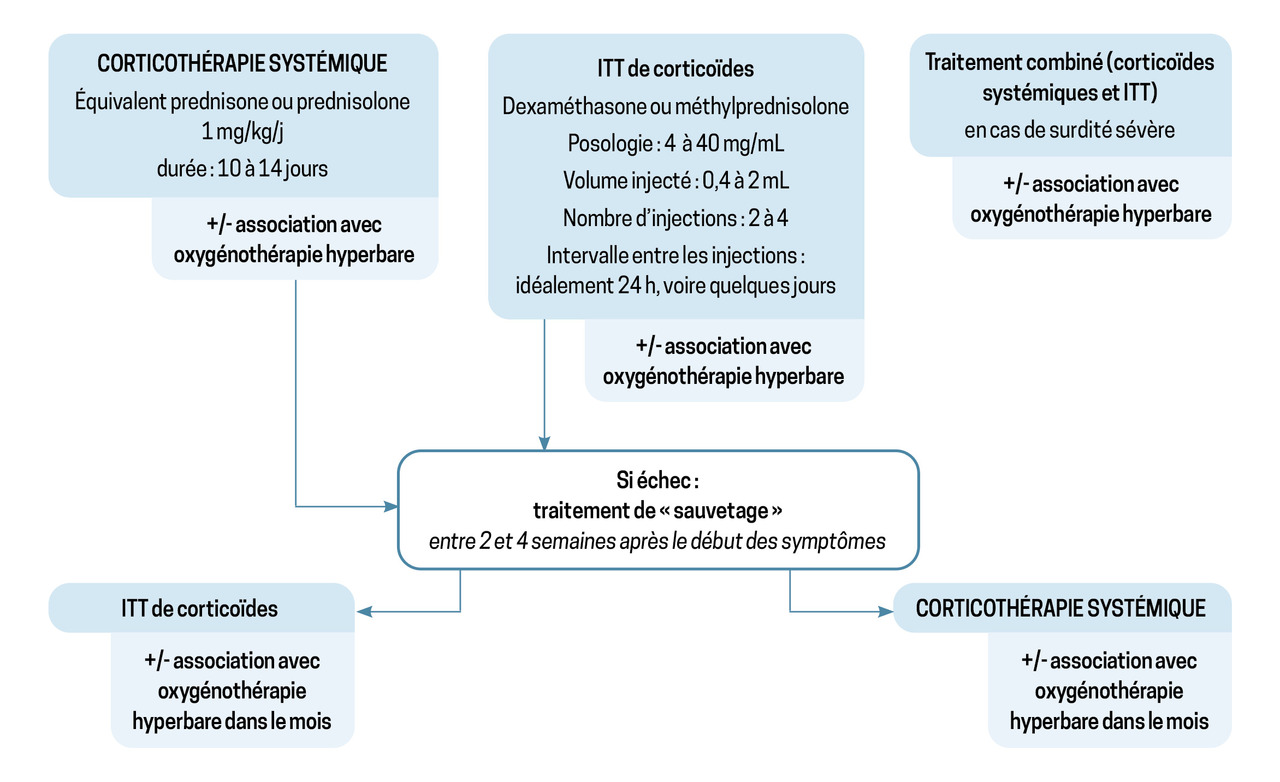
Le traitement des SBNI a fait l’objet de diverses approches, mais il existe un fort consensus international en faveur de l’utilisation des corticostéroïdes, plus ou moins associés à l’oxygénothérapie hyperbare.1,2
Corticothérapie systémique
La corticothérapie par voie orale reste le traitement de référence des SBNI malgré l’absence de preuve scientifique claire en ce qui concerne l’effet mesurable d’une corticothérapie courte pour la récupération auditive.1,2,11
Il est recommandé de débuter la corticothérapie dans les soixante-douze heures suivant le début des symptômes à la dose de 1 mg/kg/j d’équivalent prednisone (60 mg/j au maximum) pendant dix à quatorze jours, avec ou sans décroissance des doses.1,2,11 Il n’y a pas de différence d’efficacité entre la voie orale et la voie veineuse.6
Le débat autour de la corticothérapie porte sur les préoccupations concernant ses effets indésirables (suppression de l’axe hypothalamo-hypophyso-surrénalien, syndrome de Cushing et autres complications) qui se produisent majoritairement en cas de corticothérapie orale au long cours. Les corticothérapies orales de courte durée (à condition qu’elles ne soient pas répétées dans le temps) ne sont généralement pas à l’origine d’effets indésirables notables. Cependant, il s’agit de rester vigilant chez les diabétiques, car une corticothérapie courte à fortes doses peut déséquilibrer la glycémie.
Enfin, il convient de rappeler les contre-indications des corticoïdes par voie orale : infection ou mycose non contrôlée par un traitement adapté, virose évolutive (hépatite, herpès ou zona), psychose non contrôlée par un traitement, association avec un vaccin vivant et patients atteints de phénylcétonurie si le médicament contient de l’aspartame.14
Corticothérapie intratympanique
La corticothérapie intratympanique consiste à injecter des corticostéroïdes à travers la membrane tympanique sous anesthésie locale, en ciblant la fenêtre cochléaire dans le but théorique que de fortes concentrations de principe actif atteignent la cochlée.
Il n’y a actuellement aucun consensus sur les protocoles d’injections intratympaniques, avec des variations dans le type de molécule utilisée, la technique, la posologie et la durée du traitement.15Les avantages de la corticothérapie intratympanique incluent la facilité d’administration en milieu ambulatoire, l’initiation rapide possible et une exposition systémique minimale. Les inconvénients incluent des complications traumatiques potentielles, comme une perforation de la membrane tympanique.
L’administration de corticostéroïdes intratympaniques a démontré des avantages cliniques par rapport au placebo, en particulier en matière de seuils tonaux moyens et de discrimination de mots en audiométrie vocale.15 - 19
La combinaison d’une corticothérapie systémique avec une corticothérapie intratympanique a donné des résultats mitigés. Cependant, cette approche pourrait être bénéfique aux patients atteints de perte auditive sévère.17 - 19
Place de l’oxygénothérapie hyperbare
L’oxygénothérapie hyperbare (OHB) vise à fournir de l’oxygène à haute pression pour améliorer les niveaux d’oxygène dans la périlymphe, ce qui pourrait contrecarrer l’ischémie de l’oreille interne.20,21 Les recommandations de l’AAO-HNS suggèrent que l’OHB peut être administrée en association avec des corticostéroïdes dans les deux semaines suivant l’apparition des symptômes ou comme « traitement de sauvetage » dans le mois.2
Plusieurs méta-analyses soutiennent l’efficacité de la combinaison de l’oxygénothérapie avec les corticostéroïdes, en particulier dans les cas de perte auditive sévère ou totale, avec plus de 1 200 minutes de thérapie recommandées, pour de meilleurs résultats.20 Le traitement standard implique 10 à 20 séances, généralement d’une durée d’environ quatre-vingt-dix minutes chacune.21
Les complications potentielles de l’OHB sont le barotraumatisme, l’otite barotraumatique et la sinusite, ainsi que des complications liées à une hyperoxie comme la myopie et les cataractes.22
Les contre-indications absolues incluent le pneumothorax non traité et la chimiothérapie. Les infections des voies respiratoires supérieures et l’emphysème constituent des contre-indications relatives.21,22
Autres traitements
L’insulin-like growth factor 1 (IGF- 1) est utilisable en une injection unique intratympanique sous forme d’hydrogel. Il protègerait en particulier les cellules ciliées externes.23
Un certain nombre de thérapies expérimentales existent ; il s’agit de médicaments qualifiés d’« otoprotecteurs » ou « otorestaurateurs », permettant de protéger et régénérer les cellules ciliées cochléaires. Il s’agit d’agents antioxydants locaux à libération lente comme SENS- 401 ou ACOU085, qui viseraient à atténuer la perte auditive.24,25
Par ailleurs, les antiviraux, les thrombolytiques et les substances vasoactives ne sont pas recommandés pour la SBNI en raison de preuves insuffisantes d’efficacité.2
Un arbre décisionnel (fig. 2) résume la prise en charge des SBNI, et les propositions récapitulatives des recommandations de l’AAO-HNS sont résumées dans le tableau.
Pronostic et suivi
Dans le cadre du suivi, il est recommandé de réaliser une audiométrie de contrôle à la fin du traitement (à partir du quatorzième jour), puis idéalement six mois plus tard.2 En cas de récupération incomplète ou de non-récupération avec ou sans acouphènes, une réadaptation audioprothétique est envisagée.2 Plusieurs facteurs seraient de mauvais pronostic pour la récupération auditive :
- les courbes audiométriques de type D ou E sont associées à une moins bonne récupération auditive, reflétant différentes pathologies sous-jacentes ;3,11
- la sévérité de la surdité ; plus la perte initiale est importante, plus la récupération serait lente ;3,5,26
- le retard thérapeutique ; un début de traitement au-delà de soixante-douze heures après l’apparition de la SBNI serait lié à une moins bonne récupération ;1,26
- les SBNI bilatérales sont associées à une surdité plus sévère et à un moins bon pronostic de récupération ;8
- l’existence de comorbidités ; le diabète et d’autres facteurs de risque cardiovasculaire et l’utilisation récente de médicaments ototoxiques ont un impact négatif sur la récupération ;2,26
- les patients âgés de plus de 60 ans sont exposés à un risque accru de mauvaise récupération auditive ;2
- la présence d’un syndrome vestibulaire associé (vertiges) aggraverait le pronostic de récupération.12
D’une manière générale, environ 65 % des patients recouvrent l’audition en quatorze jours, quel que soit le traitement instauré. S’il n’y a pas d’amélioration dans les quatorze jours, le pronostic de récupération auditive est considéré comme mauvais.2
Que dire à vos patients ?
La survenue d’une surdité brusque doit faire consulter rapidement, avec instauration d’une corticothérapie, idéalement dans les soixante-douze heures.
Le diagnostic de SBNI est posé grâce à une audiométrie. Une IRM cérébrale centrée sur les conduits auditifs internes est aussi réalisée afin d’éliminer des lésions sous-jacentes.
Dans la majorité des cas, une récupération est constatée en quatorze jours sous traitement.
2. Chandrasekhar SS, Tsai Do BS, Schwartz SR, et al. Clinical practice guideline: Sudden hearing loss (Update). Otolaryngol Head Neck Surg 2019;161(2):195-210.
3. Tran Ba Huy P, Sauvaget E. La surdité brusque idiopathique n’est pas, aujourd’hui, une urgence sensorielle. Ann Otolaryngol Chir Cervicofac 2007;124(2):66-71.
4. Haremza C, Klopp-Dutote N, Strunski V, et al. Evaluation of cardiovascular risks and recovery of idiopathic sudden sensorineural hearing loss in hospitalised patients: Comparison between complete and partial sudden sensorineural hearing loss. J Laryngol Otol 2017;131(10):919-24.
5. Mosnier I, Bouccara D, Sterkers O. Les surdités brusques en 1997 : hypothèses étiopathogéniques, conduite à tenir, facteurs pronostiques, traitements. Ann Otolaryngol Chir Cervicofac 1997;114(7-8):251-66.
6. Szkutnik K, Olszewski J. Analysis of the causes of the occurrence and treatment results of sudden hearing loss/deafness in the own material. Otolaryngol Pol 2022;76(6):22-9.
7. Khamvongsa P, Patel N, Ali AA, et al. Using corticosteroids to treat sudden sensorineural hearing loss in pregnancy: A case report and literature review. Case Rep Womens Health 2020:27:e00201.
8. Wang Y, Xiong W, Sun X, et al. Characteristics and prognosis analysis of bilateral sudden sensorineural hearing loss: A retrospective case-control study. Clin Otolaryngol 2022;47(6):732-40.
9. Bing D, Wang DY, Lan L, et al. Comparison between Bilateral and Unilateral Sudden Sensorineural Hearing Loss. Chin Med J (Engl) 2018;131(3):307-15.
10. Mehta N, Mehta S. Comparative Evaluation of Injection Dexamethasone and Oral Glycerol Versus Injection Dexamethasone Alone in the Treatment of Sudden Onset Sensorineural Deafness. Ear Nose Throat J 2021;100(3_suppl):317S-324S.
11. Gombert E, George M, Maire R, et al. Surdité brusque : diagnostic et prise en charge en 2021. Rev Med Suisse 2021;17:1694-700.
12. Yu H, Li H. Association of vertigo with hearing outcomes in patients with sudden sensorineural hearing loss: A systematic review and meta-analysis. JAMA Otolaryngol Head Neck Surg 2018;144(8):677-83.
13. Liu Y, Pyykkö I, Naganawa S, et al. Consensus on MR imaging of endolymphatic hydrops in patients with suspected hydropic ear disease (Meniere). Front Surg 2022;9:874971.
14. Base de données publique des médicaments. Solupred 20 mg, comprimé orodispersible (notice). 6 novembre 2025. https://bit.ly/44yd2Mb
15. Chrysouli K, Kollia P, Papanikolaou V, et al. The effectiveness of intratympanic steroid injection in addition to systemic corticosteroids in the treatment of idiopathic sudden sensorineural hearing loss. Am J Otolaryngol 2023;44(4):103872.
16. Twigg V, Lawrence R, Thevasagayam R, et al. ENT UK guideline. Management of suspected unilateral idiopathic sudden sensorineural hearing loss in adults. 31 mai 2020. https://bit.ly/4oj4mAv
17. Gundogan O, Pinar E, Imre A, et al. Therapeutic efficacy of the combination of intratympanic methylprednisolone and oral steroid for idiopathic sudden deafness. Otolaryngol Neck Surg 2013;149(5):753-8.
18. Liebau A, Pogorzelski O, Salt AN, et al. Hearing changes after intratympanically applied steroids for primary therapy of sudden hearing loss: A meta-analysis using mathematical simulations of drug delivery protocols. Otol Neurotol 2017;38(1):19-30.
19. Liebau A, Pogorzelski O, Salt AN, et al. Hearing changes after intratympanic steroids for secondary (salvage) therapy of sudden hearing loss: A meta-analysis using mathematical simulations of drug delivery protocols. Otol Neurotol 2018;39(7):803-15.
20. Joshua TG, Ayub A, Wijesinghe P, et al. Hyperbaric oxygen therapy for patients with sudden sensorineural hearing loss: A systematic review and meta-analysis. JAMA Otolaryngol Head Neck Surg 2022;148(1):5-11.
21. Olex-Zarychta D. Hyperbaric oxygenation as adjunctive therapy in the treatment of sudden sensorineural hearing loss. Int J Mol Sci 2020;21(22):8588.
22. Mathieu D, Marroni A, Kot J. Tenth European Consensus Conference on hyperbaric medicine: Recommendations for accepted and non-accepted clinical indications and practice of hyperbaric oxygen treatment. Diving Hyperb Med 2017;47(1):24-32.
23. Hayashi Y, Yamamoto N, Nakagawa T, et al. Insulin-like growth factor 1 inhibits hair cell apoptosis and promotes the cell cycle of supporting cells by activating different downstream cascades after pharmacological hair cell injury in neonatal mice. Mol Cell Neurosci 2013:56:29-38.
24. Braverman I, Elziere M, Komazec Z, et al. Efficacy and safety of SENS-401 in sudden sensorineural hearing loss: The AUDIBLE-S randomized placebo-controlled phase IIb trial. Am J Otolaryngol 2024;45(6):104480.
25. Peixoto Pinheiro B, Müller M, Bös M, et al. A potassium channel agonist protects hearing function and promotes outer hair cell survival in a mouse model for age-related hearing loss. Cell Death Dis 2022;13(7):595.
26. Poljak NK, Klančnik M, Ivanišević P, et al. Analysis of clinical parameters as predictors of hearing recovery in patients with sudden sensorineural hearing loss. Braz J Otorhinolaryngol 2022;88(Suppl 3):S171-6.

 Encadrés
Encadrés