Pour beaucoup, la maladie de Parkinson est synonyme de lenteur, de raideur, de marche à petits pas et surtout de tremblements. Cette image est en partie vraie, car le diagnostic repose encore actuellement sur la présence de signes moteurs (les derniers critères de la maladie datent de 20151). Cependant, dès la première description de la « paralysie tremblante » par James Parkinson en 1817, il est fait mention de très nombreux signes pouvant impliquer le système nerveux autonome, le sommeil ou la sphère cognitive et comportementale. Pour autant, ces signes ont été négligés pendant des décennies, et ce pour plusieurs raisons :
- la prise en charge holistique des patients est un concept récent, notamment dans la prise en compte de l’anxiété, des troubles de la sexualité et du sommeil dans les maladies chroniques ;
- l’amélioration spectaculaire des signes moteurs par des traitements dopaminergiques (traitements per os ou par pompe) et par la stimulation cérébrale profonde a pu conforter les soignants dans l’idée que les signes non moteurs relevaient d’une moindre importance dans la maladie de Parkinson ;
- les possibles copathologies liées à l’âge, comme les troubles rhumatologiques dégénératifs ou les pathologies prostatiques chez l’homme, demeurent un défi diagnostique ;
- certains troubles du comportement ou du sommeil ont longtemps été attribués aux effets indésirables des traitements antiparkinsoniens (agonistes dopaminergiques pour le trouble du contrôle des impulsions ou les hallucinations).
Une grande variété de signes non moteurs
Depuis plus de vingt ans, de très nombreuses études se sont intéressées à la fréquence des signes non moteurs dans la maladie de Parkinson. L’étude PRIAMO a ainsi identifié plusieurs catégories de signes : gastro-intestinaux, douleurs, urinaires, cardiovasculaires, troubles du sommeil, fatigue, apathie, troubles de l’attention/de la mémoire, cutanés, psychiatriques, respiratoires, « autres ».2 Selon cette étude exhaustive ayant inclus plus de 1 000 patients dans toute l’Italie, les signes les plus fréquemment décrits par les patients sont les suivants : fatigue (58,1 %), anxiété (55,8 %), douleurs des membres inférieurs (37,9 %), insomnie (36,9 %), impériosités mictionnelles (35 %), nycturie (34,6 %), troubles de la concentration (31,4 %), hyposmie (26,9 %), constipation (27,5 %), plainte mnésique (25,1 %), dépression (22,5 %), somnolence diurne excessive (21,2 %), apathie (21 %) et douleurs « diffuses » (20,8 %). Outre ces signes non moteurs, l’hypotension artérielle et les hallucinations sont abordées du fait de leurs potentielles conséquences pour le patient. Les signes axiaux (dysphagie, bavage et dysarthrie) ne sont, en revanche, pas évoqués dans cet article.
Établir le lien entre un signe non moteur et la maladie de Parkinson
Pour raisonner devant un potentiel signe non moteur chez un patient atteint de la maladie de Parkinson, il convient de toujours se poser la question de l’unicité du tableau clinique et donc de rechercher une éventuelle copathologie ou une iatrogénie qui pourrait expliquer, au moins en partie, la plainte.
Dans un second temps, il est nécessaire de retenir que certains signes décrits par les patients peuvent le plus souvent résulter d’un sous-dosage en traitement antiparkinsonien ; quatre sont particulièrement évocateurs :
- des douleurs diffuses au niveau des membres inférieurs, qui, outre la réalisation d’examens complémentaires en fonction de la clinique rapportée, sont généralement résolues par une majoration des doses de lévodopa ;
- la fatigue, qui implique le dépistage et l’exploration d’une possible altération de l’état général (entre autres, prescrire facilement un dosage de la thyréostimuline [TSH]) mais aussi l’évaluation de la qualité du sommeil. Celui-ci est, en effet, très affecté par les troubles psychologiques survenant de façon plus fréquente dans la maladie de Parkinson mais doit, en plus de la recherche d’un syndrome des jambes sans repos, faire rapidement évoquer un sous-dosage en antiparkinsoniens ;
- la nycturie (besoin d’uriner plusieurs fois durant la nuit), qui est la plupart du temps une conséquence d’un inconfort lié au sous-dosage en traitement plutôt que d’un éventuel syndrome d’apnées du sommeil (qui doit être recherché même si la prévalence est moindre dans la maladie de Parkinson par rapport à la population générale). Dans ce cas, le rôle du neurologue est central dans l’adaptation du traitement dopaminergique ;
- les troubles psychologiques et psychiatriques dans la maladie de Parkinson, qui sont également sensibles aux variations de dosage des antiparkinsoniens.
Troubles cognitivo-comportementaux et psychiatriques
Les troubles cognitivo-comportementaux sont fréquents dans la maladie de Parkinson ; une prise en charge non médicamenteuse doit être privilégiée.
Anxiété
L’anxiété peut survenir lors de fluctuations non motrices de la maladie et s’accompagne de manifestations parfois spectaculaires (douleurs abdominales, dyspnée aiguë). Dans ce cas, une prise en charge en urgence est nécessaire et doit permettre une adaptation du traitement des complications motrices.
Une prise en charge psychologique est à proposer à tous les patients, en les orientant vers des professionnels qui utilisent des techniques auxquelles le patient adhère (la thérapie cognitivo-comportementale a montré une certaine efficacité, mais une autre thérapie peut être envisagée si le patient n’y adhère pas).
Concernant les psychotropes, les benzodiazépines doivent être prescrites pour une durée courte, associées à un traitement au long cours de type inhibiteurs de la recapture de la sérotonine (IRS) ou de la sérotonine et de la noradrénaline (IRSNa).
Plaintes cognitives
L’anxiété mais aussi l’atteinte de l’humeur sont les principaux éléments à rechercher en cas de plainte cognitive qui, dans la maladie de Parkinson, se manifeste le plus souvent par des troubles attentionnels ou dysexécutifs (troubles mnésiques touchant la récupération et qui s’améliorent avec l’indiçage).
Pour les patients jeunes (moins de 65 ans) ou en cas de suspicion de maladie d’Alzheimer associée, un bilan neuro-psychologique peut être nécessaire.
Aucun traitement médicamenteux n’a montré de bénéfice sur les troubles cognitifs de la maladie de Parkinson et leur prise en charge est la même qu’en cas de démence ou de dysfonctionnement cognitif léger lié à une autre cause.
Dépression et risque suicidaire
Les éléments dépressifs, bien que plus rares, doivent être dépistés et distingués d’une éventuelle apathie ou d’un sous-dosage en traitement (hypomimie et lenteur psychique).
Une prise en charge spécialisée est indispensable si le risque suicidaire est élevé, ce qui peut être le cas chez les patients ayant un trouble du contrôle des impulsions.
Troubles du contrôle des impulsions, hallucinations et délire
Les troubles du contrôle des impulsions ainsi que les hallucinations ou le délire doivent conduire à une réévaluation du traitement antiparkinsonien et des traitements associés, notamment anticholinergiques et opioïdes.
Devant l’apparition ou la recrudescence d’éléments délirants de façon subaiguë, la recherche d’une épine irritative (fécalome, rétention d’urine, déshydratation, infection virale…) doit être réalisée dans les meilleurs délais, si besoin dans le service d’urgence de secteur. Le neurologue pourrait, par la suite et en fonction de l’état moteur du patient, diminuer la dopathérapie ou associer un traitement par clozapine/quétiapine, qui peut être introduit précocement à visée préventive. La présence d’un délire ou d’hallucinations florides représente un facteur de mauvais pronostic de la maladie de Parkinson et doit faire accélérer la prise en charge sociale. Il s’agit, en effet, de la première cause d’institutionnalisation des patients parkinsoniens.
Prise en charge de la dysautonomie
L’atteinte dysautonomique est moins complexe à gérer que les troubles cognitivo-comportementaux.
Constipation
La constipation est le symptôme non moteur probablement le plus sous-estimé par les professionnels de santé ; or, il peut avoir un impact sur les troubles vésico-sphinctériens, augmenter le risque de psychose, de confusion et de complications locales (fissures anales). La stratégie thérapeutique n’est pas spécifique, et l’objectif est d’obtenir la fréquence d’une selle moulée par jour. Des outils tels que l’irrigation transanale peuvent avoir un intérêt en cas de constipation sévère et résistante.
Hypotension orthostatique
L’hypotension artérielle orthostatique – associée à des pics hypertensifs chez certains patients, rendant la gestion davantage problématique – est aussi sous-diagnostiquée, alors que son dépistage repose sur des manœuvres simples. L’application de règles hygiéno-diététiques, la réévaluation fréquente du rapport bénéfice/risque des anti-hypertenseurs, des alphabloquants et de certains psychotropes, et le port de bas ou de bandes de contention permettent d’améliorer l’état des patients.
Dans certains cas, le neurologue peut prescrire de la fludrocortisone ou de la midodrine (alpha-agoniste) trois fois par jour. La gestion d’une potentielle iatrogénie nécessite une coordination avec le médecin traitant.
Les effets indésirables de certains traitements comme la midodrine peuvent aggraver d’autres aspects non moteurs ; la priorité doit être donnée à ce qui impacte le plus la qualité de vie du patient et/ou de l’aidant.
Troubles urinaires
Ils sont le plus souvent marqués par des impériosités mictionnelles et des fuites peu abondantes non liées à l’effort. Le recours à un bilan urodynamique permet de mieux cibler la thérapeutique et d’instaurer de façon plus sereine des anti-cholinergiques lipophobes, passant moins la barrière hématoencéphalique ; il peut s’agir du trospium, de la fésotérodine, voire de la solifénacine.
Troubles du sommeil
Outre un éventuel sous-dosage en traitement antiparkinsonien, l’existence de troubles du sommeil doit faire systématiquement dépister une anxiété ou un trouble de l’humeur sous-jacent.
Le trouble du comportement en sommeil paradoxal gêne principalement le conjoint et doit être traité, notamment si le patient risque de se blesser ou de blesser autrui du fait de la violence des mouvements.
Dans ce cas, des molécules telles que le clonazépam, la gabapentine ou la mélatonine peuvent être prescrites.
Concernant l’insomnie, dès lors qu’un sous-dosage, une iatrogénie (prescription tardive de paroxétine, midodrine ou corticoïdes), non-respect de l’hygiène de sommeil et copathologie sont éliminés, une polygraphie nocturne peut aider à la prise en charge.
L’utilisation d’hypnotiques doit se faire avec parcimonie en évitant le recours aux benzodiazépines durant plusieurs semaines. Les antidépresseurs tétracycliques (mirtazapine ou miansérine) peuvent être prescrits, de même que la mélatonine, qui a surtout un effet sur l’induction du sommeil.
Parfois, une évaluation en centre du sommeil est indispensable pour débuter une prise en charge non médicamenteuse personnalisée. Enfin, la somnolence diurne excessive doit faire rechercher une iatrogénie (agonistes dopaminergiques en priorité) et une possible altération de l’état général. Si l’imputabilité de la maladie de Parkinson est retenue, des traitements éveillants comme le solriamfétol ou le pitolisant peuvent être introduits par le neurologue.
Impliquer les aidants, le patient et l’équipe de soin
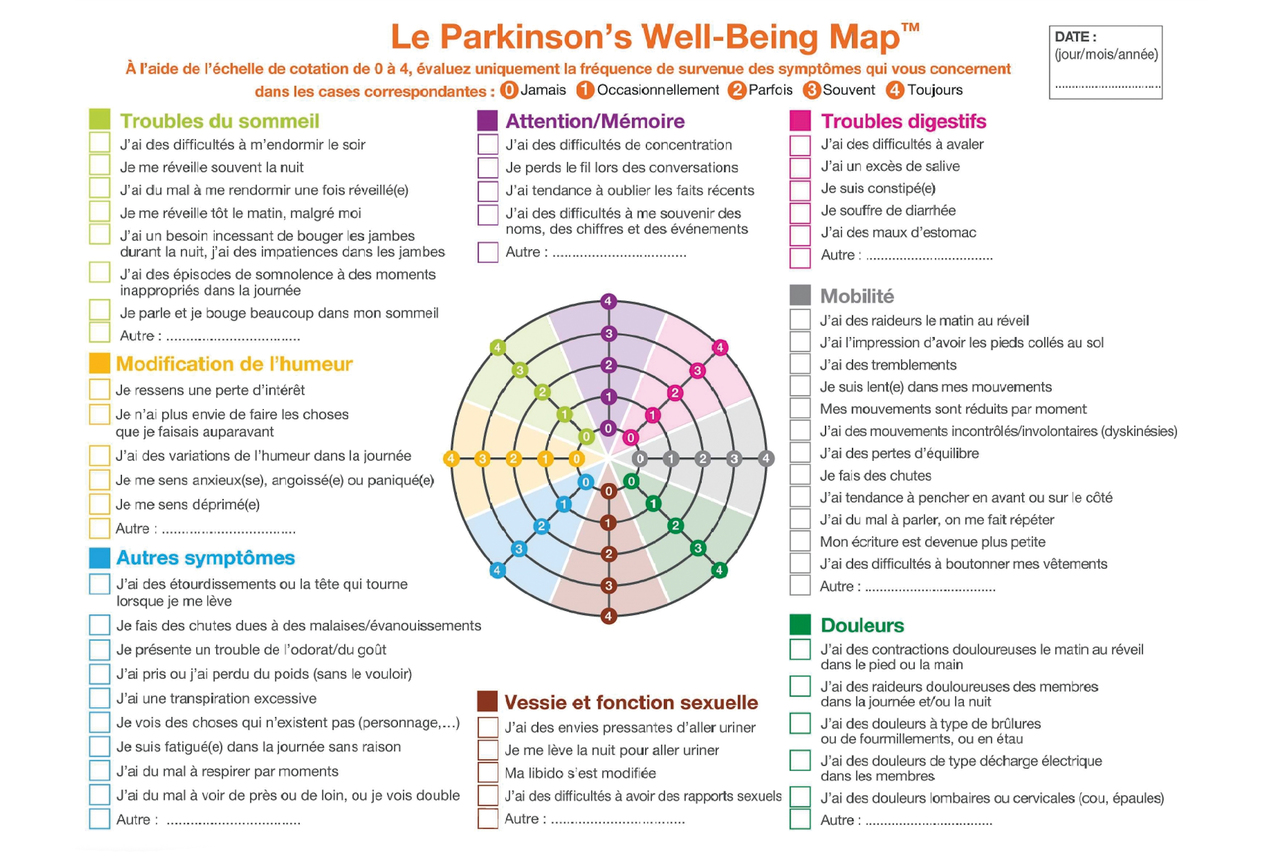
Le dépistage des signes non moteurs de la maladie de Parkinson nécessite du temps. Certains outils comme la Well-Being Map5 (évaluation du patient facilitant la description des difficultés) [figure] peuvent aider à personnaliser la prise en charge, de même que les séances d’éducation thérapeutique, qui enseignent aux patients à reconnaître leurs symptômes et à aménager leur quotidien en fonction de la gêne. La multiplicité des intervenants potentiels (urologue, rééducateur, cardiologue, rhumatologue, infirmier, infirmier en pratique avancée, psychologue, psychiatre, etc.) rend encore plus essentiel le travail en collaboration.
Signes non moteurs de la maladie de Parkinson : indicateurs-clés
Les signes non moteurs de la maladie de Parkinson sont aussi variés qu’imprévisibles. Cependant, cinq grands principes peuvent aider le clinicien :
- tous les patients ne développent pas systématiquement l’ensemble des signes non moteurs, notamment les troubles cognitifs, qui inquiètent les patients et leur entourage ;
- aucun tableau clinique de ces signes non moteurs n’est spécifique de la maladie de Parkinson ;
- la grande majorité des signes non moteurs peuvent survenir à n’importe quel stade d’évolution de la maladie. Néanmoins, leur fréquence et leur intensité ont tendance à s’aggraver au cours des années ;
- certains signes non moteurs surviennent plutôt de façon précoce (hyposmie, troubles du comportement en sommeil paradoxal, constipation) ; d’autres doivent alerter sur la possibilité d’un diagnostic différentiel, soit en tant que critère d’exclusion (troubles praxiques ou phasiques faisant évoquer une paralysie supranucléaire progressive ou une dégénérescence corticobasale), soit en tant que drapeau rouge (par exemple, précocité et sévérité de la dysautonomie devant faire évoquer une atrophie multisystématisée) ;
- la tendance générale est à la prise en compte des signes non moteurs dans le diagnostic de la maladie de Parkinson ;3 ainsi, l’absence de troubles cognitifs, dysautonomiques ou du sommeil dans les cinq ans suivant l’apparition des signes moteurs doit faire reconsidérer le diagnostic.
Que dire à vos patients ?
La plupart des patients parkinsoniens sont sous-dosés en traitement dopaminergique, ce qui peut engendrer fatigue, anxiété, dépression, douleur et troubles du sommeil.
De nombreux signes peuvent être liés à la maladie de Parkinson, mais il peut exister des facteurs confondants, qu’il convient d’éliminer.
Il peut être utile de préparer votre consultation avec des outils tels que ceux proposés par les associations de patients (par exemple la Well-Being Map).
La prise en charge non médicamenteuse (règles hygiénodiététiques, activité physique, suivi psychologique) reste l’une des pierres angulaires du traitement.
2. Barone P, Antonini A, Colosimo C, et al. The PRIAMO study: A multicenter assessment of nonmotor symptoms and their impact on quality of life in Parkinson’s disease. Mov Disord 2009;24(11):1641-9.
3. Höglinger GU, Adler CH, Berg D, et al. A biological classification of Parkinson’s disease: The SynNeurGe research diagnostic criteria. Lancet Neurol 2024;23(2):191-204.
4. Seppi K, Ray Chaudhuri K, Coelho M, et al. Update on treatments for nonmotor symptoms of Parkinson’s disease-an evidence-based medicine review. Mov Disord 2019;34(2):180-98.
5. Schuler B, Zouitina Y, Lefranc M, et al. Intérêt de la Well Being Map dans le suivi des patients présentant une maladie de Parkinson. Rev Neurol 2016;172(S1):A104.

 Encadrés
Encadrés