Le syndrome de la douleur vésicale ou cystite interstitielle (SDV/CI) fait partie des syndromes douloureux pelviens de la femme, au même titre que le syndrome de la douleur urétrale, de la douleur vulvaire (anciennement vulvodynie), de la douleur vestibulaire (anciennement vestibulodynie).
Selon la définition consensuelle actuelle, il correspond à une douleur pelvienne, une pression ou un inconfort chronique (évoluant depuis plus de six mois) perçus comme étant en relation avec la vessie et accompagnés par au moins un symptôme urinaire tel que la pollakiurie ou une envie mictionnelle permanente.1
Un syndrome méconnu en France
Cette pathologie a été décrite au début du XIXe siècle, notamment dans sa forme ulcéreuse. Elle n’est pourtant au programme de l’internat de médecine que depuis 2009 en France, noyée au sein du chapitre des algies pelviennes de la femme (item 39). Elle reste donc méconnue du monde médical français.
Les données épidémiologiques sont rares dans notre pays, contrairement à l’Amérique du Nord ou à l’Europe du Nord, où la prévalence chez la femme est estimée entre 0,05 et 3,7 %, avec un ratio homme/femme de 1 sur 9.2
Pathogénie : de nombreuses hypothèses
Malgré de très nombreuses publications scientifiques sur le sujet, la pathogénie reste imprécise, principalement du fait de l’absence d’un bon modèle d’étude animal ; l’animal utilise en effet la fonction urinaire le plus souvent comme marqueur de son territoire et ne peut s’exprimer sur ce qu’il ressent. Ainsi, plusieurs théories coexistent sans s’éliminer.
La théorie épithéliale reste prédominante : un déficit épithélial, et notamment en glycosaminoglycanes (protéines de surface), expliquerait une perméabilité anormale de la paroi aux substances contenues dans l’urine (et particulièrement le potassium) qui seraient source d’inflammation chronique de cette paroi.
La théorie mastocytaire est également valable ; en effet, pour des raisons encore non clairement démontrées, les cellules mastocytaires de la paroi vésicale seraient activées de façon permanente.
La dérégulation sensitive associant une sensibilisation spinale centrale et/ou une hyperinnervation sensorielle est une hypothèse également retenue.
Enfin, le fait qu’il puisse s’agir d’un syndrome fonctionnel somatique est aussi évoqué.
De très nombreux biomarqueurs (epithelial growth factor, nerve growth factor, facteur antiprolifératif, adénosine triphosphate…), le plus souvent urinaires ou urothéliaux, ont été caractérisés ces vingt dernières années, mais leur utilisation en pratique courante n’a pas encore abouti.
Des modifications de la substance grise cérébrale (augmentée chez les patients) ont été observées en IRM.3 De récents travaux suggèrent un support génétique4 et un rôle joué par des facteurs de transcription urothéliaux, dont les récepteurs de l’acide rétinoïque.5
Comment poser le diagnostic ?
Le diagnostic repose sur des critères cliniques facilement identifiables.
Il s’agit le plus souvent de femmes (9 femmes pour 1 homme).
Le besoin mictionnel est permanent, expliquant la pollakiurie, qui est souvent diurne (10 à plus de 50 mictions) mais aussi nocturne (3 à plus de 10 mictions). Dans certains cas de sommeil profond ou de prise de somnifères, la pollakiurie nocturne peut toutefois ne pas être importante.
Ce besoin mictionnel est associé à des douleurs, une sensation de pression, d’inconfort ou de gêne, perçues comme étant en relation avec la vessie. En effet, le remplissage vésical progressif accentue ces symptômes et la miction soulage la douleur, l’inconfort ou la gêne : c’est le signe majeur pour différencier le SDV/CI de la cystite bactérienne aiguë, qui provoque le plus souvent des brûlures mictionnelles. Cependant, le soulagement est bref (quelques minutes), voire très bref, car perçu uniquement durant la miction.
Les douleurs, pressions ou inconforts sont ressentis au niveau de la région sus-pubienne mais parfois aussi vaginale ou urétrale. Il n’y a pas de caractère mécanique, ni de lien avec la position. En revanche, l’intensité des symptômes ressentis peut varier dans le temps ; une évolution par crises – pouvant durer plusieurs jours à quelques semaines – est fréquente, avec en général une période intercrises durant laquelle la situation clinique reste anormale.
En outre, la douleur, la pression ou l’inconfort vésical provoquent une sensation imminente de devoir uriner, à la recherche d’un soulagement, sans être pour autant une urgenturie puisque les patients sont capables de se retenir et ne font pas état de fuites urinaires involontaires. La plupart du temps cependant, ils ne diffèrent pas leurs mictions car cela accentue leurs symptômes. Dans de rares cas, certains se retiennent plusieurs heures, ce qui aboutit à un soulagement des symptômes.
Les traitements classiques à visée vésicale, antibiotiques, anti-inflammatoires, antalgiques et anticholinergiques sont inefficaces.
Les rapports sexuels accentuent les symptômes perçus et/ou déclenchent les crises ; ils sont donc évités ou redoutés.
Chez un patient sur cinq seulement, il existe un lien avec l’alimentation : les aliments acides accentuent les symptômes et/ou déclenchent une crise.
Des circonstances particulières ayant précédé l’apparition des symptômes sont souvent mises en évidence : épisode unique ou multiple de cystite bactérienne, intervention chirurgicale pelvienne, traumatisme pelvien mais aussi traumatisme psychologique.
Dans 30 % des cas, une autre pathologie douloureuse est associée : autres syndromes douloureux déjà évoqués, fibromyalgie, douleurs myofasciales, endométriose, syndrome du côlon irritable, syndrome de Gougerot- Sjögren, et souvent un syndrome dépressif.
Cette description clinique caractéristique est largement suffisante pour évoquer un diagnostic de SDV/CI. Néanmoins, la méconnaissance de cette pathologie explique l’errance diagnostique, et donc une longue durée d’évolution des symptômes avant une prise en charge efficace (quatre ans en moyenne dans notre expérience).
Quel bilan initier ?
Dans tous les cas, face à une description clinique caractéristique, le médecin généraliste doit mettre en place des actions très simples en première intention.
Il convient ainsi de faire remplir au patient un calendrier mictionnel. Cet outil, facile à mettre en œuvre, est indispensable pour apprécier le nombre de mictions, leurs horaires, les volumes mictionnels, l’absence de fuites sur urgenturie et enfin la diurèse totale. En effet, il n’est pas rare de rencontrer des patients dont la pollakiurie et les envies mictionnelles permanentes s’expliquent par une polyurie (ou diurèse excessive), la pollakiurie nocturne pouvant s’expliquer par une polyurie nocturne (plus de 30 % du volume total des urines est éliminé la nuit). La normalisation de la diurèse aux environs de 1,2 à 1,5 litre d’urine par jour, si elle entraîne également celle de la fréquence mictionnelle, permet d’écarter le diagnostic de SDV/CI. La prise en charge des causes curables de polyurie nocturne autre que la polyurie (syndrome d’apnées du sommeil ou insuffisance cardiaque avec œdèmes des membres inférieurs relargués pendant la nuit, voire un traitement par hormone antidiurétique avant 65 ans) est utile en première intention.
Des autoquestionnaires validés sont également disponibles : questionnaire de symptômes et de gêne de Sant et O’Leary, questionnaire PUF (Pain Urgency Frequency score).
L’examen clinique est le plus souvent normal en dehors d’une hypersensibilité fréquente de la paroi vaginale antérieure expliquant la dyspareunie souvent associée.
La prescription d’un examen cytobactériologique des urines (ECBU) pour écarter une cystite bactérienne est conseillée. L’ECBU est stérile, mais il est courant de constater une leucocyturie augmentée, voire une hématurie microscopique, en cas de SDV/CI.
Passer la main au spécialiste de la vessie
À ce stade de la démarche diagnostique, il convient d’adresser le patient à un urologue qui connaît cette pathologie.
Avant d’envisager un traitement, ce dernier a recours à deux types d’investigation complémentaires.
Bilan urodynamique
Cet examen permet de mettre en évidence un signe essentiel : l’hypersensibilité de la vessie, avec une perception plus précoce et/ou plus douloureuse des besoins mictionnels. Le besoin, ressenti comme une douleur ou parfois comme une simple pression ou un inconfort, est plus précoce et ne permet pas – surtout quand il est douloureux – de remplir la vessie à une capacité normale d’environ 300 à 400 mL. Ce besoin est évalué sur une échelle visuelle analogique.
Dans le même temps, les pressions
vésicales restent basses jusqu’au déclenchement éventuel d’une miction, ce qui permet d’écarter les diagnostics différentiels d’hyperactivité ou d’hypertonie vésicale.
Ce signe d’hypersensibilité vésicale, bien analysé, est pathognomonique mais reste très dépendant de l’opérateur. La plupart des sociétés savantes ne recommandent donc pas le bilan urodynamique dans la démarche diagnostique d’un SDV/CI.
Endoscopie vésicale
Cet examen réalisé sans anesthésie ou sous simple anesthésie locale est en général vécu comme douloureux ou inconfortable. L’anesthésie générale ou la rachianesthésie permettent de le réaliser dans de meilleures conditions pour le patient.
Il consiste en une exploration première des parois de la vessie afin de distinguer deux situations bien distinctes :
- dans une majorité de cas de SDV/CI, les parois vésicales ont un aspect normal ;
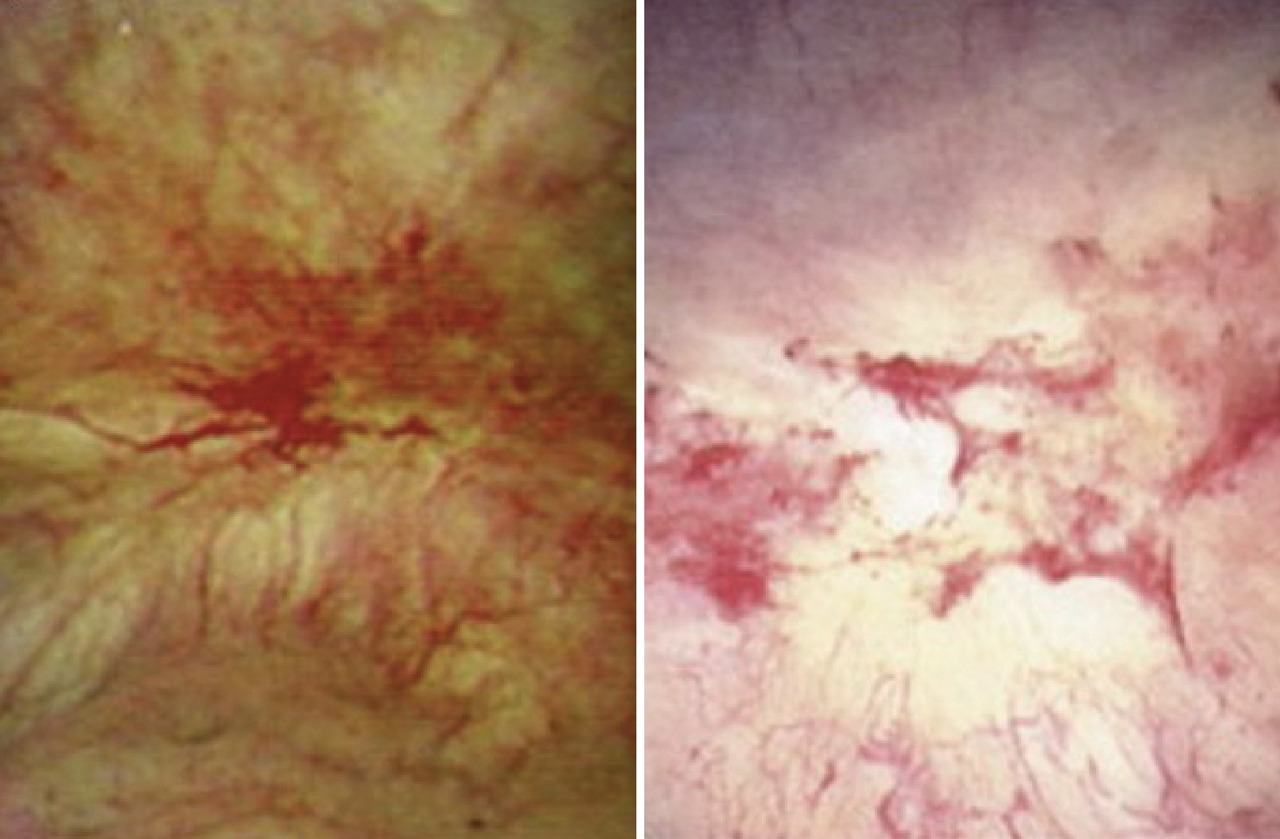
- dans une minorité de cas, des zones d’aspect inflammatoire d’une typologie très variable sont mises en évidence. Le plus souvent, ces lésions sont peu nombreuses et siègent exclusivement sur les parois mobiles de la vessie. Cependant, elles peuvent parfois être plus étendues : ce sont les ulcères dits de Hunner (fig. 1), décrits en 1915, à une époque où le matériel endoscopique n’était pas développé comme aujourd’hui (lumière blanche, caméra etc.). Il est très important de diagnostiquer ces ulcères ; plusieurs auteurs s’accordent pour penser qu’en leur présence, il ne s’agit pas d’un SDV/CI, et la prise en charge des patients diffère.6
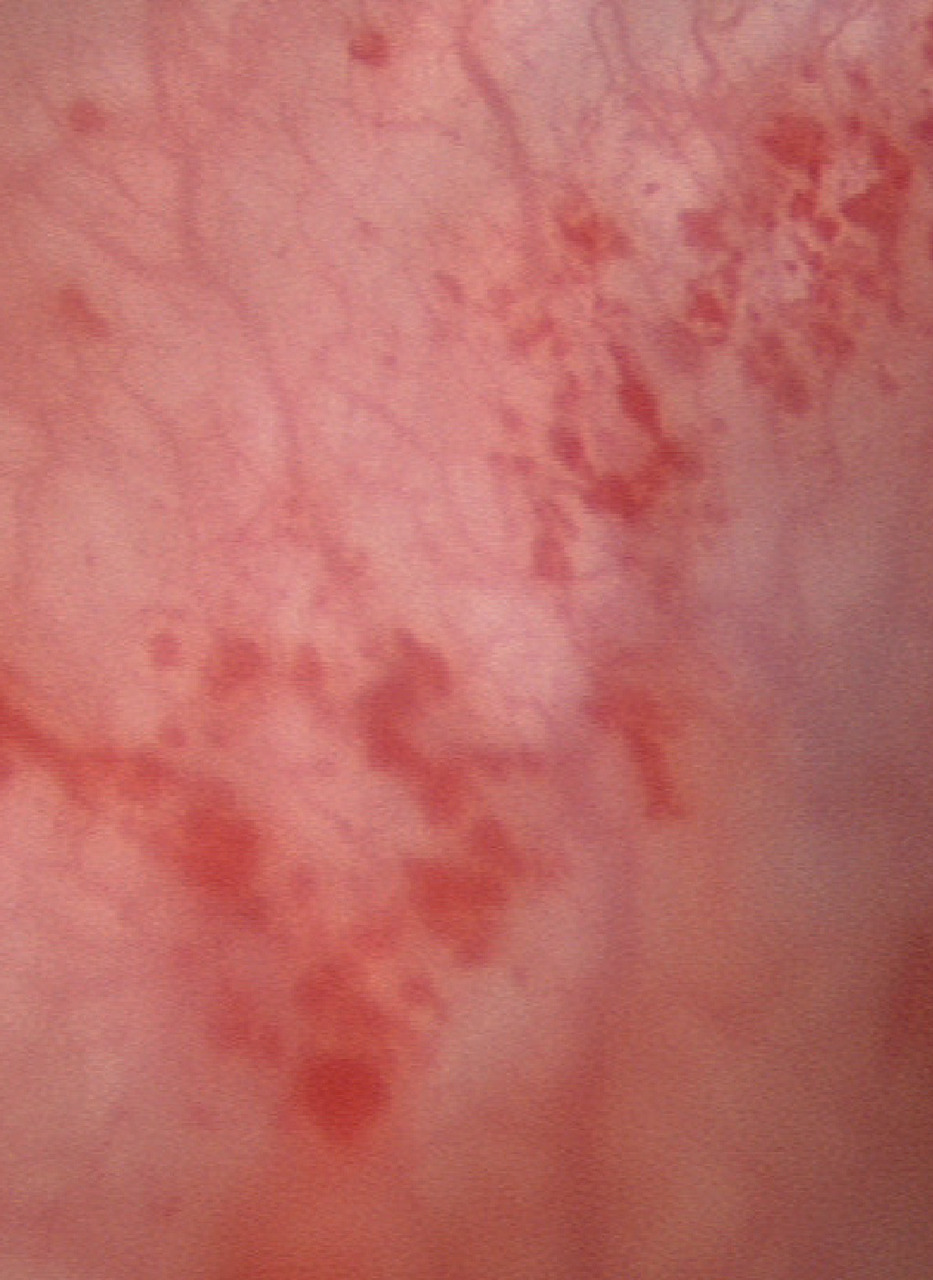
Le deuxième temps de l’examen endoscopique vésical consiste en la réalisation d’une hydrodistension de la vessie jusqu’à une pression de 80 cm d’eau pendant une durée non consensuelle de quelques minutes (3 minutes en moyenne). La vessie est ensuite vidée, et un nouvel examen visuel est réalisé. Celui-ci met le plus souvent en évidence des points de saignement plus ou moins nombreux, diffus ou hémorragiques appelés pétéchies ou glomérulations (fig. 2).
Dans de rares cas, des lésions inflammatoires peuvent devenir visibles alors qu’elles ne l’étaient pas lors de l’examen initial des parois ; ces lésions, si elles sont visibles dès la première exploration, s’étendent souvent après l’hydrodistension. Elles peuvent rester isolées ou, plus souvent, être accompagnées de pétéchies diffuses. L’interprétation diagnostique de ces situations distinctes n’est pas établie.
Il convient de réaliser des biopsies de la paroi vésicale, si possible en emportant une partie de la couche musculaire afin d’écarter les pathologies cancéreuses (notamment le carcinome in situ).
La présence de mastocytes dans la couche musculaire à plus de 28 éléments par mm2 est considérée comme plaidant très en faveur d’un syndrome de la douleur vésicale ou cystite interstitielle. Selon certaines recommandations internationales, ce test n’est à réaliser qu’après échec des traitements de première ligne.
À l’issue de ce bilan, les fausses pollakiuries liées à une polyurie sont corrigées, et les principaux diagnostiques différentiels écartés : cystite bactérienne (brûlures mictionnelles et ECBU positif), hyperactivité vésicale (urgenturies avec fuites mictionnelles et contraction détrusorienne involontaire au bilan urodynamique), autres syndromes douloureux pelviens (territoire douloureux différent, absence de lien entre les symptômes et le remplissage ou la vidange vésicale, pas de pollakiurie si diurèse normale).
Quel traitement est recommandé ?
Comme souvent en médecine, les traitements sont symptomatiques quand la physiopathologie reste inconnue et que la cause n’est pas identifiée.
Pas de consensus
La liste des traitements pour le SDV/CI qui ont fait l’objet d’études scientifiques dans la littérature médicale est impressionnante ; ils sont repris sans discernement par les sociétés savantes internationales dans leurs recommandations : celles de l’European Association of Urology7 ou, surtout, celles de l’International Painful Bladder Foundation. Il n’existe malheureusement pas de recommandations françaises.
Propositions du comité international de l’incontinence
Pour exemple, le dernier rapport de la Consultation internationale du comité de l’incontinence consacré à la cystite interstitielle/syndrome de la douleur vésicale8 distingue quatre lignes de traitement.
Mesures générales et d’hygiène de vie
En première ligne sont proposées des mesures non invasives d’éducation, de réduction du stress, d’ajustements alimentaires, de relaxation et de rééducation du plancher pelvien ou de consultation en cas de maladie associée.
En pratique, ces mesures sont seulement utiles quand le diagnostic est incertain. En effet, dans un vrai SDV/CI, elles ne sont pas efficaces, en dehors des ajustements alimentaires qui peuvent aider les patients sensibles en réduisant les symptômes, le nombre ou l’intensité des crises, mais exceptionnellement normaliser la situation.
En deuxième ligne, trois options
Sont ensuite proposés le test d’hydrodistension vésicale sous anesthésie, des traitements oraux ou intravésicaux.
Test d’hydrodistension vésicale
Ce test d’hydrodistension vésicale permet de mettre en évidence des lésions ulcéreuses ou inflammatoires. Ces patients relèvent d’un traitement endoscopique des ulcères par fulguration ou résection complète, qui les soulage instantanément. Ils ne seront pas soulagés par une simple biopsie dont il n’est ainsi pas possible de se contenter.
Malheureusement, on ne sait pas éviter la récidive de ces ulcères actuellement et pour éviter les résections répétitives, la cystectomie avec dérivation urinaire est une bonne option ; elle reste néanmoins légitimement difficile à accepter par les patients.
Traitements oraux
Les traitements oraux décrits dans ces recommandations sont nombreux mais sans ordre de priorité.
Le seul traitement oral ayant obtenu une autorisation de mise sur le marché (AMM) en France pour le SDV/CI est le pentosane polysulfate sodique à la dose de 3 fois 100 mg/j. Il est onéreux (plus de 500 euros par mois) et mal remboursé (taux à 15 %). Il est donc primordial pour les patients éligibles à ce traitement de demander auprès de l’Assurance maladie une mise en ALD hors liste pour le SDV/CI, en motivant la demande par le caractère non substituable et onéreux de ce traitement de longue durée. En effet, il n’existe pas de critère de guérison de cette maladie et le traitement doit être pris au très long cours. Une surveillance ophtalmologique régulière est requise pour dépister d’éventuelles maculopathies induites. Les nombreux effets indésirables de ce traitement (maux de tête, étourdissements, nausées, diarrhée, dyspepsie, douleurs abdominales, hypertrophie de l’abdomen, hémorragie rectale, œdèmes périphériques, alopécie, maux de dos, asthénie) le font souvent abandonner par les patients.
D’autres traitements oraux peuvent moduler la perception de la douleur (amitriptyline, prégabaline, gabapentine, hydroxyzine…), mais ils sont souvent mal tolérés.
Enfin, la cimétidine (2 fois 200 mg/j) a fait l’objet de deux études randomisées déjà anciennes et peut parfois aider. La ciclosporine A peut également être utilisée.
Traitements intravésicaux
Ils sont nombreux et facilement accessibles en France.
À titre d’exemple, le diméthylsulfoxyde peut être cité. Il est obtenu à titre compassionnel via le logiciel e-Saturne de l’Agence nationale de la sécurité du médicament et des produits de santé (ANSM). Dans une étude rétrospective avec plus de onze ans de recul en moyenne, les trois quarts des patients traités étaient satisfaits de leur prise en charge, avec une bonne efficacité sur les douleurs ressenties.9 Cependant, le laboratoire qui le commercialise n’en fait plus la promotion et aucune étude récente ne l’a utilisé, ce qui le fait disparaître peu à peu des recommandations internationales. Ce traitement a également la réputation justifiée d’exacerber les symptômes dès son administration dans la vessie, empêchant de le garder pendant l’heure requise. Notre équipe a démontré que l’administrer en ambulatoire, sous anesthésie générale pour les patients intolérants, permettait de garder le produit au contact de la muqueuse vésicale pendant l’heure requise, en observant le même taux de satisfaction de 75 %.10
D’autres produits à base de sulfate de chondroïtine, d’acide hyaluronique ou d’héparine, qui sont les glycosaminoglycanes composant la couche superficielle de la vessie, peuvent également être proposés. Ces produits ne sont pas remboursés par la Sécurité sociale mais ont démontré une efficacité similaire à celle du diméthylsulfoxyde.11
Le bacille Calmette et Guérin (BCG) a également été employé, avec des résultats très hétérogènes ne permettant pas de le proposer en routine.
Traitements de troisième ligne : peu de données
Il s’agit de la neuromodulation des racines sacrées et de l’injection de toxine botulinique dans le détrusor et/ou l’inclusion dans un protocole de recherche clinique. Comme pour beaucoup de traitements du SDV/CI, de nombreuses études ont été publiées sur le sujet et semblent montrer une efficacité chez une partie des patients, mais avec des méthodologies souvent pauvres, des suivis courts et sans que cela ne soit intégré dans une prise en charge globale.
La chirurgie en dernier recours
La quatrième ligne de traitement regroupe les traitements chirurgicaux : cystectomie totale avec dérivation urinaire ou cystectomie sus-trigonale et entérocystoplastie d’agrandissement.
Ces traitements sont adaptés aux patients avec des cystites ulcéreuses fréquemment récidivantes ou trop étendues et/ou qui ne peuvent être améliorés par les résections endoscopiques itératives. Le soulagement de la douleur est possible mais au prix d’une chirurgie plus complexe et mutilante.
Dans le SDV/CI sans ulcères, les résultats de ces cystectomies sont, en revanche, décevants. Ces traitements ne doivent être réalisés que dans les centres très spécialisés en cas de cystites ulcéreuses et de façon très exceptionnelle dans le SDV/CI sans ulcère, après échec de nombreux autres traitements et une évaluation rigoureuse du patient.
Au total, la littérature scientifique et les recommandations ne fournissent que peu ou pas de stratégie thérapeutique (un ordre ou une préférence de traitement). La combinaison cimétidine-instillations endovésicales de diméthylsulfoxyde-traitement per os de pentosane polysulfate de sodium est l’une des seules à avoir été publiée.9
Que dire à vos patients ?
Le syndrome de la douleur vésicale ou cystite interstitielle (SDV/CI) est une maladie dont la physiopathologie n’est pas clairement identifiée mais qui est facile à diagnostiquer par l’interrogatoire. Elle peut être confirmée par un bilan urodynamique et une cystoscopie sous anesthésie générale avec hydrodistension. Un signe clinique est quasiment pathognomonique : le soulagement bref lors de la miction. Un signe urodynamique est très caractéristique : l’hypersensibilité vésicale.
La maladie évolue souvent par crises, avec parfois des rémissions spontanées ; elle nécessite le plus souvent un traitement au long cours qui est à définir par l’urologue.Le SDV/CI est une maladie pour laquelle il n’existe que des traitements symptomatiques. Le seul traitement per os qui détient l’AMM en France pour cette maladie est onéreux et très mal remboursé.
Il existe des associations de patients pour le SDV/CI qui peuvent orienter vers les centres ayant l’expérience de cette maladie, à défaut de liste nationale des centres experts (Marseille, Nantes, Paris [hôpitaux Saint-Louis et La Pitié-Salpêtrière], Strasbourg et Toulouse).
2. Davis NF, Gnanappiragasam S, Thornhill JA. Interstitial cystitis/painful bladder syndrome: The influence of modern diagnostic criteria on epidemiology and on Internet search activity by the public. Transl Androl Urol 2015;4(5):506-11.
3. Kairys AE, Schmidt-Wilcke T, Puiu T, et al. Increased brain gray matter in the primary somatosensory cortex is associated with increased pain and mood disturbance in patients with interstitial cystitis/painful bladder syndrome. J Urol 2015;193(1):131-7.
4. Allen-Brady K, Rowe K, Cessna M, et al. Significant Linkage Evidence for Interstitial Cystitis/Painful Bladder Syndrome on Chromosome 3. J Urol 2018;199(1):172-7.
5. Kaga K, Inoue KI, Kaga M, et al. Expression profile of urothelial transcription factors in bladder biopsies with interstitial cystitis. Int J Urol 2017;24(8):632-8.
6. Fall M, Nordling J, Cervigni M, et al. Hunner lesion disease differs in diagnosis, treatment and outcome from bladder pain syndrome: An ESSIC working group report. Scand J Urol 2020;54(2):91-8.
7. EAU Guidelines. Edn. presented at the EAU Annual Congress, Madrid 2025. ISBN 978-94-92671-29-5. EAU Guidelines Office, Arnhem, The Netherlands. http://uroweb.org/guidelines/compilations-of-all-guidelines/
8. Hanno P, Cervigni M, Choo MS, et al. Summary of the 2023 report of the international consultation on incontinence interstitial cystitis/bladder pain syndrome (IC/BPS) committee. Continence 2023;8:101056.
9. de Cian M, Tricard T, Saussine C. Bladder pain syndrome: Long-term results (15 years) of a single-center experience. Prog Urol 2022;32(10):681-90.
10. Gaullier M, Tricard T, Mouracade P, et al. The dimethyl sulfoxide under general anesthesia: An alternative after failure without anesthesia in the painful bladder syndrome/interstitial cystitis? Prog Urol 2018;28(7):382-6.
11. Keane J, Young N, Goh J, et al. A comparison of two intravesical bladder instillations for interstitial cystitis/bladder pain syndrome. Eur J Obstet Gynecol Reprod Biol 2021;256:230-4.

 Encadrés
Encadrés