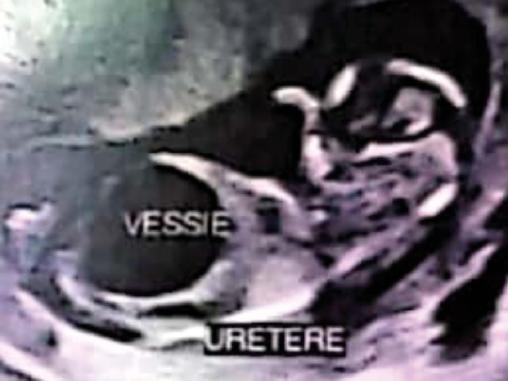
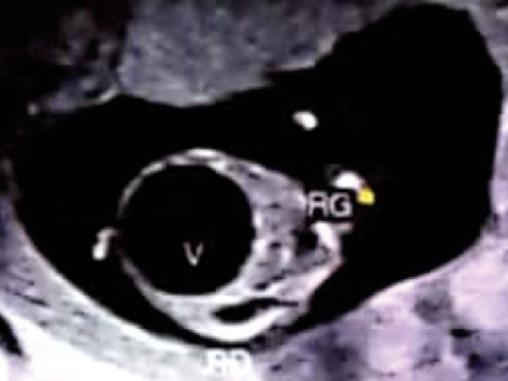
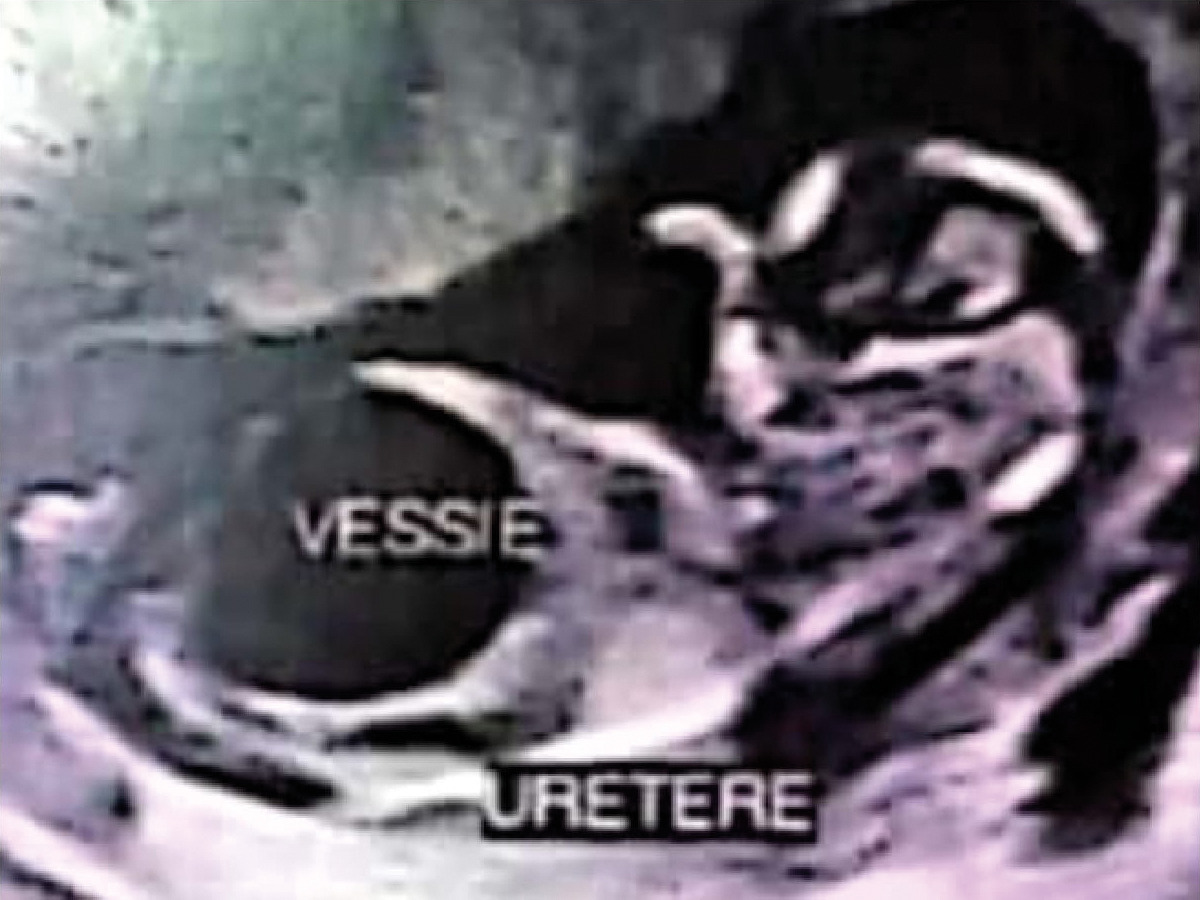
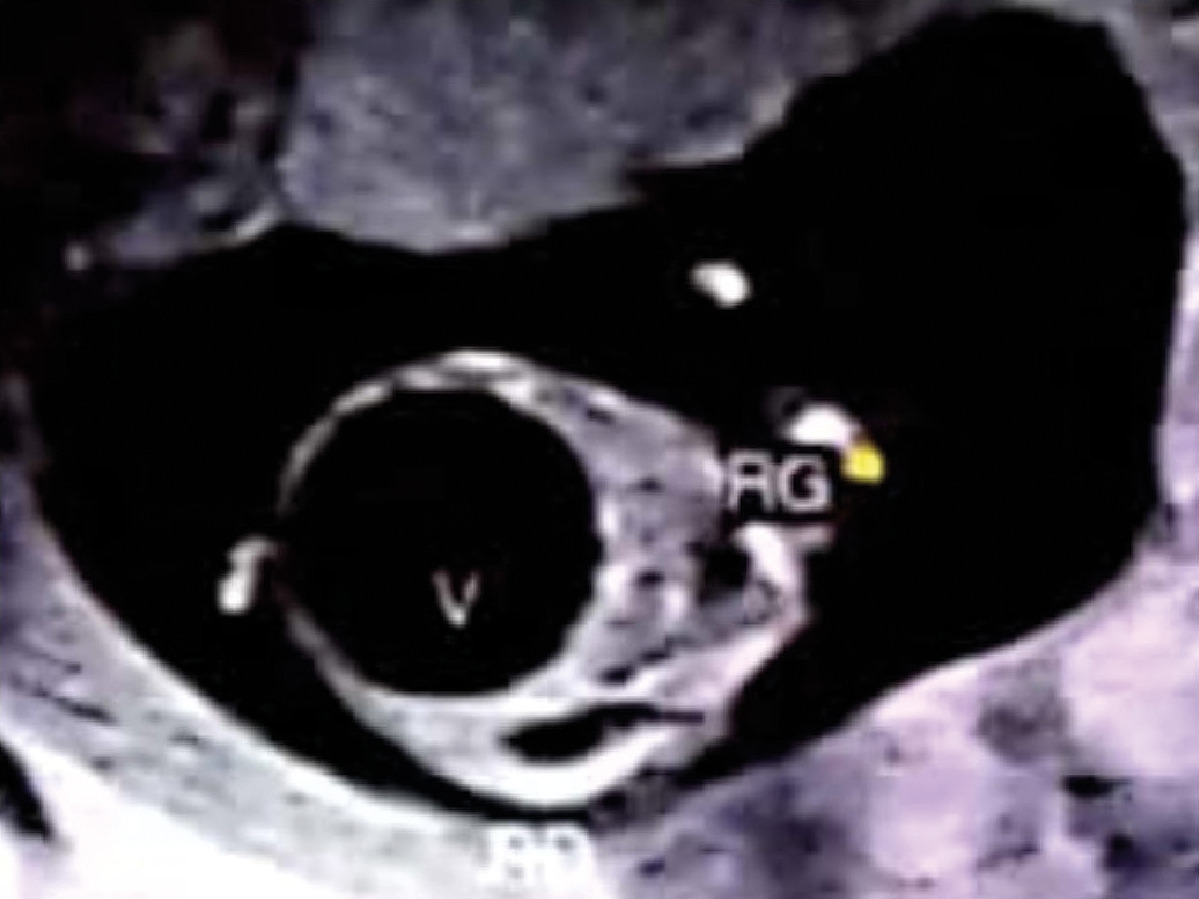
Une patiente âgée de 22 ans, primigeste, sans antécédents particuliers, est adressée au service de gynécologie-obstétrique à 13 semaines d’aménorrhée (SA) à la suite de la découverte échographique fortuite d’une mégavessie fœtale. L’échographie de cette grossesse monofœtale évolutive montre un fœtus de sexe masculin, avec une volumineuse image kystique anéchogène comblant tout l’abdomen, refoulant le diaphragme, avec une paroi très fine, correspondant à la vessie, sans signe du « trou de serrure », ainsi qu’une urétérohydronéphrose bilatérale associée à une dilatation pyélocalicielle et des reins hyperéchogènes avec une différenciation conservée. La paroi abdominale est extrêmement fine, le liquide amniotique diminué (fig. 1 et 2).
Le diagnostic de syndrome de prune belly (SPB) est fortement suspecté. Une imagerie par résonance magnétique (IRM) fœtale est réalisée qui ne montre aucune autre malformation associée. Le diagnostic de SPB est donc retenu.
À 15 SA, la patiente est réadmise pour une menace d’avortement sévère, conduisant à l’expulsion d’un fœtus mâle non viable. L’examen clinique montre une paroi abdominale flasque, une masse importante occupant la quasi-totalité de l’abdomen correspondant à la vessie, sans autre anomalie associée. Le rapport anatomo-pathologique a révélé une aplasie musculaire de la paroi abdominale et une surdistension vésicale, confirmant a posteriori le diagnostic de SPB.
Le diagnostic de syndrome de prune belly (SPB) est fortement suspecté. Une imagerie par résonance magnétique (IRM) fœtale est réalisée qui ne montre aucune autre malformation associée. Le diagnostic de SPB est donc retenu.
À 15 SA, la patiente est réadmise pour une menace d’avortement sévère, conduisant à l’expulsion d’un fœtus mâle non viable. L’examen clinique montre une paroi abdominale flasque, une masse importante occupant la quasi-totalité de l’abdomen correspondant à la vessie, sans autre anomalie associée. Le rapport anatomo-pathologique a révélé une aplasie musculaire de la paroi abdominale et une surdistension vésicale, confirmant a posteriori le diagnostic de SPB.
Références
1. Alhawsawi AM, Aljiffry M, Walsh MJ, et al. Hepatic artery aneurysm associated with Prune Belly syndrome: A case report and review of the literature. J Surg Educ 2009;66:43-7.
2. Herman TE, Siegel MJ. Prune Belly syndrome. J Perinatol 2009;29:69-71.
3. Papantoniou N, Papoutsis D, Daskalakis G, et al. Prenatal diagnosis of Prune-Belly syndrome at 13 weeks of gestation: Case report and review of literature. J Matern Fetal Neonatal Med 2010;23:1263-7.
4. Hoshino T, Ihara Y, Shirane H. Prenatal diagnosis of Prune Belly syndrome at 12 weeks of pregnancy: Case report and review of the literature. Ultrasound Obstet Gynecol 1998;12:362-6.
5. Megan M, Bogart MD, Holly E, et al. Prune Belly syndrome in two children and review of the literature. Pediatr Dermatol 2006;23:324-45.
6. Romero R, Pilu G, Jeanty P, et al. Prenatal diagnosis of congenital anomalies: Prune Belly syndrome.In Norwalk, CT: Appleton & Lange 1988:289-90
2. Herman TE, Siegel MJ. Prune Belly syndrome. J Perinatol 2009;29:69-71.
3. Papantoniou N, Papoutsis D, Daskalakis G, et al. Prenatal diagnosis of Prune-Belly syndrome at 13 weeks of gestation: Case report and review of literature. J Matern Fetal Neonatal Med 2010;23:1263-7.
4. Hoshino T, Ihara Y, Shirane H. Prenatal diagnosis of Prune Belly syndrome at 12 weeks of pregnancy: Case report and review of the literature. Ultrasound Obstet Gynecol 1998;12:362-6.
5. Megan M, Bogart MD, Holly E, et al. Prune Belly syndrome in two children and review of the literature. Pediatr Dermatol 2006;23:324-45.
6. Romero R, Pilu G, Jeanty P, et al. Prenatal diagnosis of congenital anomalies: Prune Belly syndrome.In Norwalk, CT: Appleton & Lange 1988:289-90
Une question, un commentaire ?