La prise en charge thérapeutique des patients souffrant d’épilepsie soulève de nombreuses questions, en particulier : quels sont les objectifs des traitements ? Quand initier un traitement ? Quel rationnel sous-tend le choix d’une molécule plutôt qu’une autre pour un patient donné ? Comment adapter le traitement en cas d’échec ? Quelles options autres que les médicaments et pour quels patients ? La façon d’appréhender ces problématiques n’est pas identique à tous les âges de la vie, avec en particulier des principes et pratiques en partie différents entre enfants et adultes. Cet article a pour objectif principal de présenter les éléments clés pour une prise en charge synergique entre les différents acteurs du suivi des patients, praticiens non neurologues, neurologues et neurologues experts en épilepsie exerçant dans des centres de recours. Comme précisé récemment par la Haute Autorité de santé (HAS),1 cette complémentarité dans le parcours de soin est un aspect primordial de la qualité de la prise en charge d’une pathologie neurologique chronique comme l’épilepsie.
Quels sont les objectifs des traitements ?
Si, au cours des trente dernières années, le nombre de molécules antiépileptiques disponibles n’a cessé d’augmenter pour atteindre une quinzaine actuellement, plusieurs aspects fondamentaux sont restés valides.2
À ce jour, l’ensemble des traitements médicamenteux disponibles correspond à des molécules « anticrises » et non « antiépileptiques » à proprement parler ou a fortiori « antiépileptogènes ». La nomenclature internationale pour désigner ces traitements parle d’ailleurs à présent explicitement d’« antiseizure drugs ». Il s’agit ainsi de traitements symptomatiques et non de traitements étiologiques. En d’autres termes, ces molécules permettent de limiter le risque de survenue d’une crise chez un patient souffrant d’épilepsie mais n’impactent pas le mécanisme physiopathologique qui est à l’origine de l’épilepsie. Dans ce contexte, aucune molécule actuellement commercialisée n’a démontré son efficacité dans la prévention de la survenue d’une épilepsie chez des patients à haut risque,3 par exemple après un traumatisme crânien sévère, expliquant qu’il n’existe aucune indication à initier un traitement en prévention primaire après un accident vasculaire, un traumatisme crânien ou une neurochirurgie. De même, il n’existe aucune évidence permettant d’envisager que les molécules disponibles sont à même de modifier l’évolution naturelle de la maladie chez un patient souffrant d’épilepsie.
Malgré des variabilités de la réponse individuelle d’un patient donné à telle ou telle molécule et des différences entre syndromes et causes des épilepsies,1 la proportion de patients souffrant d’épilepsie pharmacorésistante n’a pas été modifiée et reste autour de 33 %.4 Ainsi, les nouvelles molécules ont apporté une plus grande maniabilité et une meilleure gestion des effets indésirables, mais n’ont pas fait la preuve, à l’échelle de la population, d’une plus grande efficacité que les antiépileptiques d’ancienne génération. Il est néanmoins important de rappeler que la pharmacorésistance se définit exclusivement par la persistance de crises malgré l’essai d’au moins deux molécules différentes, utilisées dans la bonne indication épileptologique et à des posologies optimales.5 Ainsi, le terme de pharmacorésistance est descriptif et ne préjuge pas de la sévérité et/ou du handicap de l’épilepsie. Un patient qui, malgré les traitements, présente cinq crises par an répond à la même définition de pharmacorésistance qu’un patient souffrant de plusieurs crises par semaine.
En parallèle de ces éléments, le handicap dans l’épilepsie est multifactoriel, incluant les crises et les conséquences directes, dont le risque traumatique ou celui, rare mais réel, de mort soudaine inattendue dans l’épilepsie,6 mais également tous les autres aspects liés à l’épilepsie, dont les comorbidités cognitives ou psychiatriques [lire « Épilepsie et troubles psychiatriques (ÉPI-Psy) »page 985 ]. Dans ce contexte, si la qualité de vie chez un patient qui débute une épilepsie est essentiellement tributaire du contrôle complet des crises, la situation est différente chez les patients avec une épilepsie pharmacorésistante. Chez ces derniers, la qualité de vie est fortement liée aux complications cognitives et psychiatriques et aux effets indésirables des médicaments.7
Tous ces éléments étant pris en compte, il est aisé d’envisager que les objectifs thérapeutiques varient avec le temps :
À ce jour, l’ensemble des traitements médicamenteux disponibles correspond à des molécules « anticrises » et non « antiépileptiques » à proprement parler ou a fortiori « antiépileptogènes ». La nomenclature internationale pour désigner ces traitements parle d’ailleurs à présent explicitement d’« antiseizure drugs ». Il s’agit ainsi de traitements symptomatiques et non de traitements étiologiques. En d’autres termes, ces molécules permettent de limiter le risque de survenue d’une crise chez un patient souffrant d’épilepsie mais n’impactent pas le mécanisme physiopathologique qui est à l’origine de l’épilepsie. Dans ce contexte, aucune molécule actuellement commercialisée n’a démontré son efficacité dans la prévention de la survenue d’une épilepsie chez des patients à haut risque,3 par exemple après un traumatisme crânien sévère, expliquant qu’il n’existe aucune indication à initier un traitement en prévention primaire après un accident vasculaire, un traumatisme crânien ou une neurochirurgie. De même, il n’existe aucune évidence permettant d’envisager que les molécules disponibles sont à même de modifier l’évolution naturelle de la maladie chez un patient souffrant d’épilepsie.
Malgré des variabilités de la réponse individuelle d’un patient donné à telle ou telle molécule et des différences entre syndromes et causes des épilepsies,1 la proportion de patients souffrant d’épilepsie pharmacorésistante n’a pas été modifiée et reste autour de 33 %.4 Ainsi, les nouvelles molécules ont apporté une plus grande maniabilité et une meilleure gestion des effets indésirables, mais n’ont pas fait la preuve, à l’échelle de la population, d’une plus grande efficacité que les antiépileptiques d’ancienne génération. Il est néanmoins important de rappeler que la pharmacorésistance se définit exclusivement par la persistance de crises malgré l’essai d’au moins deux molécules différentes, utilisées dans la bonne indication épileptologique et à des posologies optimales.5 Ainsi, le terme de pharmacorésistance est descriptif et ne préjuge pas de la sévérité et/ou du handicap de l’épilepsie. Un patient qui, malgré les traitements, présente cinq crises par an répond à la même définition de pharmacorésistance qu’un patient souffrant de plusieurs crises par semaine.
En parallèle de ces éléments, le handicap dans l’épilepsie est multifactoriel, incluant les crises et les conséquences directes, dont le risque traumatique ou celui, rare mais réel, de mort soudaine inattendue dans l’épilepsie,6 mais également tous les autres aspects liés à l’épilepsie, dont les comorbidités cognitives ou psychiatriques [lire « Épilepsie et troubles psychiatriques (ÉPI-Psy) »
Tous ces éléments étant pris en compte, il est aisé d’envisager que les objectifs thérapeutiques varient avec le temps :
- en début de maladie, l’objectif principal est d’assurer le contrôle complet des crises, en limitant bien sûr le risque d’effets indésirables des traitements ;
- chez les patients qui auraient malheureusement évolué vers une pharmacorésistance, les objectifs sont à moduler à l’échelle individuelle afin de cibler la qualité de vie. Ceci explique que, dans bon nombre de situations, il y ait un choix partagé entre le patient et son médecin pour ne pas aller plus loin dans l’escalade thérapeutique afin de ne pas accentuer les effets indésirables des traitements qui deviendraient plus délétères que la fréquence des crises.
Quand initier un traitement ?
Le premier élément à rappeler est l’absence d’indication à mettre en place un traitement à visée préventive. Par ailleurs, il n’y a pas d’indication à maintenir un traitement au long cours chez un patient qui aurait présenté une crise situationnelle (ou crise provoquée). L’un des exemples classiques est celui d’un patient ayant présenté une crise à la phase aiguë d’un accident vasculaire cérébral (AVC). Si un traitement est parfois poursuivi quelques semaines, il n’est pas légitime de le maintenir au long cours, puisque le critère d’épilepsie n’est pas rempli. Un traitement ne serait à discuter que si une crise spontanée survenait à distance de l’AVC.
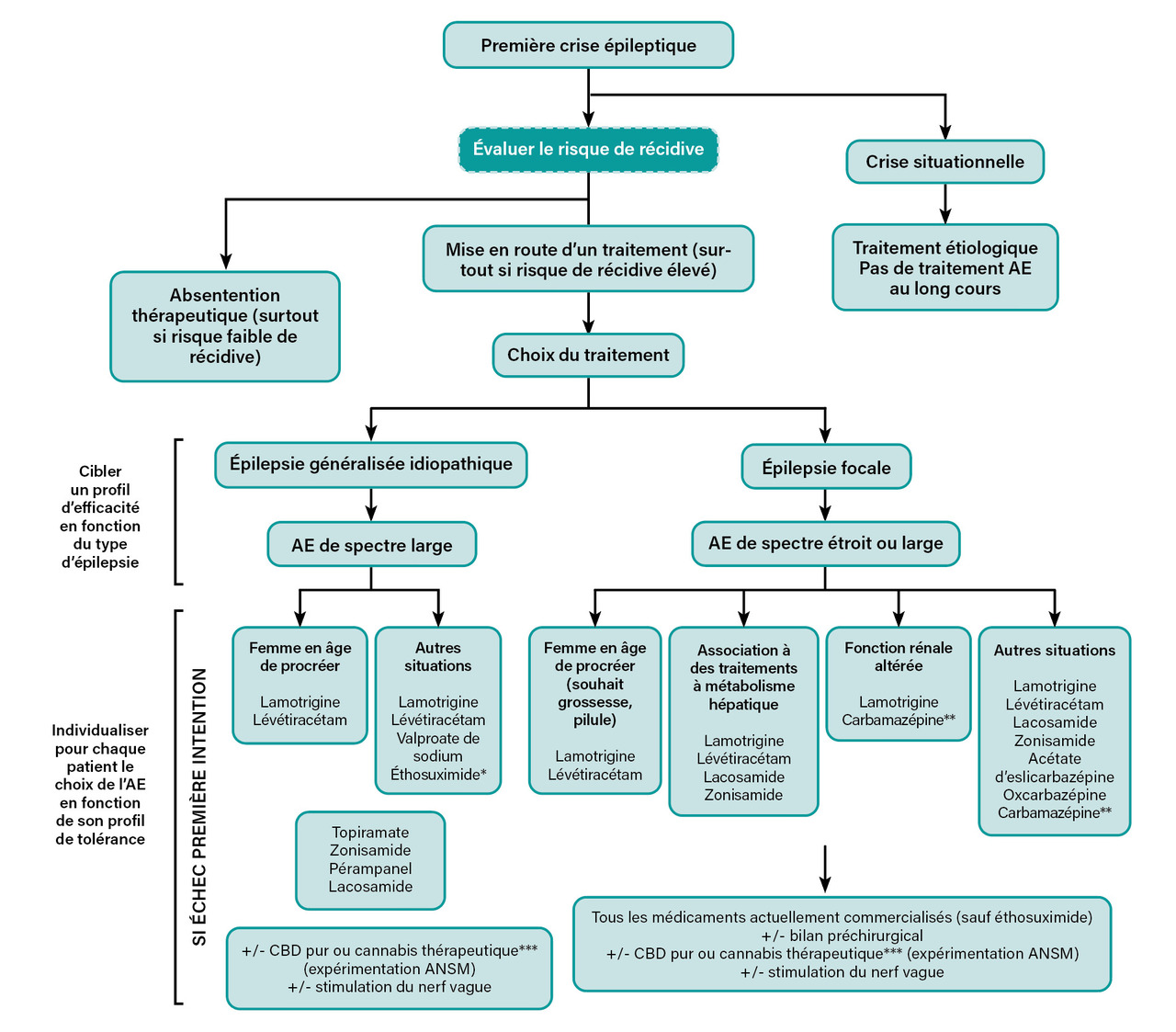
Chez un patient qui présente une première crise spontanée, l’indication de traitement prend en compte le risque de récidive, le risque d’effets indésirables des traitements et la volonté du patient, qui est un point fondamental. En effet, pour un risque de récidive identique, le choix final du patient peut varier. Dans la mesure où la mise en place d’un traitement n’assure jamais une protection de 100 % et l’abstention un risque de 100 %, il est essentiel de donner l’information la plus claire possible afin que le patient puisse décider avec le praticien de ce qu’il préfère en fonction de son appréhension du risque et surtout en fonction de la possibilité de cadrer la gestion de la crise si une récidive devait survenir. L’évaluation du risque de récidive doit prendre en compte le nombre de crises réellement survenues, le résultat de l’électroencéphalogramme (EEG), l’existence d’une lésion épileptogène.8 Le nombre de crises réellement survenues renvoie au fait qu’il est courant qu’un patient consulte pour ce qui est considéré comme une première crise, mais qu’à l’interrogatoire on retrouve d’autres épisodes survenus par le passé, en particulier dans des épilepsies focales ou dans l’épilepsie myoclonique juvénile.
Chez un patient à faible risque – une seule et unique crise, avec un EEG et une imagerie normaux –, le risque de récidive à deux ans sans traitement est de l’ordre de 25 % versus 20 % avec un traitement immédiat,8 expliquant que l’abstention soit ici régulière.
À l’inverse, chez les patients à haut risque – plusieurs crises par le passé, EEG avec anomalies épileptiques et/ou lésion épileptogène à l’imagerie par résonance magnétique (IRM) –, le risque de récidive à deux ans sans traitement est de l’ordre de 60 % versus 35 à 40 % avec un traitement immédiat,8 justifiant que le traitement soit recommandé, même si certains patients peuvent finalement faire le choix d’attendre la récidive d’une crise spontanée.
Chez un patient qui présente une première crise spontanée, l’indication de traitement prend en compte le risque de récidive, le risque d’effets indésirables des traitements et la volonté du patient, qui est un point fondamental. En effet, pour un risque de récidive identique, le choix final du patient peut varier. Dans la mesure où la mise en place d’un traitement n’assure jamais une protection de 100 % et l’abstention un risque de 100 %, il est essentiel de donner l’information la plus claire possible afin que le patient puisse décider avec le praticien de ce qu’il préfère en fonction de son appréhension du risque et surtout en fonction de la possibilité de cadrer la gestion de la crise si une récidive devait survenir. L’évaluation du risque de récidive doit prendre en compte le nombre de crises réellement survenues, le résultat de l’électroencéphalogramme (EEG), l’existence d’une lésion épileptogène.8 Le nombre de crises réellement survenues renvoie au fait qu’il est courant qu’un patient consulte pour ce qui est considéré comme une première crise, mais qu’à l’interrogatoire on retrouve d’autres épisodes survenus par le passé, en particulier dans des épilepsies focales ou dans l’épilepsie myoclonique juvénile.
Chez un patient à faible risque – une seule et unique crise, avec un EEG et une imagerie normaux –, le risque de récidive à deux ans sans traitement est de l’ordre de 25 % versus 20 % avec un traitement immédiat,8 expliquant que l’abstention soit ici régulière.
À l’inverse, chez les patients à haut risque – plusieurs crises par le passé, EEG avec anomalies épileptiques et/ou lésion épileptogène à l’imagerie par résonance magnétique (IRM) –, le risque de récidive à deux ans sans traitement est de l’ordre de 60 % versus 35 à 40 % avec un traitement immédiat,8 justifiant que le traitement soit recommandé, même si certains patients peuvent finalement faire le choix d’attendre la récidive d’une crise spontanée.
Comment choisir une molécule pour un patient donné ?
Une fois posée l’indication d’initier un traitement, le choix de la molécule repose sur la combinaison de deux questions :
- compte tenu de l’épilepsie de ce patient, quelle(s) molécule(s) parmi celles disponibles serai(en)t la(les) plus efficace(s) ?
- parmi ces molécules potentiellement efficaces, quelle est celle dont le profil de tolérance est le plus adapté à ce patient spécifique ?
Profils d’efficacité
De manière schématique, les antiépileptiques sont classés en molécules à large spectre et molécules à spectre étroit (tableau ), les premières pouvant être utilisées dans toutes les formes d’épilepsie quand les secondes sont préconisées principalement dans les épilepsies focales en raison du risque d’aggravation de certaines crises dans les épilepsies généralisées idiopathiques. Dans ce contexte, s’agissant de l’efficacité, l’élément décisionnel principal est le diagnostic syndromique.
Dans les épilepsies généralisées idiopathiques de l’adulte, les molécules ayant démontré leur efficacité en monothérapie sont le valproate de sodium, la lamotrigine et le lévétiracétam, auxquels s’ajoute l’éthosuximide dans les épilepsies-absences de l’enfant. Un point important est la démonstration claire que dans ces formes d’épilepsie avec crises tonico-cloniques généralisées, et en particulier l’épilepsie myoclonique juvénile, le valproate de sodium a, sans ambiguïté, démontré une plus grande efficacité que les deux autres,9,10 notamment en prenant en compte le risque d’aggravation des myoclonies sous lamotrigine. Pour autant, il est évident que cette meilleure efficacité ne peut en aucun cas justifier de proposer du valproate de sodium chez une jeune femme, en raison des risques démontrés pour les enfants exposés in utero.
Dans les épilepsies focales, la situation est différente. En effet, en matière d’efficacité, il n’existe aucune différence significative entre les molécules suivantes : carbamazépine, lamotrigine, lévétiracétam, lacosamide, zonisamide, oxcarbazépine et acétate d’eslicarbazépine.
Dans les épilepsies généralisées idiopathiques de l’adulte, les molécules ayant démontré leur efficacité en monothérapie sont le valproate de sodium, la lamotrigine et le lévétiracétam, auxquels s’ajoute l’éthosuximide dans les épilepsies-absences de l’enfant. Un point important est la démonstration claire que dans ces formes d’épilepsie avec crises tonico-cloniques généralisées, et en particulier l’épilepsie myoclonique juvénile, le valproate de sodium a, sans ambiguïté, démontré une plus grande efficacité que les deux autres,9,10 notamment en prenant en compte le risque d’aggravation des myoclonies sous lamotrigine. Pour autant, il est évident que cette meilleure efficacité ne peut en aucun cas justifier de proposer du valproate de sodium chez une jeune femme, en raison des risques démontrés pour les enfants exposés in utero.
Dans les épilepsies focales, la situation est différente. En effet, en matière d’efficacité, il n’existe aucune différence significative entre les molécules suivantes : carbamazépine, lamotrigine, lévétiracétam, lacosamide, zonisamide, oxcarbazépine et acétate d’eslicarbazépine.
Profils de tolérance
L’élément majeur du choix final est le profil de sécurité du traitement pour le patient spécifique chez lequel il est initié. Ce profil est évalué en fonction du genre du patient, de ses antécédents médicaux, dont le risque d’interactions médicamenteuses, et des éventuelles comorbidités.
S’agissant du genre, la question est essentiellement celle des risques liés aux traitements chez les jeunes femmes en âge de procréer. Cet aspect est critique et doit toujours être pris en compte. Plusieurs traitements – en particulier le valproate de sodium, le topiramate et la carbamazépine – augmentent de manière significative le risque de malformation majeure par rapport à la population générale.11 Par ailleurs, plusieurs de ces mêmes traitements augmentent également de manière significative le risque de difficultés des apprentissages, retard mental et syndrome autistique. Pour ces raisons, le valproate de sodium, le topiramate et la carbamazépine ne peuvent pas être proposés en première ligne. De plus, un protocole de soins précisant spécifiquement ces points et cosigné une fois par an par la patiente et son neurologue est obligatoire pour la prescription et la délivrance de valproate de sodium ou de topiramate. Tous ces éléments ont bénéficié d’une synthèse de la HAS en 2023.1
Pour les hommes avec épilepsie, une alerte de l’Agence européenne du médicament est diffusée (mais sans données scientifiques valides publiques), et l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) a publié une information de sécurité en novembre 2023 indiquant que « l’utilisation de ces médicaments (valproate de sodium et dérivés) dans les trois mois précédant la conception d’un enfant pourrait exposer celui-ci à un potentiel risque de troubles neurodéveloppementaux ».12 Une étude récente est rassurante, mais l’ANSM est en cours d’évaluation des mesures à adopter chez l’homme.
Les principales précautions à prendre sont les suivantes (figure ) :
S’agissant du genre, la question est essentiellement celle des risques liés aux traitements chez les jeunes femmes en âge de procréer. Cet aspect est critique et doit toujours être pris en compte. Plusieurs traitements – en particulier le valproate de sodium, le topiramate et la carbamazépine – augmentent de manière significative le risque de malformation majeure par rapport à la population générale.11 Par ailleurs, plusieurs de ces mêmes traitements augmentent également de manière significative le risque de difficultés des apprentissages, retard mental et syndrome autistique. Pour ces raisons, le valproate de sodium, le topiramate et la carbamazépine ne peuvent pas être proposés en première ligne. De plus, un protocole de soins précisant spécifiquement ces points et cosigné une fois par an par la patiente et son neurologue est obligatoire pour la prescription et la délivrance de valproate de sodium ou de topiramate. Tous ces éléments ont bénéficié d’une synthèse de la HAS en 2023.1
Pour les hommes avec épilepsie, une alerte de l’Agence européenne du médicament est diffusée (mais sans données scientifiques valides publiques), et l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) a publié une information de sécurité en novembre 2023 indiquant que « l’utilisation de ces médicaments (valproate de sodium et dérivés) dans les trois mois précédant la conception d’un enfant pourrait exposer celui-ci à un potentiel risque de troubles neurodéveloppementaux ».12 Une étude récente est rassurante, mais l’ANSM est en cours d’évaluation des mesures à adopter chez l’homme.
Les principales précautions à prendre sont les suivantes (
- éviter les molécules inductrices enzymatiques chez les patients traités avec des médicaments à métabolisme hépatique, dont la contraception orale ou les chimiothérapies. Par ailleurs, il existe actuellement des éléments faisant suspecter qu’en raison de leur impact sur le métabolisme lipidique, les traitements inducteurs enzymatiques pourraient augmenter le risque athéromateux à long terme. Bien que ceci ne soit pas formellement démontré, en particulier concernant le risque d’événements cardio- ou neurovasculaires graves, il peut être prudent de ne pas initier en première intention un médicament inducteur enzymatique ;
- éviter les molécules à élimination urinaire sous forme active, dont le lévétiracétam, chez les patients avec insuffisance rénale chronique sévère ;
- éviter les molécules pour lesquelles il existe un risque – bien que rare – de réaction cutanée sévère (lamotrigine, carbamazépine, oxcarbazépine, acétate d’eslicarbazépine) chez les patients aux antécédents allergiques graves ;
- éviter les molécules qui pourraient aggraver une comorbidité particulière. Plusieurs exemples classiques peuvent être cités :
- le lévéricétam est fréquemment associé à des effets indésirables psychiatriques (anxiété, irritabilité, voire syndrome dépressif sévère), et il est recommandé de préférer une molécule plus neutre chez des patients avec une comorbidité psychiatrique,
- la lamotrogine peut aggraver une pathologie migraineuse. À l’inverse, le topiramate peut apporter un bénéfice dans ce contexte, mais ceci ne s’appliquerait, le cas échéant en première intention, que chez un homme.
Modalités de prescription
S’agissant des modalités de prescription, quelques précautions sont nécessaires :
- tous les traitements antiépileptiques ont une relation effet-dose. Dans la mesure où le traitement est initié à la dose minimale efficace théorique, la première chose à proposer est d’augmenter les posologies jusqu’à pouvoir réellement juger de l’inefficacité d’une molécule ;
- si cette relation effet-dose est vraie, elle est difficile à anticiper à l’échelle individuelle et il n’existe aucune indication à la prescription d’une surveillance des taux sériques des traitements, hors cas particulier de la grossesse. En effet, il a été démontré que l’équilibre de l’épilepsie est, in fine, identique, que le traitement soit adapté sur la clinique ou de manière préventive sur la base des résultats de la surveillance biologique ;13
- il n’y a pas d’indication à prévoir de manière systématique un traitement d’urgence par benzodiazépines en cas de crises. De même, en cas de récidive d’une crise unique, l’adaptation du traitement se discute en fonction de la situation, mais il n’y a pas de justification à administrer du clobazam, y compris sur une période courte. Le recours à une benzodiazépine d’urgence est, en revanche, pertinent chez des patients qui feraient des crises prolongées ou systématiquement des crises en salves (plus de trois crises en quatre heures) ;
- si des inquiétudes ont existé initialement quant à un risque de déstabilisation de l’épilepsie en cas d’utilisation des génériques en raison de l’indice thérapeutique étroit des traitements antiépileptiques, les données accumulées depuis sont rassurantes. Actuellement, les recommandations de la Ligue française contre l’épilepsie indiquent qu’il n’y a pas de problématique pharmacologique interdisant la prescription d’un générique dans l’épilepsie débutante. Chez les patients traités au long cours depuis de nombreuses années, la situation peut parfois être plus complexe, y compris pour des raisons non pharmacologiques. Il peut donc être médicalement justifié, dans certains cas spécifiques, de maintenir la contre-indication à la substitution autorisée pour les molécules à marge thérapeutique étroite.
Comment adapter le traitement en cas d’échec ?
En général, en cas d’échec de la première monothérapie, le choix se porte vers la substitution par une autre monothérapie. Par la suite, il est fréquent de proposer des polythérapies, même s’il n’existe pas de démonstration formelle que la polythérapie fasse mieux que la succession d’essais en monothérapie. Surtout, le rationnel du choix des alternatives en matière de molécules reste identique à celui qui prévaut pour la monothérapie de première intention. Par ailleurs, en polythérapie, il n’y a pas de démonstration formelle de la supériorité de certaines molécules par rapport à d’autres.14 Ceci est vrai également pour les molécules récentes, actuellement exclusivement utilisées en polythérapie dans les épilepsies pharmacorésistantes. Ceci s’applique également au cannabidiol, autorisé dans des formes d’épilepsies sévères rares (syndrome de Dravet, syndrome de Lennox-Gastaut et maladie de Bourneville), mais qui peut aussi être proposé de manière dérogatoire par un centre de référence des épilepsies rares pour des patients avec d’autres formes d’épilepsie sévères, dans le cadre de l’expérimentation d’accès mise en place par l’ANSM. Néanmoins, dans tous les cas, et comme évoqué plus haut, l’anticipation des effets indésirables, dont l’impact sur les comorbidités, est un élément majeur de la décision dans les épilepsies pharmacorésistantes.
Quelles options au-delà des médicaments et pour quels patients ?
Chez un patient avec épilepsie pharmacorésistante, il est indispensable de se poser la question d’une prise en charge non pharmacologique. Ceci est avant tout le cas pour les patients souffrant d’épilepsie focale chez lesquels une chirurgie doit être envisagée. En effet, même si le nombre de patients réellement éligibles à une chirurgie reste limité, c’est la seule et unique approche qui peut permettre d’obtenir une réelle guérison de l’épilepsie focale. Cette évaluation de l’éligibilité doit être réalisée dans un centre avec cette compétence ;1 elle s’appuie sur une consultation et, si la situation le permet et que le patient le souhaite, sur un bilan spécifiques. Ce bilan comprend a minima une IRM encéphalique réalisée en conditions épileptologiques, un enregistrement vidéo-EEG de longue durée afin d’enregistrer les crises habituelles du patient et un bilan neuropsychologique.14 Il détermine la localisation présomptive de la zone de départ des crises, son extension et ses rapports avec des régions fonctionnelles importantes (motricité, langage, mémoire). In fine, le bilan doit permettre d’évaluer les chances de succès et les risques d’un geste chirurgical. Dans la situation classique de l’épilepsie de la face interne du lobe temporal associée à une sclérose de l’hippocampe, les chances de contrôle complet des crises à dix ans sont d’environ 75 %.15 En revanche, le bilan est plus complexe et le pronostic moins bon (50 à 60 % de patients libres de crises au long cours) dans les épilepsies extratemporales.
En cas de contre-indication à la chirurgie, dont bien sûr les patients avec épilepsie généralisée, une option non pharmacologique peut être la stimulation du nerf vague. Il s’agit d’un dispositif sous-cutané (boîtier placé sous la clavicule) avec des électrodes de stimulation sur le nerf vague gauche. Ce dispositif dispose d’une stimulation basale visant à diminuer la fréquence et/ou l’intensité des crises, complétée par une possibilité de stimulation supplémentaire par aimant ou automatique pour essayer de stopper une crise en cours. Dans tous les cas, il s’agit néanmoins d’un traitement palliatif, avec environ 50 à 60 % de patients rapportant une amélioration globale.16
En cas de contre-indication à la chirurgie, dont bien sûr les patients avec épilepsie généralisée, une option non pharmacologique peut être la stimulation du nerf vague. Il s’agit d’un dispositif sous-cutané (boîtier placé sous la clavicule) avec des électrodes de stimulation sur le nerf vague gauche. Ce dispositif dispose d’une stimulation basale visant à diminuer la fréquence et/ou l’intensité des crises, complétée par une possibilité de stimulation supplémentaire par aimant ou automatique pour essayer de stopper une crise en cours. Dans tous les cas, il s’agit néanmoins d’un traitement palliatif, avec environ 50 à 60 % de patients rapportant une amélioration globale.16
Références
1. Haute Autorité de santé. Guides du parcours de santé de l’adulte et de l’enfant avec épilepsie. Décembre 2023. https://urlz.fr/mwje
2. Perucca E, Brodie MJ, Kwan P, et al. 30 years of second-generation antiseizure medications: Impact and future perspectives. Lancet Neurol 2020;19(6):554-6.
3. Temkin NR. Antiepileptogenesis and seizure prevention trials with antiepileptic drugs: Meta-analysis of controlled trials. Epilepsia 2001;42(4):515-24.
4. Zhibin C, Brodie MJ, Liew D, et al. Treatment outcomes in patients with newly diagnosed epilepsy treated with established and new antiepileptic drugs. JAMA Neurol 2018;75(3):279-86.
5. Kwan P, Arzimanoglou A, Berg AT, et al. Definition of drug resistant epilepsy: Consensus proposal by the ad hoc Task Force of the ILAE Commission on Therapeutic Strategies. Epilepsia 2010;51(6):1069-77.
6. Devinsky O, Hesdorffer DC, Thurman DJ, et al. Sudden unexpected death in epilepsy: Epidemiology, mechanisms, and prevention. Lancet Neurol 2016;15(10):1075-88.
7. Perucca P, Carter J, Vahle V, et al. Adverse antiepileptic drug effects: Toward a clinically and neurobiologically relevant taxonomy. Neurology 2009;72(14):1223-9.
8. Kim LG, Johnson TL, Marson AG, et al. Prediction of risk of seizure recurrence after a single seizure and early epilepsy: Further results from the MESS trial. Lancet Neurol 2006;5(4):317-22.
9. Marson A, Burnside G, Appleton R, et al. The SANAD II study of the effectiveness and cost-effectiveness of valproate versus levetiracetam for newly diagnosed generalised and unclassifiable epilepsy: An open-label, non-inferiority, multicentre, phase 4, randomised controlled trial. Lancet 2021;397(10282):1375-86.
10. Marson AG, Al-Kharusi AM, Alwaidh M, et al. The SANAD study of effectiveness of valproate, lamotrigine, or topiramate for generalised and unclassifiable epilepsy: An unblinded randomised controlled trial. Lancet 2007;369(9566):1016-26.
11. ANSM. Antiépileptiques au cours de la grossesse. État actuel des connaissances sur le risque de malformations et de troubles neurodéveloppementaux. Octobre 2020. https://urlz.fr/sBln
12. ANSM. Informations de sécurité. Valproate et dérivés : risque potentiel de troubles neurodéveloppementaux chez les enfants dont le père a été traité dans les 3 mois qui précèdent la conception. 16 novembre 2023. https://urlz.fr/sGLj
13. Aícua-Rapún I, André P, Rossetti AO, et al. Therapeutic drug monitoring of newer antiepileptic drugs: A randomized trial for dosage adjustment. Ann Neurol 2020;87(1):22-9.
14. Rheims S, Perucca E, Cucherat M, et al. Factors determining response to antiepileptic drugs in randomized controlled trials. A systematic review and meta-analysis. Epilepsia 2011;52(2):219-33.
15. Ryvlin P, Cross JH, Rheims S. Epilepsy surgery in children and adults. Lancet Neurol 2014;13:1114-26.
16. Ryvlin P, Rheims S, Hirsch LJ, et al. Neuromodulation in epilepsy: State-of-the-art approved therapies. Lancet Neurol 2021;20(12):1038-47.
2. Perucca E, Brodie MJ, Kwan P, et al. 30 years of second-generation antiseizure medications: Impact and future perspectives. Lancet Neurol 2020;19(6):554-6.
3. Temkin NR. Antiepileptogenesis and seizure prevention trials with antiepileptic drugs: Meta-analysis of controlled trials. Epilepsia 2001;42(4):515-24.
4. Zhibin C, Brodie MJ, Liew D, et al. Treatment outcomes in patients with newly diagnosed epilepsy treated with established and new antiepileptic drugs. JAMA Neurol 2018;75(3):279-86.
5. Kwan P, Arzimanoglou A, Berg AT, et al. Definition of drug resistant epilepsy: Consensus proposal by the ad hoc Task Force of the ILAE Commission on Therapeutic Strategies. Epilepsia 2010;51(6):1069-77.
6. Devinsky O, Hesdorffer DC, Thurman DJ, et al. Sudden unexpected death in epilepsy: Epidemiology, mechanisms, and prevention. Lancet Neurol 2016;15(10):1075-88.
7. Perucca P, Carter J, Vahle V, et al. Adverse antiepileptic drug effects: Toward a clinically and neurobiologically relevant taxonomy. Neurology 2009;72(14):1223-9.
8. Kim LG, Johnson TL, Marson AG, et al. Prediction of risk of seizure recurrence after a single seizure and early epilepsy: Further results from the MESS trial. Lancet Neurol 2006;5(4):317-22.
9. Marson A, Burnside G, Appleton R, et al. The SANAD II study of the effectiveness and cost-effectiveness of valproate versus levetiracetam for newly diagnosed generalised and unclassifiable epilepsy: An open-label, non-inferiority, multicentre, phase 4, randomised controlled trial. Lancet 2021;397(10282):1375-86.
10. Marson AG, Al-Kharusi AM, Alwaidh M, et al. The SANAD study of effectiveness of valproate, lamotrigine, or topiramate for generalised and unclassifiable epilepsy: An unblinded randomised controlled trial. Lancet 2007;369(9566):1016-26.
11. ANSM. Antiépileptiques au cours de la grossesse. État actuel des connaissances sur le risque de malformations et de troubles neurodéveloppementaux. Octobre 2020. https://urlz.fr/sBln
12. ANSM. Informations de sécurité. Valproate et dérivés : risque potentiel de troubles neurodéveloppementaux chez les enfants dont le père a été traité dans les 3 mois qui précèdent la conception. 16 novembre 2023. https://urlz.fr/sGLj
13. Aícua-Rapún I, André P, Rossetti AO, et al. Therapeutic drug monitoring of newer antiepileptic drugs: A randomized trial for dosage adjustment. Ann Neurol 2020;87(1):22-9.
14. Rheims S, Perucca E, Cucherat M, et al. Factors determining response to antiepileptic drugs in randomized controlled trials. A systematic review and meta-analysis. Epilepsia 2011;52(2):219-33.
15. Ryvlin P, Cross JH, Rheims S. Epilepsy surgery in children and adults. Lancet Neurol 2014;13:1114-26.
16. Ryvlin P, Rheims S, Hirsch LJ, et al. Neuromodulation in epilepsy: State-of-the-art approved therapies. Lancet Neurol 2021;20(12):1038-47.