Le rhumatisme psoriasique (RP) est un rhumatisme inflammatoire chronique concernant 0,3 à 0,5 % des Français et qui survient le plus souvent entre 30 et 60 ans, autant chez les hommes que les femmes. Jusqu’à 30 % des patients atteints de psoriasis développent un RP au cours de leur vie.
Signes cliniques variables, fréquentes comorbidités et qualité de vie souvent altérée
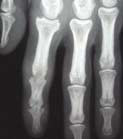
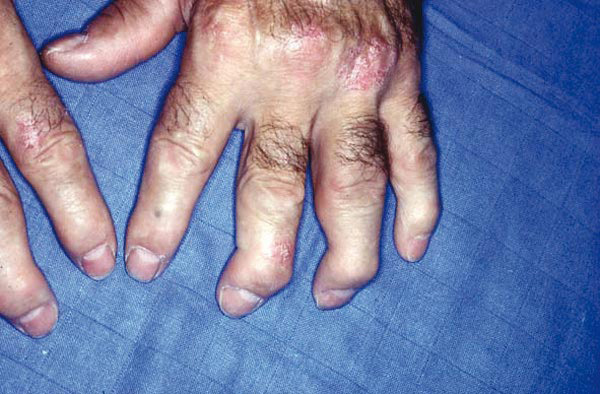
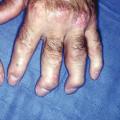
Le tableau clinique typique est constitué, chez une personne atteinte de psoriasis, par la survenue de douleurs articulaires d’horaire inflammatoire, révélant des arthrites périphériques, de forme oligoarticulaires et asymétriques le plus souvent, et pouvant atteindre les articulations interphalangiennes distales (fig. 1 et 2). Les manifestations cutanées du RP comprennent le psoriasis (généralement psoriasis en plaques) et le psoriasis unguéal, souvent marqué par un épaississement de l’ongle ressemblant à une mycose.
La présentation est variable et on y trouve des éléments du spectre des spondyloarthrites, puisque le rhumatisme psoriasique fait partie de ce groupe de maladies. On observe chez environ un tiers des patients atteints de RP, au cours de leur vie, l’apparition de dactylite (inflammation de l’ensemble d’un doigt ou d’un orteil) et /ou d’enthésite (inflammation des insertions des tendons dans l’os).
Une atteinte axiale responsable de lombalgies inflammatoires est moins fréquente et les manifestations extra-musculosquelettiques (uvéite, maladies inflammatoires chroniques de l’intestin [MICI]) sont rares.1
Le RP est fréquemment associé à des comorbidités, notamment à l’obésité (dans environ un tiers des cas) et à des éléments dysmétaboliques (diabète, hypertension, hyperlipidémie, stéatose hépatique).2,3 Les patients atteints de RP ont une qualité de vie souvent altérée ; ils rapportent des douleurs mais souvent aussi de la fatigue, des troubles du sommeil, une gêne fonctionnelle, sociale et professionnelle ;4 la dépression et l’anxiété sont fréquentes (autour de 20 % des patients).
Des recommandations thérapeutiques établies
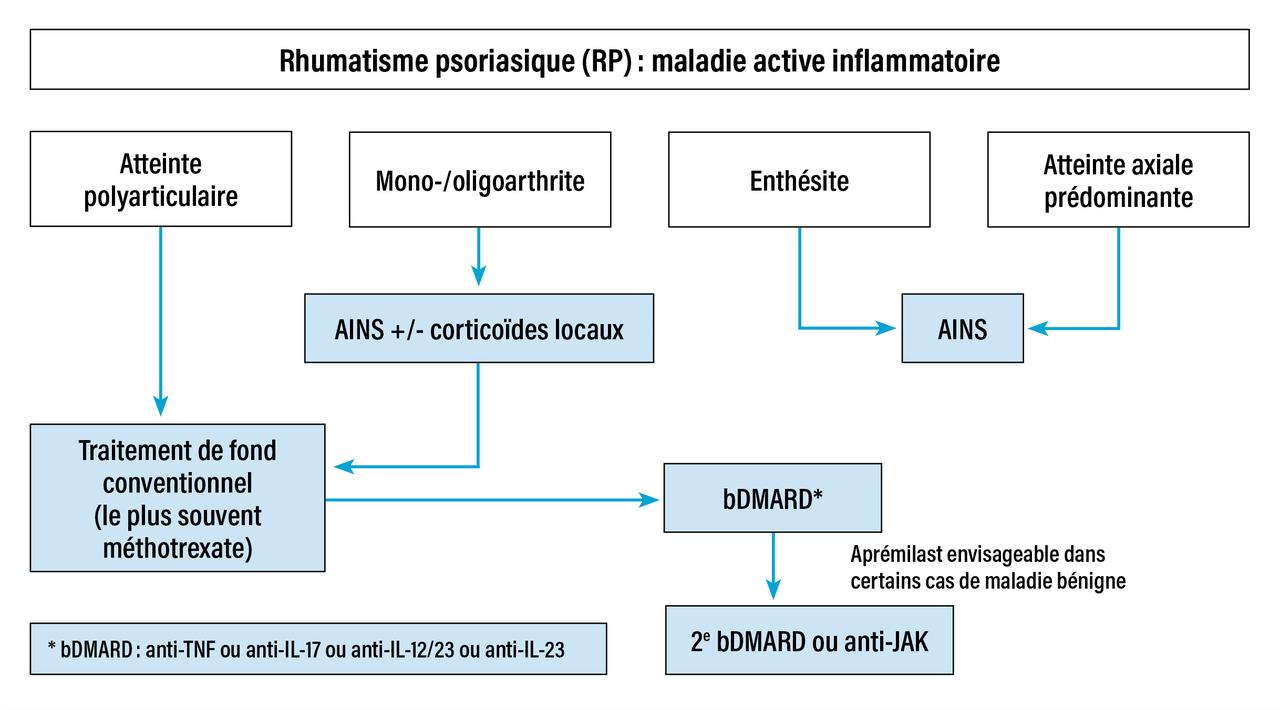
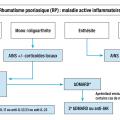
Dans cette maladie complexe et hétérogène, pour laquelle de nombreuses alternatives thérapeutiques existent (tableau), il est utile de disposer de recommandations.5 Dans cet article, nous faisons référence aux recommandations françaises de la Société française de rhumatologie (SFR)6 et aux recommandations de 2023 de l’Alliance européenne des associations de rhumatologie (Eular).7 La figure 3 reprend les grandes lignes du traitement de façon séquentielle. Les patients atteints de RP relèvent d’un suivi spécialisé par un rhumatologue, en collaboration avec le médecin traitant.7 Le rhumatologue doit réaliser un suivi régulier, généralement une à trois fois par an. Le médecin traitant assure le suivi du patient au quotidien, la prise en charge des facteurs de risque cardiovasculaire, des comorbidités et le suivi de médecine préventive. Le dermatologue peut être consulté si besoin ; cependant, l’atteinte psoriasique cutanée répond souvent bien aux traitements de fond du RP.
Dans le RP comme dans d’autres pathologies chroniques, les choix de traitement doivent être effectués en accord entre le médecin et le patient, dans le cadre d’une décision partagée.6 En effet, l’adhésion du patient au projet thérapeutique est un facteur clé pour l’acceptation des contraintes liées à ces traitements, et pour l’adhésion médicamenteuse, souvent incomplète dans les maladies chroniques.8
Une prise en charge optimale des patients atteints de RP nécessite des approches à la fois pharmacologiques et non pharmacologiques :6,7
- le traitement médicamenteux de l’atteinte articulaire peut s’associer au traitement du psoriasis cutané (par exemple avec des traitements topiques) ;
- les mesures non pharmacologiques globales incluent la possibilité de recours au dispositif lié à une affection de longue durée auprès de la Sécurité sociale, la prise en charge physique (kinésithérapie, ergothérapie) et l’éducation thérapeutique, ainsi que l’adaptation du mode de vie (lutte contre le tabagisme et l’obésité, encouragement de l’exercice physique régulier).6,7
Traitement anti-inflammatoire symptomatique en première intention
Le traitement de première intention repose essentiellement sur les anti-inflammatoires, parfois associés à une infiltration.6,7
Anti-inflammatoires non stéroïdiens
Les anti-inflammatoires non stéroïdiens (AINS) représentent la première ligne de traitement. Chez des patients avec une atteinte périphérique limitée (par exemple une monoarthrite ou une enthésite isolée) ou avec des symptômes axiaux, les AINS seuls peuvent être suffisants pour contrôler les symptômes. Cependant, le rapport bénéfice-risque des AINS doit être soigneusement pris en compte, en particulier pour les prescriptions au long cours, chez ces patients ayant des comorbidités cardiovasculaires fréquentes. Chez les patients atteints de formes polyarticulaires ou avec une forme très inflammatoire (par exemple accompagnée d’un syndrome inflammatoire biologique), un traitement de fond est très rapidement associé aux AINS.6,7
Infiltrations locales de glucocorticoïdes
Les infiltrations de corticoïdes peuvent être envisagées comme une thérapie adjuvante dans le RP.9 Elles peuvent être réalisées en intra-articulaire en cas de synovite, ou en périarticulaire à proximité d’une enthésite, par exemple pour une bursite rétrotendineuse du tendon d’Achille sur une enthésite du talon.
Ces infiltrations sont pratiquées le plus souvent sous contrôle d’imagerie (sous scopie ou sous contrôle échographique) par un rhumatologue ou un radiologue expérimenté. Elles sont efficaces après quelques jours et pendant quelques semaines ; il s’agit donc bien d’un traitement adjuvant qui doit s’accompagner d’une adaptation du traitement de fond.
Les risques comprennent une infection locale, un saignement et un manque d’efficacité. La règle générale est de ne pas dépasser trois infiltrations par an.
Un traitement par voie générale à base de cortisone (corticothérapie orale ou intraveineuse) est généralement déconseillé dans le RP, du fait du risque de poussée cutanée à la décroissance de la cortisone, et de la toxicité de la corticothérapie au long cours.6,7
Indications du traitement de fond de première intention
Dans les formes oligoarticulaires, on peut traiter avec un traitement symptomatique seul. Cependant, chez les patients atteints de forme polyarticulaire (plus de quatre synovites) ou présentant une maladie mono- ou oligo-articulaire mais avec des facteurs de mauvais pronostic (atteinte structurale à la radiographie, syndrome inflammatoire biologique, présence de dactylite ou d’atteinte des ongles), il est recommandé de commencer directement ou très rapidement un traitement de fond.6,7
Le traitement de fond de première intention repose sur les traitements dits conventionnels synthétiques (fig. 3). Trois molécules appartiennent à cette catégorie : le méthotrexate (MTX), le léflunomide et la sulfasalazine.6,7
Méthotrexate
Le MTX est considéré comme le traitement de fond de référence pour le RP périphérique chez l’adulte. Il agit en tant qu’antagoniste de l’acide folique, inhibant la prolifération cellulaire. La posologie habituelle est de 0,2 à 0,3 mg/kg en une prise par semaine, administrée par voie orale ou sous-cutanée. L’efficacité est retardée d’environ deux mois.
Pour près d’un quart des utilisateurs, le MTX est responsable d’effets indésirables à type de nausées, d’inconfort digestif, d’aphtes et de fatigue.10 Ces effets indésirables peuvent être évités en partie par l’adjonction d’acide folique (la dose recommandée est de 10 mg/semaine, administrée per os 48 heures après le MTX). Ce traitement nécessite également une surveillance biologique régulière pour détecter une pancytopénie et une cytolyse. Enfin, le MTX nécessite une contraception chez la femme et chez l’homme en raison d’un risque tératogène et de retard de croissance intra-utérin ; il est contre-indiqué pendant la grossesse et l’allaitement.11
Léflunomide
Le léflunomide est un dérivé isoxazolique avec une action immunomodulatrice et des propriétés antiprolifératives et anti-inflammatoires. La posologie habituelle est d’un comprimé à 20 mg/j. L’efficacité, comme pour le MTX, est retardée d’environ deux mois. Ce traitement nécessite également une surveillance biologique régulière, du fait d’un risque de cytolyse hépatique en particulier ; il est tératogène chez la femme et chez l’homme.
Sulfasalazine
La sulfasalazine est utilisée depuis longtemps dans les spondyloarthrites. La posologie efficace est de 4 à 6 comprimés à 500 mg/j. L’efficacité est là aussi retardée et une surveillance biologique régulière est nécessaire. La sulfasalazine est proposée dans le RP périphérique, même si peu d’études ont confirmé son efficacité, et qu’elle n’apporte pas d’amélioration sur le plan cutané.
Traitements de fond ciblés
Dans les formes périphériques de RP, en cas d’échec d’un premier traitement de fond conventionnel (cet échec peut être primaire [absence d’efficacité] ou secondaire [rechute retardée]), il est recommandé d’avoir recours à un traitement de fond ciblé.
Les patients présentant une atteinte axiale prédominante (il s’agit de formes ressemblant à une spondyloarthrite axiale) et les patients avec une atteinte enthésitique prédominante, et n’ayant pas répondu aux AINS, sont candidats directement à un traitement ciblé, sans passer par l’étape d’un traitement conventionnel synthétique.6,7,12
En France, comme d’ailleurs dans d’autres pays européens, la plupart des patients atteints de RP ont une maladie correctement contrôlée par des AINS et un traitement de fond conventionnel (la plupart des patients reçoivent une association de ces deux types de traitement) ; on peut estimer qu’environ un tiers des patients nécessitent le recours à un traitement de fond ciblé.
La prescription d’un traitement de fond ciblé relève du rhumatologue. Ces traitements ciblés ont longtemps relevé d’une prescription initiale hospitalière. Depuis le 17 avril 2024, certaines biothérapies ne sont plus soumises à cette réglementation : elles peuvent donc être initiées en ville, par les médecins spécialistes concernés.
Le nombre de traitements de fond ciblés indiqués dans le RP a beaucoup augmenté ces dernières années : biothérapies (bDMARD [disease-modifying antirheumatic drugs, médicament antirhumatismal modifiant la maladie]) avec différents modes d’action, traitements de fond dits ciblés synthétiques (targeted synthetic en anglais ou tsDMARD) [tableau].
Biothérapies
Les biothérapies sont des traitements biotechnologiques produits à partir de cellules ou de micro-organismes, avec une action très ciblée. Ils sont utilisés dans le RP et le psoriasis depuis une vingtaine d’années pour certains d’entre eux.13
Les biothérapies ont un délai d’efficacité de l’ordre de deux mois ; elles sont le plus souvent prescrites en association au MTX. Leurs effets indésirables comprennent un risque accru d’infection, en particulier des voies aériennes supérieures et des poumons. La prescription d’une biothérapie relève d’un avis spécialisé rhumatologique et nécessite une évaluation préalable pour dépister d’éventuelles infections, telles qu’une tuberculose latente ou des virus hépatotropes.11
Inhibiteurs du TNF
Les inhibiteurs du facteur de nécrose tumorale (tumor necrosis factor, TNF) ont été les premières biothérapies autorisées dans le traitement du RP. Le blocage du TNF diminue l’inflammation et prévient l’atteinte structurale provoquée par l’inflammation chronique.14
Les anti-TNF autorisés dans le RP sont l’infliximab, l’adalimumab, l’étanercept, le golimumab et le certolizumab pégol (tableau). Ces médicaments sont réservés aux cas de réponse insuffisante au traitement de fond conventionnel, notamment le MTX.
Inhibiteurs des interleukines
Les autres biothérapies indiquées pour le traitement du RP sont des inhibiteurs des interleukines (IL). Le sécukinumab et l’ixékizumab sont des inhibiteurs de l’interleukine 17A (IL- 17A) ; le bimékizumab inhibe l’IL- 17A et F ; le guselkumab et le risankizumab ont une action sur l’IL- 23p19 ; l’ustékinumab agit sur l’axe IL- 12/23 (tableau).5 - 7,15
Choix de la biothérapie
Concernant le traitement de l’atteinte périphérique, les biothérapies sont actuellement toutes recommandées au même niveau (fig. 3).5 - 7
En cas d’atteinte concomitante cutanée importante ou modifiant la qualité de vie du patient (par exemple atteinte du visage), on privilégie un inhibiteur de l’IL- 17 ou de l’IL- 23p19 ou de l’IL- 12/23.6,7 En effet, ces modes d’action ont démontré une meilleure efficacité sur l’atteinte cutanée par rapport aux anti-TNF.13,15,16
Pour l’atteinte axiale, on recommande un anti-TNF ou un anti-IL- 17.6,7,12
Le choix du traitement doit également tenir compte de la présence éventuelle d’une atteinte extra-musculosquelettique. Ainsi, les uvéites relèvent d’un anti-TNF monoclonal ; les MICI d’un anti-TNF monoclonal, d’un anti-IL- 12/23, de certains anti-IL- 23p19 ou encore d’un inhibiteur de Janus kinase (JAK).7,15
Traitements ciblés synthétiques
Les traitements ciblés synthétiques utilisés dans le RP sont les inhibiteurs de JAK et l’aprémilast.
Inhibiteurs de JAK
Les inhibiteurs de JAK sont des médicaments administrés par voie orale qui bloquent des enzymes responsables de la production de cytokines impliquées dans l’inflammation et l’immunité. Les inhibiteurs de JAK indiqués dans le RP sont le tofacitinib et l’upadacitinib.17 Ces médicaments ont une efficacité en un à trois mois et sont souvent utilisés en association au MTX. Leur place dans la stratégie thérapeutique se situe aujourd’hui plutôt en deuxième ligne de traitement ciblé, donc après échec d’une biothérapie, ou lorsqu’une biothérapie n’est pas indiquée (fig. 3) compte tenu de leur rapport bénéfice-risque.7
En effet, en 2022, une alerte a été déclenchée concernant les inhibiteurs de JAK, à la suite de données indiquant une augmentation du risque cardiovasculaire et du risque néoplasique après une large étude avec le tofacitinib dans la polyarthrite rhumatoïde.18 Cette alerte a été élargie par l'European Medicine Agency à l’ensemble des molécules inhibitrices de JAK et à toutes les indications, dont le RP.19 La recommandation est d’utiliser les inhibiteurs de JAK uniquement en l’absence d’alternative thérapeutique et avec précaution chez les patients de plus de 65 ans, les fumeurs et anciens fumeurs, ainsi que chez les patients ayant des facteurs de risque cardiovasculaire ou des antécédents de cancer.19
Aprémilast
L’aprémilast est un immunomodulateur administré par voie orale qui inhibe l’enzyme phosphodiestérase 4 (PDE4), impliquée dans la production des cytokines. L’efficacité de ce médicament est modeste, mais il est bien toléré (en dehors de troubles digestifs sans gravité, les premières semaines de traitement le plus souvent). Il est recommandé dans les formes bénignes de RP, quand les biothérapies et les inhibiteurs de JAK ne sont pas indiqués (fig. 3).6,7
Stratégie thérapeutique
Un tiers environ des patients ne répondent pas complètement à un premier traitement de fond ciblé, sans qu’on connaisse bien aujourd’hui les facteurs pronostiques de bonne réponse aux différentes molécules disponibles.
Si la réponse au premier traitement ciblé est insuffisante, le rhumatologue choisit ensuite un autre traitement, une biothérapie ou un traitement ciblé synthétique.6,7 Le traitement doit être pris pendant au moins trois mois avant de parler d’échec.
La maintenance thérapeutique est en moyenne de trois à cinq ans, ce qui signifie que la vie d’un patient atteint de RP est souvent rythmée par des changements de traitement de fond, toujours dans le cadre d’une décision médicale partagée.
Pathologie chronique aux alternatives thérapeutiques nombreuses
La prise en charge des patients atteints de rhumatisme psoriasique nécessite des approches à la fois pharmacologiques et non pharmacologiques. Les AINS à visée symptomatique sont souvent efficaces. Le traitement de fond utilisé en première intention est le plus souvent le MTX, avec possibilité de recours au léflunomide ou à la sulfasalazine. En cas d’échec d’un traitement de fond conventionnel, il est recommandé d’avoir recours à un traitement de fond ciblé (biothérapie en première intention ; dans certains cas, inhibiteurs de JAK en l’absence de facteurs de risque ; aprémilast en cas d’atteinte bénigne). Les biothérapies les plus utilisées sont encore actuellement les anti-TNF (souvent associés au MTX), mais des biothérapies avec d’autres modes d’action présentent des avantages dans certaines situations. Une bonne collaboration entre le rhumatologue et le médecin traitant est importante dans cette maladie chronique où le pronostic est grevé par des comorbidités fréquentes.
2. Ogdie A, Schwartzman S, Husni ME. Recognizing and managing comorbidities in psoriatic arthritis. Curr Opin Rheumatol 2015;27:118-26.
3. Ogdie A, Schwartzman S, Eder L, et al. Comprehensive treatment of psoriatic arthritis: Managing comorbidities and extraarticular manifestations. J Rheumatol 2014;41(11):2315-22.
4. Gossec L, de Wit M, Kiltz U et al. A patient-derived and patient-reported outcome measure for assessing psoriatic arthritis: Elaboration and preliminary validation of the Psoriatic Arthritis Impact of Disease (PsAID) questionnaire, a 13-country EULAR initiative. Ann Rheum Dis 2014;73(6):1012-9.
5. Coates LC, Soriano ER, Corp N, et al. Group for research and assessment of psoriasis and psoriatic arthritis (GRAPPA): Updated treatment recommendations for psoriatic arthritis 2021. Nat Rev Rheumatol 2022;18(8):465-79.
6. Wendling D, Hecquet S, Fogel O, et al. 2022 French Society of Rheumatology (SFR) recommendations on the everyday management of patients with spondyloarthritis, including psoriatic arthritis. Joint Bone Spine 2022;89(3):105344.
7. Gossec L, Kerschbaumer A, Ferreira RJO, et al. EULAR recommendations for the management of psoriatic arthritis with pharmacological therapies: 2023 update. Ann Rheum Dis 2024;83(6):706-19.
8. Gossec L, Molto A, Romand X, et al. Recommendations for the assessment and optimization of adherence to disease-modifying drugs in chronic inflammatory rheumatic diseases: A process based on literature reviews and expert consensus. Joint Bone Spine 2019;86(1):13-9.
9. Schemoul J, Poulain C, Claudepierre P. Treatment strategies for psoriatic arthritis. Joint Bone Spine 2018;85(5):537-44.
10. Vial T, Patat AM, Boels D, et al. Adverse consequences of low-dose methotrexate medication errors: Data from French poison control and pharmacovigilance centers. Joint Bone Spine 2019;86(3):351-5.
11. Centre de référence sur les agents tératogènes (CRAT). http://www.lecrat.fr
12. Ramiro S, Nikiphorou E, Sepriano A, et al. ASAS-EULAR recommendations for the management of axial spondyloarthritis: 2022 update. Ann Rheum Dis 2023;82(1):19-34.
13. Sbidian E, Chaimani A, Guelimi R, et al. Systemic pharmacological treatments for chronic plaque psoriasis: A network meta-analysis. Cochrane Database Syst Rev 2023;7(7):CD011535.
14. Caso F, Lubrano E, Del Puente A, et al. Progress in understanding and utilizing TNF-alpha inhibition for the treatment of psoriatic arthritis. Expert Rev Clin Immunol 2016;12(3):315-31.
15. Kerschbaumer A, Smolen JS, Ferreira RJO, et al. Efficacy and safety of pharmacological treatment of psoriatic arthritis: A systematic literature research informing the 2023 update of the EULAR recommendations for the management of psoriatic arthritis. Ann Rheum Dis 2024;83(6):760-74.
16. Bergen LLT, Petrovic A, Aarebrot AK, et al. The TNF/IL-23/IL-17 axis-head-to-head trials comparing different biologics in psoriasis treatment. Scand J Immunol 2020;92(4):e12946.
17. Keeling S, Maksymowych WP. JAK inhibitors, psoriatic arthritis, and axial spondyloarthritis: A critical review of clinical trials. Expert Rev Clin Immunol 2021;17(7):701-15.
18. Ytterberg SR, Bhatt DL, Mikuls TR, et al. Cardiovascular and cancer risk with tofacitinib in rheumatoid arthritis. N Engl J Med 2022;386(4):316-26.
19. European Medecines Agency (EMA). EMA recommends measures to minimise risk of serious side effects with Janus kinase inhibitors for chronic inflammatory disorders. 22 octobre 2022. https://www.ema.europa.eu/en/news/ema-recommends-measures-minimise-risk-serious-side-effects-janus-kinase-inhibitors-chronic-inflammatory-disorders
Dans cet article
- Signes cliniques variables, fréquentes comorbidités et qualité de vie souvent altérée
- Des recommandations thérapeutiques établies
- Traitement anti-inflammatoire symptomatique en première intention
- Indications du traitement de fond de première intention
- Traitements de fond ciblés
- Stratégie thérapeutique
- Pathologie chronique aux alternatives thérapeutiques nombreuses