Les accidents vasculaires cérébraux (AVC) sont un problème majeur en raison de leur fréquence, d’une mortalité élevée à court et long termes et des séquelles invalidantes qu’ils génèrent.1 Leur incidence annuelle est d’environ 2 400 par million d’habitants, dont 80 % sont ischémiques. Elle est en augmentation dans les pays à hauts revenus où l’espérance de vie s’est allongée, mais aussi et surtout dans les pays à faibles revenus et chez les jeunes.1
Cet article se limite au traitement dans les quarante-huit premières heures de l’ischémie cérébrale, en excluant les accidents ischémiques transitoires.
Imagerie multimodale, un préalable indispensable à la compréhension du mécanisme
Pour traiter de façon appropriée un patient en phase aiguë d’une ischémie cérébrale, il faut, d’une part, une certitude diagnostique et, d’autre part, une compréhension du mécanisme, que seule l’imagerie multimodale peut apporter. Bien que certains symptômes soient moins fréquents dans les infarctus cérébraux que dans les hémorragies (céphalées, troubles de la vigilance, crises épileptiques), les données cliniques ne sont pas suffisamment spécifiques à l’échelon individuel pour différencier ischémie et hémorragie.
IRM en première intention
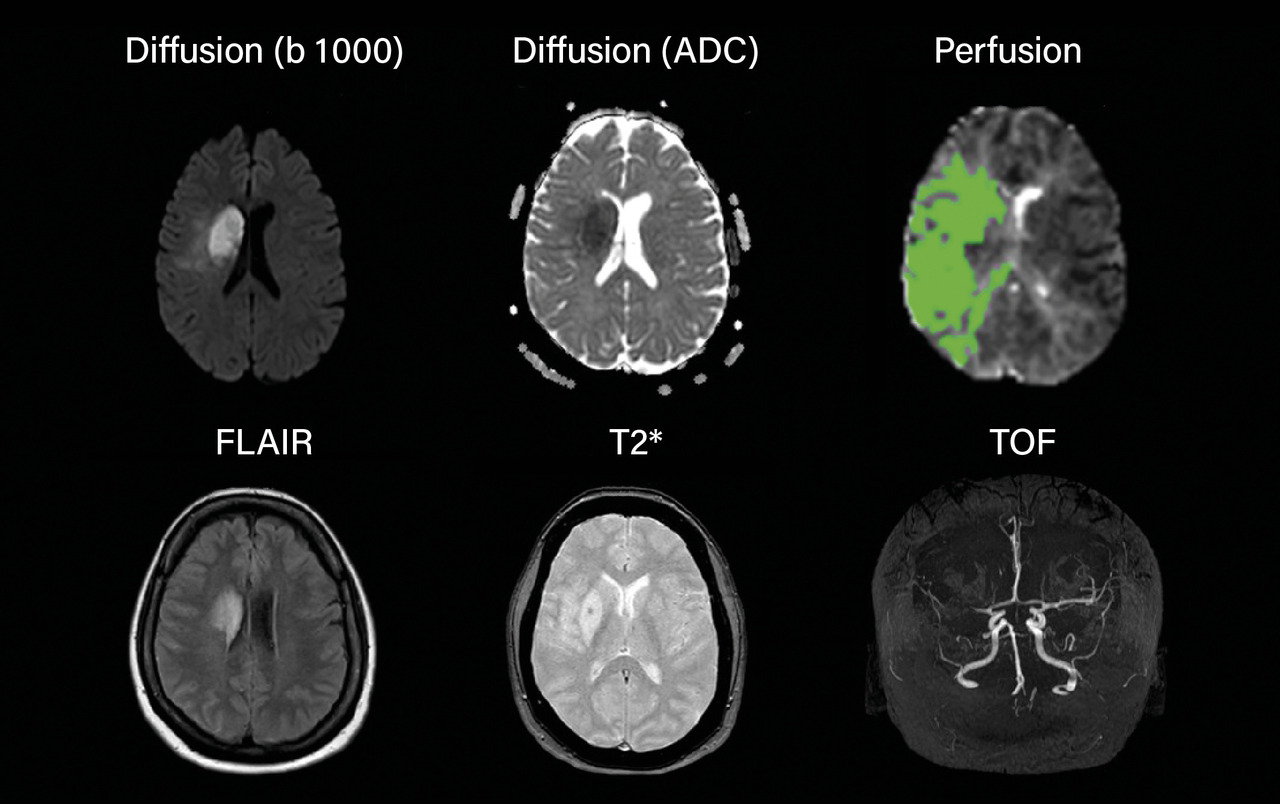
L’imagerie par résonance magnétique (IRM) est l’examen le plus approprié (figure). Elle doit comporter quatre séquences :2
- la séquence de diffusion, qui identifie les lésions ischémiques récentes sous forme d’un signal hyperintense en b 1000 et d’une diminution du coefficient apparent de diffusion de l’eau. Ces changements sont très précoces, contrairement à ceux observés en séquence FLAIR (fluid-attenuated inversion recovery) ;
- la séquence T2* écho de gradient ou de susceptibilité (SWI), qui permet de repérer très précocement les hémorragies. Elle est donc cruciale pour différencier ischémie et hémorragie, et pour identifier la présence de microsaignements chroniques (microbleeds) ;
- la séquence FLAIR, qui identifie les lésions anciennes d’origine vasculaire ou d’autre nature. Dans l’ischémie cérébrale, elle ne révèle la présence d’un infarctus qu’après un délai de quatre à six heures. Elle est utilisée comme une horloge tissulaire permettant d’évaluer une heure de début inconnue ou de préciser une heure de début approximative donnée par l’entourage ;
- la séquence ToF (time of flight), qui visualise le polygone de Willis et identifie les occlusions d’artères intracrâniennes.
La séquence de perfusion peut être utile pour visualiser la zone de pénombre ischémique, mais elle n’est pas utilisée en routine car elle allonge la durée de l’examen dans un contexte d’urgence. Elle n’est réellement utile que chez les patients vus plus de quatre heures trente après l’apparition des symptômes, ou pour les diagnostics différentiels de type trouble neurologique fonctionnel ou migraine avec aura.
Scanner cérébral en l’absence d’IRM
Lorsque l’IRM n’est pas disponible en urgence ou ne peut être réalisée en raison d’une contre-indication, un scanner cérébral sans contraste doit être effectué sans délai. Il identifie facilement les hémorragies, sous forme d’une hyperdensité parenchymateuse spontanée. En cas d’ischémie cérébrale aiguë, le scanner peut être normal au début, puis apparaissent des signes précoces d’ischémie cérébrale, sous forme d’une légère atténuation de la substance grise. Celle-ci est, chez un sujet normal, plus vascularisée que la substance blanche et donc légèrement plus dense. Dans les ischémies du territoire de l’artère cérébrale moyenne, on observe ainsi une atténuation du noyau lenticulaire, du ruban insulaire et des sillons corticaux dont la densité devient identique à celle de la substance blanche voisine.3 La visualisation d’une artère cérébrale moyenne hyperdense est le témoin de son occlusion par un thrombus.3
Après administration d’un produit de contraste iodé, l’angioscanner visualise les artères du polygone de Willis et une éventuelle occlusion de celles-ci ; il peut apporter des informations sur la perfusion cérébrale assez proches de celles obtenues en IRM.
Cinq stratégies thérapeutiques efficaces
Ces modalités de prise en charge augmentent les chances de survie sans handicap ou sans dépendance.
Admission en unité neurovasculaire, pierre angulaire du traitement
La prise en charge en unité neurovasculaire (UNV) permet d’éviter un décès et un cas de dépendance pour 24 patients traités en comparaison avec une prise en charge dans un service conventionnel.4 Ce bénéfice est indépendant de l’âge, de la gravité, du type d’AVC et du traitement.4 C’est pourquoi l’UNV constitue la pierre angulaire du traitement de tous les types d’AVC.5 Elle se définit comme une structure géographiquement déterminée, multidisciplinaire et pluriprofessionnelle, dans laquelle le personnel a une formation spécifique.4
Le bénéfice de la prise en charge en UNV a été démontré à une époque où les traitements spécifiques n’avaient pas encore fait preuve d’efficacité.4 Il est observé à partir de la fin de la première semaine et se maintient avec le temps,4 suggérant l’action d’une meilleure prévention des complications – y compris les récidives ischémiques – et d’une meilleure prise en charge de celles-ci. Cette prise en charge repose sur des procédures permettant le dépistage et le traitement appropriés des troubles de déglutition, de l’hyperthermie, de l’hyperglycémie, des anomalies d’hydratation, de la dénutrition, des thromboses veineuses profondes et des escarres, en parallèle de la mise en évidence de la cause présumée dont dépendent les mesures de prévention secondaire précoce.
Antiplaquettaires pour éviter récidives et décès
Une méta-analyse de deux grands essais randomisés ayant inclus chacun plus de 20 000 patients a comparé aspirine (de 160 à 300 mg /j pendant deux à quatre semaines, puis de 75 à 160 mg/j) et placebo dans les quarante-huit premières heures d’un infarctus cérébral.6 L’aspirine a permis, pour 1 000 patients traités, d’éviter sept récidives ischémiques cérébrales et neuf décès ou récidives d’AVC pendant l’hospitalisation, au prix de deux hémorragies cérébrales ou transformations hémorragiques, supplémentaires.6 Ce bénéfice est homogène dans tous les sous-groupes étudiés (âge, sexe, présence d’une fibrillation atriale, pression artérielle).6 Dans ces deux études conduites il y a plus de trente ans, il n’a pas été observé d’augmentation de la mortalité chez les 773 patients qui avaient été inclus avant l’imagerie et avaient, en fait, une hémorragie cérébrale.6 En raison du grand nombre de patients qui peuvent recevoir de l’aspirine, ce petit bénéfice individuel est un atout majeur au niveau de la population.
D’autres essais cliniques avec les antiplaquettaires ont concerné des accidents de faible sévérité et éventuellement transitoires. La faible sévérité se définit par un score inférieur à 4 sur le NIHSS (National Institutes of Health Stroke Scale). L’étude CHANCE (Clopidogrel in high-risk patients with acute nondisabling cerebrovascular events)7 a montré que les patients asiatiques ayant reçu dans les vingt-quatre heures une dose de charge de 300 mg de clopidogrel per os en plus de l’aspirine, pour un AVC ischémique mineur ou un accident ischémique transitoire (AIT), suivie de 75 mg de clopidogrel et de 75 mg d’aspirine pendant quatre-vingt-dix jours, avaient moins de récidive d’AVC que ceux qui étaient sous aspirine seule, sans augmentation du risque hémorragique. Ce résultat a été confirmé par l’étude POINT (Platelet-oriented inhibition in new TIA and minor ischemic stroke),8 dans laquelle la dose de charge de clopidogrel était de 600 mg (suivie de 75 mg/j) et celle de l’aspirine de 325 mg (suivie de 50 mg/j). La bithérapie était poursuivie quatre-vingt-dix jours, et le bénéfice observé était partiellement contrebalancé par un excès d’hémorragies graves.8
L’aspirine doit donc être débutée dès que possible après l’admission, ou différée de vingt-quatre heures en cas de thrombolyse intraveineuse (IV) ou de thrombectomie mécanique. En présence d’un accident non cardio-embolique mineur (score NIHSS inférieur à 4) chez un patient qui n’a pas reçu de traitement thrombolytique, une bithérapie par aspirine plus clopidogrel est indiquée dès l’admission, remplacée par une monothérapie par l’un des deux antiplaquettaires au plus tard après vingt et un jours.
Thrombolyse par voie intraveineuse jusqu’à neuf heures après le début des signes
Le rt-PA (recombinant tissue plasminogen activator) multiplie par huit la probabilité d’une issue favorable à trois mois lorsqu’il est administré dans les quatre-vingt-dix minutes, par deux dans les quatre-vingt-onze à cent quatre-vingts minutes et par 1,4 dans la fenêtre des cent quatre-vingt-un à deux cent soixante-dix minutes.9 Le nombre de patients à traiter pour en avoir un supplémentaire survivant sans handicap (score 0 ou 1 sur l’échelle de Rankin modifiée [mRS]) à trois mois est de 3 après une heure et demie, 7 après trois heures et 14 après quatre heures et demie.9 La mortalité n’est pas augmentée jusqu’à quatre heures et demie, mais elle augmente ensuite.9 La transformation hémorragique est associée à l’âge, au volume de l’infarctus et à d’éventuels traitements antithrombotiques en cours.9 Plus le rt-PA est administré tôt, plus le bénéfice est important.9 La dose de rt-PA est de 0,9 mg/kg (10 % en bolus IV, 90 % en injection IV continue sur une heure). La thrombolyse est recommandée dès que possible après l’apparition des signes, avec une limite théorique à quatre heures et demie.
Néanmoins, ce qui est important pour évaluer le rapport bénéfice-risque est l’état du parenchyme cérébral au moment de la thrombolyse. Le délai était important quand la plupart des thrombolyses étaient effectuées sur de simples scanners non injectés dont le rôle était de s’assurer de l’absence d’hémorragie. Grace à l’imagerie multimodale, il est possible de s’affranchir du délai et de s’intéresser à l’état du parenchyme. Il a ainsi été démontré que, chez les patients dont l’heure d’apparition des symptômes est inconnue, il existe toujours un bénéfice de la thrombolyse en cas de discordance entre une anomalie de diffusion évocatrice d’une ischémie récente et une imagerie FLAIR normale ou montrant des signes très limités d’infarctus.10 Cette discordance entre les deux séquences IRM correspond à ce qu’on appelle le mismatch FLAIR-diffusion.
L’essai EXTEND11 a montré que la thrombolyse apporte encore un bénéfice entre quatre heures et demie et neuf heures après le début (proportion de patients ayant un score de Rankin modifié à 0 ou 1 à trois mois), chez les patients ayant une anomalie de perfusion plus importante que l’anomalie de diffusion en IRM (ou un mismatch diffusion/perfusion au scanner), malgré une augmentation du risque d’hémorragie intracérébrale. Par conséquent, la fenêtre temporelle de quatre heures et demie ne devrait plus être la règle si l’on a accès à une imagerie multimodale.
Plusieurs essais randomisés, avec une hypothèse de non-infériorité pour la plupart, ont testé le ténectéplase versus rt-PA. L’avantage théorique de celui-ci est une plus grande facilité d’emploi car il s’administre en une injection IV unique. Sur la base de ces essais, l’European Stroke Organisation a émis des recommandations12 qui suggèrent d’utiliser le ténectéplase de préférence au rt-PA (altéplase) dans la plupart des circonstances où une thrombolyse IV est nécessaire.
Thrombectomie mécanique dans des cas particuliers
Si la thrombolyse intraveineuse augmente la probabilité d’une survie sans handicap après une ischémie cérébrale aiguë, elle comporte des échecs liés soit à la survenue d’une complication, soit à une absence d’efficacité sur la recanalisation. Le meilleur prédicteur d’inefficacité est la présence d’une occlusion d’un gros tronc artériel.13
Les essais randomisés publiés en 2015 et 2016 ont démontré que le traitement endovasculaire, principalement la thrombectomie mécanique, améliore les chances de survie sans dépendance (score de Rankin modifié 0 à 2 à trois mois) chez les patients présentant une ischémie cérébrale aiguë par occlusion proximale d’une grosse artère de la circulation antérieure, en comparaison avec le traitement standard comprenant le rt-PA chez les patients éligibles : la méta-analyse des huit premiers essais, incluant 2 423 patients, a montré que ceux qui ont été randomisés dans le bras interventionnel avaient une évolution plus favorable de l’échelle de Rankin modifiée.14 Ils avaient une probabilité plus élevée d’être indépendants (mRS 0 à 2) après trois mois : le nombre de patients à traiter pour un patient supplémentaire indépendant à trois mois est de 9,3.
Ces essais ont également montré que le délai entre le début des signes et le traitement est fortement associé au résultat.14 Néanmoins, entre six et vingt-quatre heures, certains patients tirent encore bénéfice de la thrombectomie mécanique : dans l’essai DAWN (DWI or CTP assessment with clinical mismatch in the triage of wake-up and late presenting strokes undergoing neurointervention with trevo), les patients ont été sélectionnés sur la base d’une discordance entre la gravité clinique et le volume de l’infarctus (mismatch radioclinique),15 et dans l’essai DEFUSE 3 (Endovascular therapy following imaging evaluation for ischemic stroke), les patients ont été sélectionnés sur la base d’un mismatch diffusion-perfusion.16
Chirurgie décompressive
La chirurgie décompressive (hémicraniectomie) réduit la mortalité et le handicap chez les patients de moins de 60 ans qui présentent depuis moins de quarante-huit heures un infarctus étendu dans le territoire de l’artère cérébrale moyenne. Pour être efficace, la chirurgie doit être pratiquée avant l’apparition d’un infarctus malin*.
Cette chirurgie, souvent présentée à tort comme un traitement de l’infarctus malin, est en fait un traitement préventif des complications de l’infarctus malin chez des patients ayant un infarctus étendu du territoire de l’artère cérébrale moyenne. Le meilleur critère de sélection pour la chirurgie est la présence d’un volume de l’anomalie de diffusion sur une IRM réalisée vers la vingt-quatrième heure de 145 cm3 ou plus. Le bénéfice procuré par l’hémicraniectomie est important : il suffit de traiter deux patients pour éviter un décès ou une dépendance sévère (mRS ≤ 4) et quatre pour éviter un décès ou une dépendance totale (mRS ≤ à 3).17
L’essai DESTINY II (Decompressive surgery for the treatment of malignant infarction of the middle cerebral artery II) a montré que le bénéfice de cette chirurgie est également observé chez les patients de plus de 60 ans, mais que très peu de survivants peuvent se passer d’une assistance dans leur vie quotidienne.18
Pronostic favorable accru
Les essais randomisés et les méta-analyses permettent de comparer le bénéfice attendu sur le pronostic des différentes stratégies de traitement (tableau).
En pratique
La conduite à tenir face à une ischémie cérébrale aiguë peut se schématiser selon la séquence suivante :
- appel au 15 (ou au 112, numéro valide dans toute l’Union européenne) pour toute personne qui se trouve face à un patient ayant des signes évocateurs d’accident vasculaire cérébral (AVC). Cela suppose une éducation de la population ;
- prénotification par le régulateur du Samu qui prévient l’unité neurovasculaire (UNV) la plus proche ;
- admission en imagerie où l’équipe de l’UNV débute la prise en charge ;
- réalisation immédiate d’une imagerie, de préférence une imagerie par résonance magnétique (IRM), à défaut un scanner.
Si le diagnostic d’ischémie cérébrale se confirme :
- administration immédiate d’une thrombolyse intraveineuse, s’il y a une indication ;
- transfert immédiat en salle de thrombectomie s’il y a une occlusion de gros vaisseau ;
- admission en unité neurovasculaire immédiatement (ou après la fin de la thrombectomie si l’indication est retenue) ;
- aspirine 300 mg immédiatement s’il n’y a pas d’indication à une thrombolyse ou à une thrombectomie, sinon après vingt-quatre heures, suivie par une posologie de 75 mg à partir de la deuxième prise ;
- si le patient a moins de 60 ans et un infarctus étendu du territoire de l’artère cérébrale moyenne avec une anomalie de diffusion de plus de 145 cm3 en IRM à vingt-quatre heures, c’est une indication à hémicraniectomie décompressive. Si le patient a plus de 60 ans ou si l’on se situe à plus de quarante-huit heures de l’AVC, l’indication d’hémicraniectomie peut se discuter au cas par cas, mais ses résultats sont plus incertains.
2. Provost C, Soudant M, Legrand L, et al. Magnetic resonance imaging or computed tomography before treatment in acute ischemic stroke. Stroke 2019;50:659-64.
3. Moulin T, Cattin F, Crepin-Leblond T, et al. Early CT signs in acute middle cerebral artery infarction: Predictive value for subsequent infarct locations and outcome. Neurology 1996;47:366-75.
4. Langhorne P, Ramachandra S. Organised inpatient (stroke unit) care for stroke: Network meta-analysis. Stroke 2020;4:e349–50.
5. Leys D, Chollet F, Bousser M-G, et al. Prise en charge en urgence dans les unités neurovasculaires des personnes ayant un accident vasculaire cérébral. Bull Acad Ntle Med 2022;206:1169-78.
6. Chen ZM, Sandercock P, Pan HC, et al. Indications for early aspirin use in acute ischemic stroke : A combined analysis of 40 000 randomized patients from the chinese acute stroke trial and the international stroke trial. On behalf of the CAST and IST collaborative groups. Stroke 2000;31:1240-9.
7. Wang YY, Wang YY, Zhao X, et al. Clopidogrel with aspirin in acute minor stroke or transient ischemic attack. N Engl J Med 2013;369:11-9.
8. Johnston SC, Easton JD, Farrant M, et al. Clopidogrel and aspirin in acute ischemic stroke and high-risk TIA. N Engl J Med 2018;379:215-25.
9. Emberson J, Lees KR, Lyden P, et al. Effect of treatment delay, age, and stroke severity on the effects of intravenous thrombolysis with alteplase for acute ischaemic stroke: A meta-analysis of individual patient data from randomised trials. Lancet 2014;384:1929-35.
10. Thomalla G, Simonsen CZ, Boutitie F, et al. MRI-guided thrombolysis for stroke with unknown time of onset. N Engl J Med 2018;379:611-22.
11. Campbell BC V, Ma H, Ringleb PA, et al. Extending thrombolysis to 4·5-9 h and wake-up stroke using perfusion imaging: A systematic review and meta-analysis of individual patient data. Lancet 2019;394:139-47.
12. Alamowitch S, Turc G, Palaiodimou L, et al. European Stroke Organisation (ESO) expedited recommendation on tenecteplase for acute ischaemic stroke. Eur Stroke J 2023;8:8-54.
13. Tisserand M, Seners P, Turc G, et al. Mechanisms of unexplained neurological deterioration after intravenous thrombolysis. Stroke 2014;45:3527-34.
14. Badhiwala JH, Nassiri F, Alhazzani W, et al. Endovascular thrombectomy for acute ischemic stroke: A meta-analysis. JAMA 2015;314:1832-43.
15. Nogueira RG, Jadhav AP, Haussen DC, et al. Thrombectomy 6 to 24 hours after stroke with a mismatch between deficit and infarct. N Engl J Med 2018;378:11-21.
16. Goyal M, Menon BK, van Zwam WH, et al. Endovascular thrombectomy after large-vessel ischaemic stroke: A meta-analysis of individual patient data from five randomised trials. Lancet 2016;387:1723-31.
17. Vahedi K, Hofmeijer J, Jüttler E, et al. Early decompressive surgery in malignant infarction of the middle cerebral artery: A pooled analysis of three randomised controlled trials. Lancet Neurol 2007;6:215-22.
18. Jüttler E, Unterberg A, Woitzik J, et al. Hemicraniectomy in older patients with extensive middle-cerebral-artery stroke. N Engl J Med 2014;370:1091-100.

 Encadrés
Encadrés