Le syndrome dyspeptique : des signes d’alarme ?
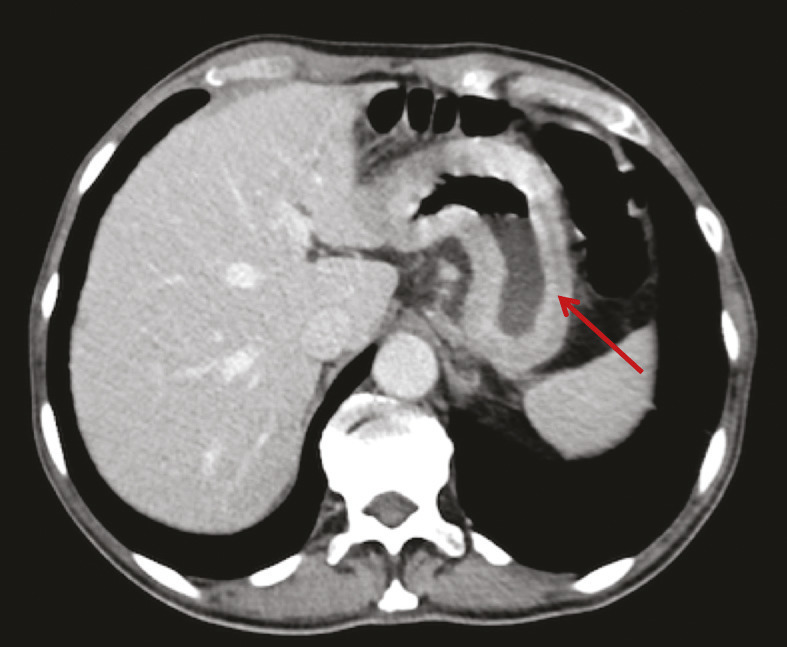
Un mois et demi plus tard, devant la persistance des symptômes et la perte de 6 kg supplémentaires, une tomodensitométrie est réalisée, qui montre un aspect épaissi de la paroi gastrique mesurant 17 mm d’épaisseur, limité à l’antre gastrique. Une nouvelle endoscopie œsogastroduodénale est alors réalisée, qui ne note pas d’anomalie évidente, si ce n’est toujours un aspect rigide à l’insufflation. Une écho-endoscopie haute est réalisée, qui révèle un épaississement localisé de la paroi gastrique et permet des biopsies guidées qui décè- lent la présence d’un adénocarcinome gastrique avec présence de cellules indépendantes.
Savoir répéter les examens…
Un bilan d’extension par tomoden- sitométrie thoraco-abdomino- pelvienne est réalisé et ne montre pas de lésion secondaire hépatique ou pulmonaire et pas de signe évocateur de carcinose péritonéale. Après discussion en réunion de concertation pluridisciplinaire, une résection chirurgicale est décidée, encadrée par une chimiothérapie périopératoire.
Qu’est-ce qu’un adénocarcinome gastrique à cellules indépendantes ?
Afin de déterminer le type histo- logique des cancers gastriques, notamment le type ADCI, les biopsies préthérapeutiques semblent avoir une excellente valeur prédictive positive (92,7 %) et négative (92,4 %), lorsqu’elles sont contri- butives. Celà permettrait d’adapter les traitements périopératoires, voire le type de chirurgie, en fonction du type histologique.
Pourquoi proposer une chimiothérapie périopératoire ?
Quel type de chirurgie proposer ?
L’examen anatomopathologique de la pièce opératoire montre l’existence d’un adénocarcinome peu différencié de l’antre gastrique, de 42 x 23 mm, avec un contingent majoritaire de cellules isolées en bague à chaton (60 %) dans un stroma fibreux. La lésion est classée pT3N1Mx. La réponse à la chimiothérapie préopératoire est moyenne, estimée selon la classification de Mandard à TRG3. Les marges de résection sont saines d’envahissement tumoral (R0).
Le dossier est discuté en réunion de concertation pluridisciplinaire, et il est décidé de réaliser une chimiothérapie postopératoire selon le schéma FLOT.
Un traitement postopératoire très fréquent
Il n’y a pas d’argument pour un changement de chimiothérapie en postopératoire en fonction des résultats cliniques et histologiques de la chimiothérapie préopératoire. La réalisation d’une radiochimiothérapie en postopératoire chez les patients traités en préopératoire ne semble pas apporter de bénéfice par rapport à une chimiothérapie.
Enfin, si le patient n’a pas reçu de chimiothérapie préopératoire, une chimiothérapie postopératoire est également recommandée.12 La radiochimiothérapie est également une alternative chez ces patients,13 en particulier en cas de résection microscopiquement incomplète (R1). En revanche, l’intérêt de cette radiochimiothérapie postopératoire semble ne pas persister dans les linites gastriques.
Lors du suivi, le patient revient 6 mois après la fin de son traitement adjuvant. La tomodensitométrie thoraco-abdomino-pelvienne révèle l’existence de deux lésions hépatiques hypodenses des segments VII et VIII, de 25 mm et 33 mm de plus grand axe. Une imagerie par résonance magnétique (IRM) hépatique ne montre pas d’autre lésion hépatique, et la tomographie par émission de positons au 18-fluorodésoxuglucose (TEP-TDM au 18FDG) ne révèle aucune fixation pathologique, y compris au niveau hépatique.
Que faire en cas de lésions métastatiques ?
La place de la TEP-TDM au 18FDG n’est pas déterminée dans la prise en charge et la surveillance du cancer gastrique. Cet examen ne doit donc pas être systématique dans le cadre du bilan d’extension. Il peut être discuté au cas par cas, en particulier dans les formes opérables à haut risque. Cependant, dans les adénocarcinomes gastriques à cellules indépendantes, la TEP-TDM a une moins bonne sensibilité et les faux négatifs sont plus fréquents.
Chez les patients ayant une atteinte métastatique, la chimiothérapie palliative a montré son efficacité en termes de survie. Mais il n’existe à ce jour pas de standard interna- tional de première ligne.
Il est tout d’abord indispensable de déterminer le statut HER2 de la tumeur en immunohistochimie avec ou sans hybridation in situ. En cas de surexpression de HER2, la référence est un schéma associant 5-FU, cisplatine et trastuzumab. Le 5-FU et le cisplatine peuvent éventuellement être substitués par la capécitabine (forme orale du 5-FU) et l’oxaliplatine respectivement. En l’absence de surexpression de HER2, plusieurs schémas de référence peuvent être proposés après discussion en réunion de concertation pluridisciplinaire et en tenant compte de l’état général du patient et des traitements éventuellement reçus en périopératoire : CF (cisplatine, 5-FU), ECF (épirubicine, CF), DCF (docétaxel CF), FOLFOX (5-FU, oxaliplatine), TFOX (docétaxel, 5-FU, oxaliplatine) ou FOLFIRI (5-FU + irinotécan).
Une résection des métastases hépatiques peut être discutée au cas par cas et uniquement si toutes les métastases sont résécables, et après une chimiothérapie première permettant un bon contrôle tumoral.10, 14, 15
Adénocarcinome gastrique à cellules indépendantes et linite gastrique
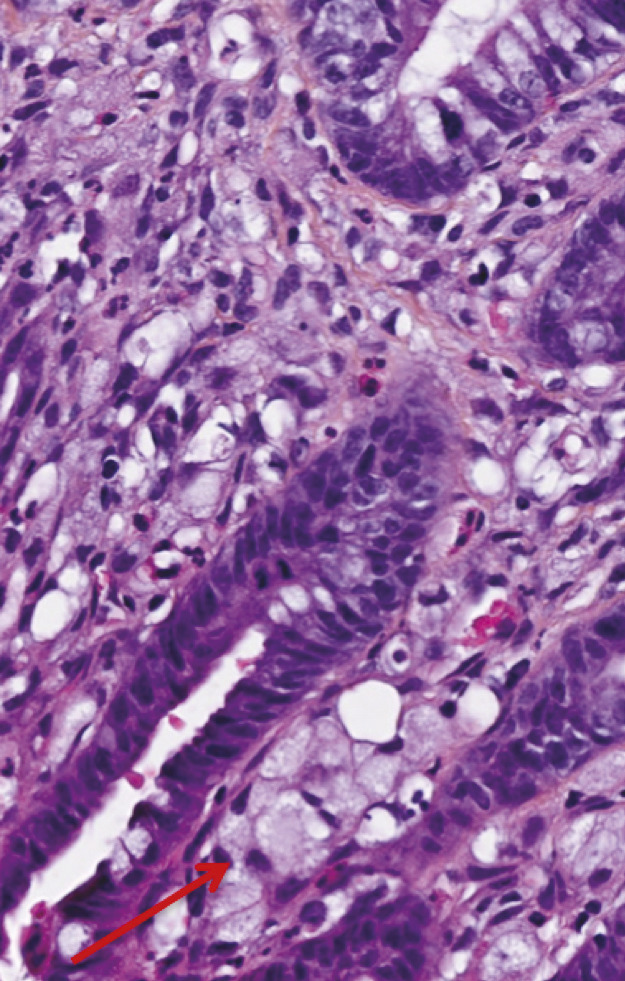
Parmi les classifications des cancers gastriques les plus fréquemment utilisées, on peut citer la classification de Lauren, décrite en 1965, qui distingue les cancers de type intestinal, les cancers de type diffus et les cancers de type mixte (ou inclassable), et celle de l’Organisation mondiale de la santé (OMS), décrite en 1990, qui identifie les adénocarcinomes papillaires, tubulaires, mucineux, les adénocarcinomes à cellules indépendantes, les carcinomes adéno-squameux et les carcinomes épidermoïdes.
L’adénocarcinome gastrique à cellules indépendantes (ADCI) défini par la classification de l’OMS est inclus dans les cancers gastriques de type diffus de la classification de Lauren, en raison de l’importance de son stroma fibreux. Cependant, il est important de noter que l’ensemble des tumeurs de type diffus ne sont pas des adénocarcinomes gastriques à cellules indépendantes.2
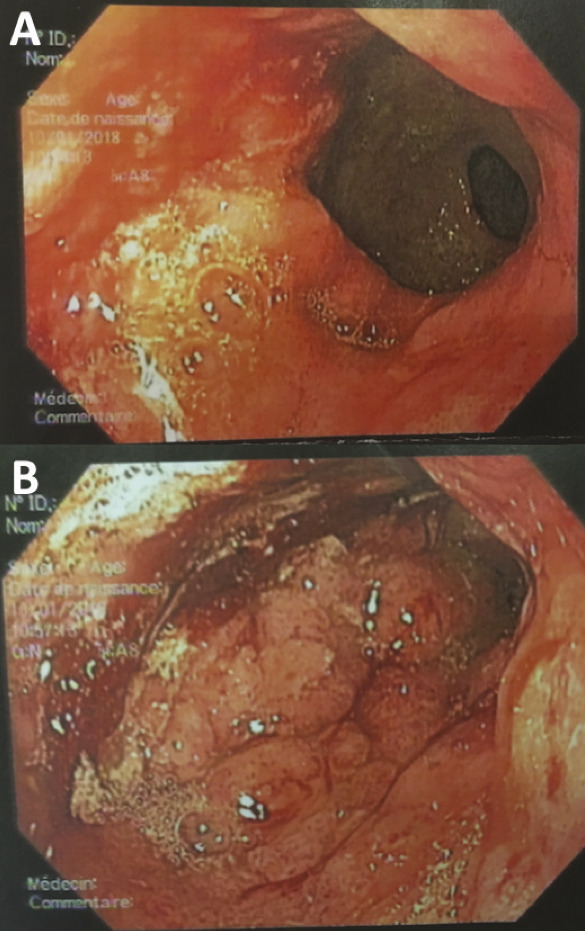
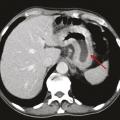
De même, une confusion fréquente est faite entre le type histologique ADCI et la linite gastrique. Cette dernière est définie macroscopiquement, en anatomopathologie, en endoscopie (fig. 2) ou en imagerie (fig. 3), par un aspect épaissi et rigide de la paroi gastrique. L’aspect de linite est fréquemment associé au type histologique ADCI, comme cela a été noté dans une série de 27 linites gastriques analysées par deux anatomopathologistes différents. P armi ces linites, 21 étaient des adénocarcinomes gastriques à cellules indépendantes et 6 d’autres types histologiques selon la classification de l’OMS. Après une troisième lecture des lames, il apparaissait que 4 tumeurs avaient un contingent minoritaire de cellules isolées (< 50 %) et 2 tumeurs étaient des adénocarcinomes tubulaires.3
2. Chiaravalli AM, Klersy C, Tava F, et al. Lower- and higher-grade subtypes of diffuse gastric cancer. Hum Pathol 2009;40:1591-9.
3. Piessen G, Messager M, Leteurtre E, Jean-Pierre T, Mariette C. Signet ring cell histology is an independent predictor of poor prognosis in gastric adenocarcinoma regardless of tumoral clinical presentation. Ann Surg 2009;250:878-87.
4. Voron T, Messager M, Duhamel A, et al. Is signet-ring cell carcinoma a specific entity among gastric cancers? Gastric Cancer 2015:1-14.
5. Cunningham D, Allum W, Stenning S, et al. Perioperative chemotherapy versus surgery alone for resectable Gastroesophageal Cancer. N Engl J Med 2006;355:11-20.
6. Ychou M, Boige V, Pignon JP, et al. Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma: an FNCLCC and FFCD multicenter phase III trial. J Clin Oncol 2011;29:1715-21.
7. Mary F, Zaanan A, Boige V, et al. Perioperative chemotherapy with FOLFOX in resectable gastroesophageal adenocarcinoma in real life practice: An AGEO multicenter retrospective study. Dig Liver Dis 2016;48:1498-502.
8. Messager M, Lefevre JH, Pichot-Delahaye V, Souadka A, Piessen G, Mariette C. The impact of perioperative chemotherapy on survival in patients with gastric signet ring cell adenocarcinoma: a multicenter comparative study. Ann Surg 2011;254:684-93.
9. Robb WB, Messager M, Gronnier C, et al. High-grade toxicity to neoadjuvant treatment for upper gastrointestinal carcinomas: what is the impact on perioperative and oncologic outcomes? Ann Surg Oncol 2015;22:3632-9.
10. Al-Batran SE, Homann N, Pauligk C, et al. Effect of neoadjuvant chemotherapy followed by surgical resection on survival in patients with limited metastatic gastric or gastroesophageal junction cancer. JAMA Oncol 2017;3:1237.
11. Michel P, Buecher B, Chapelle N, et al. Cancer de l’estomac. Thésaurus National de Cancérologie Digestive, 2017.
12. Paoletti X, Oba K, Burzykowski T, et al. Benefit of adjuvant chemotherapy for resectable gastric cancer. JAMA 2010;303:1729-37.
13. Macdonald J, Smalley S. Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction. N Engl J Med 2001;345:725-30.
14. Al-Batran SE, Goetze TO, Mueller DW, et al. The RENAISSANCE (AIO-FLOT5) trial: effect of chemotherapy alone vs. chemotherapy followed by surgical resection on survival and quality of life in patients with limited-metastatic adenocarcinoma of the stomach or esophagogastric junction – a phase III trial of the German AIO/CAO-V/CAOGI. BMC Cancer 2017;17:893.
15. Markar SR, Mikhail S, Malietzis G, et al. Influence of surgical resection of hepatic metastases from gastric adenocarcinoma on long-term survival. Ann Surg 2016;263:1092-101
Dans cet article
- Le syndrome dyspeptique : des signes d’alarme ?
- Savoir répéter les examens…
- Qu’est-ce qu’un adénocarcinome gastrique à cellules indépendantes ?
- Pourquoi proposer une chimiothérapie périopératoire ?
- Quel type de chirurgie proposer ?
- Un traitement postopératoire très fréquent
- Que faire en cas de lésions métastatiques ?

 Encadrés
Encadrés