Quel diagnostic évoquer ?
Un tableau d’éruption fébrile chez un adulte jeune doit faire évoquer plusieurs causes :
◗ une primo-infection par le virus de l’immunodéficience humaine (VIH) ;
◗ une syphilis secondaire ;
◗ une primo-infection par le virus d’Epstein-Barr (EBV), le cytomégalovirus (CMV), l’herpèsvirus humain de type 6 (HHV-6), le parvovirus B19, une rubéole ou une rougeole, voire une toxoplasmose ou une fièvre boutonneuse méditerranéenne ;
◗ un exanthème d’origine médicamenteuse.
L’interrogatoire doit systématiquement rechercher des facteurs de risque de contamination par le VIH : comportement sexuel « à risque » ou toxicomanie intraveineuse. Il est, en effet, capital d’évoquer la possibilité d’une primo-infection par le VIH afin de proposer les examens biologiques permettant d’écarter ou de confirmer cette hypothèse.
M. D. avait fait une sérologie pour le VIH avant la naissance de son enfant, laquelle était négative. Il n’avait pas refait d’autres tests depuis. Il indique avoir eu une relation non protégée extraconjugale 15 jours auparavant, lors d’un déplacement professionnel.
Son médecin lui prescrit un bilan biologique, qui montre une leucopénie modérée à l’hémogramme, sans autre anomalie sur l’ionogramme sanguin ou le bilan hépatique.
Les sérodiagnostics sont tous négatifs (VIH, virus des hépatites B et C, syphilis, EBV et CMV).
◗ une primo-infection par le virus de l’immunodéficience humaine (VIH) ;
◗ une syphilis secondaire ;
◗ une primo-infection par le virus d’Epstein-Barr (EBV), le cytomégalovirus (CMV), l’herpèsvirus humain de type 6 (HHV-6), le parvovirus B19, une rubéole ou une rougeole, voire une toxoplasmose ou une fièvre boutonneuse méditerranéenne ;
◗ un exanthème d’origine médicamenteuse.
L’interrogatoire doit systématiquement rechercher des facteurs de risque de contamination par le VIH : comportement sexuel « à risque » ou toxicomanie intraveineuse. Il est, en effet, capital d’évoquer la possibilité d’une primo-infection par le VIH afin de proposer les examens biologiques permettant d’écarter ou de confirmer cette hypothèse.
M. D. avait fait une sérologie pour le VIH avant la naissance de son enfant, laquelle était négative. Il n’avait pas refait d’autres tests depuis. Il indique avoir eu une relation non protégée extraconjugale 15 jours auparavant, lors d’un déplacement professionnel.
Son médecin lui prescrit un bilan biologique, qui montre une leucopénie modérée à l’hémogramme, sans autre anomalie sur l’ionogramme sanguin ou le bilan hépatique.
Les sérodiagnostics sont tous négatifs (VIH, virus des hépatites B et C, syphilis, EBV et CMV).
Quand évoquer une primo-infection par le VIH ?
Les manifestations cliniques et biologiques se manifestent souvent durant le pic de virémie et se résolvent rapidement (tableau 1) .1, 2
Il faut y penser en cas de syndrome viral aigu persistant (fièvre durant plus de 7 jours) associé à une polyadénopathie, à des manifestations cutanéo-muqueuses et/ou neurologiques et/ou après toute situation à risque sexuel. Les symptômes apparaissent 10 à 15 jours suivant la contamination. Des anomalies biologiques sont souvent présentes : anomalie hématologique (thrombopénie, neutropénie, hyperlymphocytose ou lymphopénie précoce) et/ou cytolyse hépatique.
Il faut y penser en cas de syndrome viral aigu persistant (fièvre durant plus de 7 jours) associé à une polyadénopathie, à des manifestations cutanéo-muqueuses et/ou neurologiques et/ou après toute situation à risque sexuel. Les symptômes apparaissent 10 à 15 jours suivant la contamination. Des anomalies biologiques sont souvent présentes : anomalie hématologique (thrombopénie, neutropénie, hyperlymphocytose ou lymphopénie précoce) et/ou cytolyse hépatique.
Quelle est la définition biologique de la primo-infection par le VIH ?
Il existe deux entités définissant biologiquement la primo-infection par le VIH :
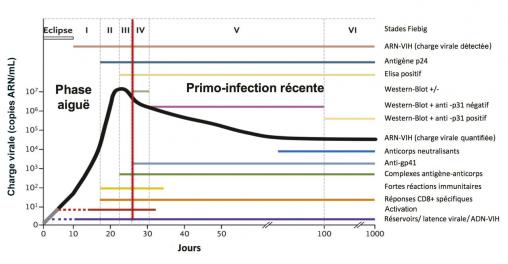
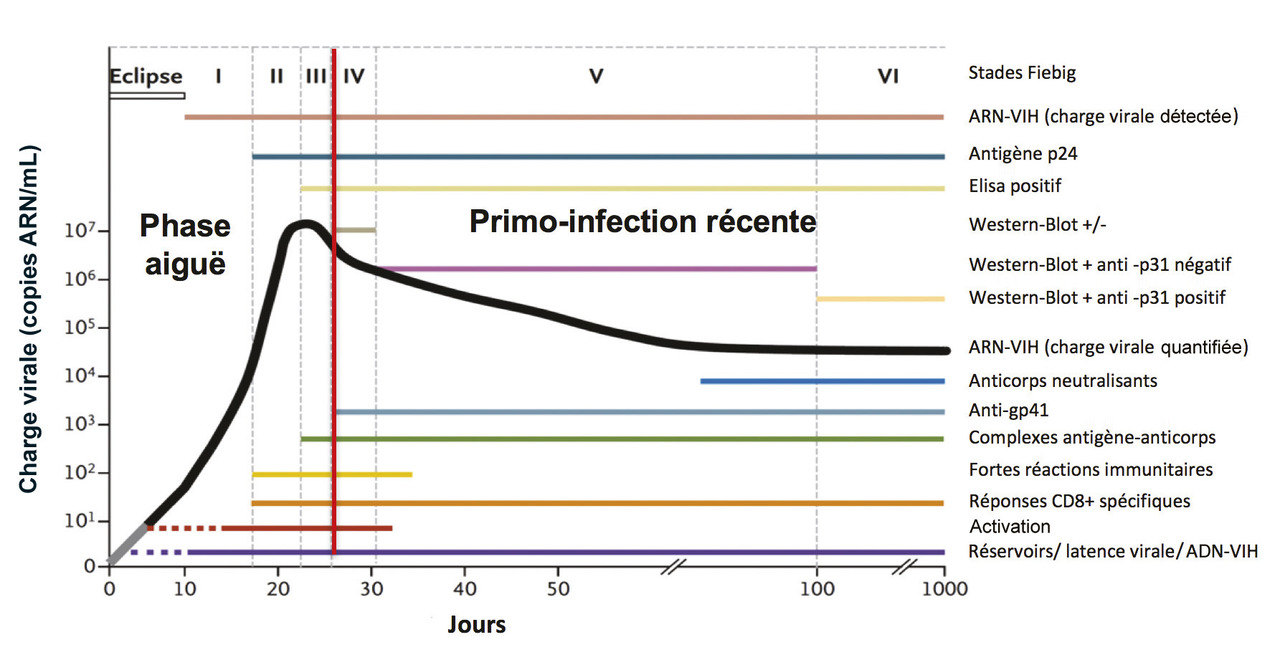
◗ infection aiguë : le test de dépistage ELISA est négatif ou faiblement positif avec un test western-blot de confirmation négatif ou incomplet (moins d’un type d’anticorps décelé) ; la charge virale ARN-VIH est positive et/ou l’antigène viral p24 est positif ; ◗ infection récente : le test ELISA est positif avec un test western-blot de confirmation incomplet (plus de deux types d’anticorps décelés, avec présence d’un anticorps anti-p24 associé à un anticorps anti-gp160 ou un anticorps anti-gp120 ou un anticorps anti-gp41). La charge virale ARN-VIH est positive et/ou l’antigène p24 est positif. Il existe une fenêtre sérologique de 20-21 jours à partir de la contamination durant laquelle les tests sérologiques sont négatifs. Ils doivent être répétés 3 à 4 semaines plus tard et sont alors habituellement positifs.
Dans une situation évocatrice de primo-infection par le VIH, le premier marqueur à se positiver est la charge virale ARN-VIH plasmatique, dès le 11e ou le 12e jour après le contact infectant(fig. 1) .3
Le diagnostic de primo-infection par le VIH étant fortement suspecté chez M. D., une charge virale ainsi qu’une nouvelle sérologie sont réalisées.
La charge virale ARN-VIH est très élevée (9 millions de copies ARN/mL) et il existe un début de positivité du test ELISA.
Le patient est adressé en urgence en consultation de maladies infectieuses, où le diagnostic est confirmé.
◗ infection aiguë : le test de dépistage ELISA est négatif ou faiblement positif avec un test western-blot de confirmation négatif ou incomplet (moins d’un type d’anticorps décelé) ; la charge virale ARN-VIH est positive et/ou l’antigène viral p24 est positif ; ◗ infection récente : le test ELISA est positif avec un test western-blot de confirmation incomplet (plus de deux types d’anticorps décelés, avec présence d’un anticorps anti-p24 associé à un anticorps anti-gp160 ou un anticorps anti-gp120 ou un anticorps anti-gp41). La charge virale ARN-VIH est positive et/ou l’antigène p24 est positif. Il existe une fenêtre sérologique de 20-21 jours à partir de la contamination durant laquelle les tests sérologiques sont négatifs. Ils doivent être répétés 3 à 4 semaines plus tard et sont alors habituellement positifs.
Dans une situation évocatrice de primo-infection par le VIH, le premier marqueur à se positiver est la charge virale ARN-VIH plasmatique, dès le 11e ou le 12e jour après le contact infectant
Le diagnostic de primo-infection par le VIH étant fortement suspecté chez M. D., une charge virale ainsi qu’une nouvelle sérologie sont réalisées.
La charge virale ARN-VIH est très élevée (9 millions de copies ARN/mL) et il existe un début de positivité du test ELISA.
Le patient est adressé en urgence en consultation de maladies infectieuses, où le diagnostic est confirmé.
Quand initier le traitement antirétroviral ?
Tout patient chez lequel une primo-infection par le VIH est diag- nostiquée doit se voir prescrire très rapidement un traitement antirétroviral (au mieux dans les 24-48 heures).4
Ce traitement doit associer deux inhibiteurs nucléosidiques de la transcriptase inverse (INTI) [ténofovir emtricitabine] et un 3e agent qui est soit un inhibiteur de la protéase (IP) [darunavir 800 mg « boosté » par du ritonavir 100 mg], soit un inhibiteur d’intégrase de 2e génération (INI) [dolutégravir, bictégravir].
Ce choix est fait en l’absence des résultats du typage HLA-B*5701 (qui a pour but de dépister une intolérance à l’abacavir, dans le cas où l’on souhaiterait prescrire cet autre antirétroviral ultérieurement) et du test génotypique de résistance aux antirétroviraux.
Le traitement sera secondairement adapté, si besoin, selon les résultats des bilans réalisés le jour même.
Le patient est alors prélevé, et informé clairement des risques de transmission du VIH à son entourage ainsi que des mesures de prévention indispensables, et repart le jour même avec un traitement antirétroviral associant ténofovir-emtricitabine et darunavir 800-ritonavir 100, sans attendre les résultats des prélèvements.
Ce traitement doit associer deux inhibiteurs nucléosidiques de la transcriptase inverse (INTI) [ténofovir emtricitabine] et un 3e agent qui est soit un inhibiteur de la protéase (IP) [darunavir 800 mg « boosté » par du ritonavir 100 mg], soit un inhibiteur d’intégrase de 2e génération (INI) [dolutégravir, bictégravir].
Ce choix est fait en l’absence des résultats du typage HLA-B*5701 (qui a pour but de dépister une intolérance à l’abacavir, dans le cas où l’on souhaiterait prescrire cet autre antirétroviral ultérieurement) et du test génotypique de résistance aux antirétroviraux.
Le traitement sera secondairement adapté, si besoin, selon les résultats des bilans réalisés le jour même.
Le patient est alors prélevé, et informé clairement des risques de transmission du VIH à son entourage ainsi que des mesures de prévention indispensables, et repart le jour même avec un traitement antirétroviral associant ténofovir-emtricitabine et darunavir 800-ritonavir 100, sans attendre les résultats des prélèvements.
Dans quel but ?
La primo-infection par le VIH est un moment clé de la dissémination du virus dans l’organisme, notamment dans les cellules cibles : les lymphocytes T CD4 latents à longue demi-vie.5
Par ailleurs, l’intégration du génome viral dans le génome des cellules infectées conduit, dès les premiers jours de l’infection, à la constitution de réservoirs pour le VIH. Ce génome viral intégré est inductible, c’est-à-dire capable, si la cellule hôte est activée, de produire des virus infectieux.
Lorsque le traitement est débuté durant la primo-infection, la décroissance de l’ADN-VIH intégré dans le génome des cellules cibles est d’autant plus importante que le traitement est débuté précocement. Le traitement limite aussi la constitution des autres réservoirs cellulaires et tissulaires et réduit l’activation immunitaire précoce, tout en préservant l’intégrité de la barrière intestinale (en réduisant le niveau d’infection du tissu lymphoïde digestif).
L’impact immuno-virologique est d’autant plus important que le traitement est débuté tôt après la contamination, il permet de préserver les lymphocytes CD4 et de normaliser plus fréquemment le ratio CD4/CD8 par rapport à un traitement initié après la primo-infection.
Le patient est revu deux semaines après le début du traitement.
Par ailleurs, l’intégration du génome viral dans le génome des cellules infectées conduit, dès les premiers jours de l’infection, à la constitution de réservoirs pour le VIH. Ce génome viral intégré est inductible, c’est-à-dire capable, si la cellule hôte est activée, de produire des virus infectieux.
Lorsque le traitement est débuté durant la primo-infection, la décroissance de l’ADN-VIH intégré dans le génome des cellules cibles est d’autant plus importante que le traitement est débuté précocement. Le traitement limite aussi la constitution des autres réservoirs cellulaires et tissulaires et réduit l’activation immunitaire précoce, tout en préservant l’intégrité de la barrière intestinale (en réduisant le niveau d’infection du tissu lymphoïde digestif).
L’impact immuno-virologique est d’autant plus important que le traitement est débuté tôt après la contamination, il permet de préserver les lymphocytes CD4 et de normaliser plus fréquemment le ratio CD4/CD8 par rapport à un traitement initié après la primo-infection.
Le patient est revu deux semaines après le début du traitement.
Quel calendrier de suivi ?
Les visites après l’introduction du traitement en cas de primo-infection doivent être plus rapprochées que lors d’un traitement initié au stade chronique car, dans cette situation, les patients sont souvent symptomatiques, et le temps de préparation au traitement est réduit.
Ainsi, il est recommandé de revoir les patients à J15, M1, M2, M3 et M6, pour un contrôle clinique et juger de la tolérance immédiate aux antirétroviraux, pour instituer un suivi immunovirologique (à M1, M3, M6) et entreprendre une éducation thérapeutique.4
Chez M. D., l’observance du traitement semble bonne ainsi que la tolérance clinique.
Le génotypage de résistance initial ne comporte pas de mutations de résistance du virus aux antirétroviraux.
Toutefois, le bilan biologique réalisé à M1 met en évidence une élévation des transaminases à 4 ou 5 fois la valeur normale, élévation non présente sur le bilan initial et sans autre manifestation ou perturbation du bilan biologique.
Ainsi, il est recommandé de revoir les patients à J15, M1, M2, M3 et M6, pour un contrôle clinique et juger de la tolérance immédiate aux antirétroviraux, pour instituer un suivi immunovirologique (à M1, M3, M6) et entreprendre une éducation thérapeutique.4
Chez M. D., l’observance du traitement semble bonne ainsi que la tolérance clinique.
Le génotypage de résistance initial ne comporte pas de mutations de résistance du virus aux antirétroviraux.
Toutefois, le bilan biologique réalisé à M1 met en évidence une élévation des transaminases à 4 ou 5 fois la valeur normale, élévation non présente sur le bilan initial et sans autre manifestation ou perturbation du bilan biologique.
Que faire si une perturbation du bilan hépatique apparaît ?
Lors de l’instauration d’un traitement antirétroviral, une surveillance biologique hépatique rapprochée doit être proposée.
Cette évaluation hépatique initiale a pour but de rechercher non seulement une hépatite C présente chez près de 3,3 % des malades et une hépatite B présente chez près de 2,0 % des malades au stade de la primo-infection par le VIH,6 mais aussi d’autres atteintes hépatiques telles que celles liées à l’alcool ou à la stéato-hépatite non alcoolique d’origine souvent métabolique.
Une atteinte hépatique cytolytique cholestatique ou mixte impose d’en évaluer la gravité, le retentissement clinique et d’en déterminer la cause.
Cette évaluation hépatique initiale a pour but de rechercher non seulement une hépatite C présente chez près de 3,3 % des malades et une hépatite B présente chez près de 2,0 % des malades au stade de la primo-infection par le VIH,6 mais aussi d’autres atteintes hépatiques telles que celles liées à l’alcool ou à la stéato-hépatite non alcoolique d’origine souvent métabolique.
Une atteinte hépatique cytolytique cholestatique ou mixte impose d’en évaluer la gravité, le retentissement clinique et d’en déterminer la cause.
Comment évaluer la gravité de l’atteinte hépatique ?
Il faut rechercher des signes d’hypersensibilité (rash cutané, fièvre...), des signes de gravité (ictère, chute du taux de prothrombine, hypoalbuminémie, élévation de la bilirubine conjuguée, signe d’encéphalopathie hépatique). La gravité de l’atteinte hépatique est classée selon le degré d’augmentation des transaminases par rapport à leur valeur normale (ainsi, par exemple, le grade 4 correspond à une valeur des transaminases supérieure à 10 fois la normale) [tableau 2] .7
Quel est l’impact clinique ?
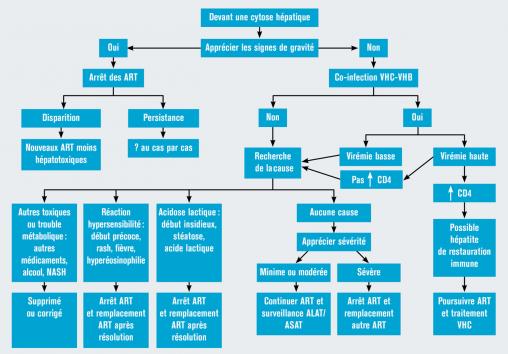
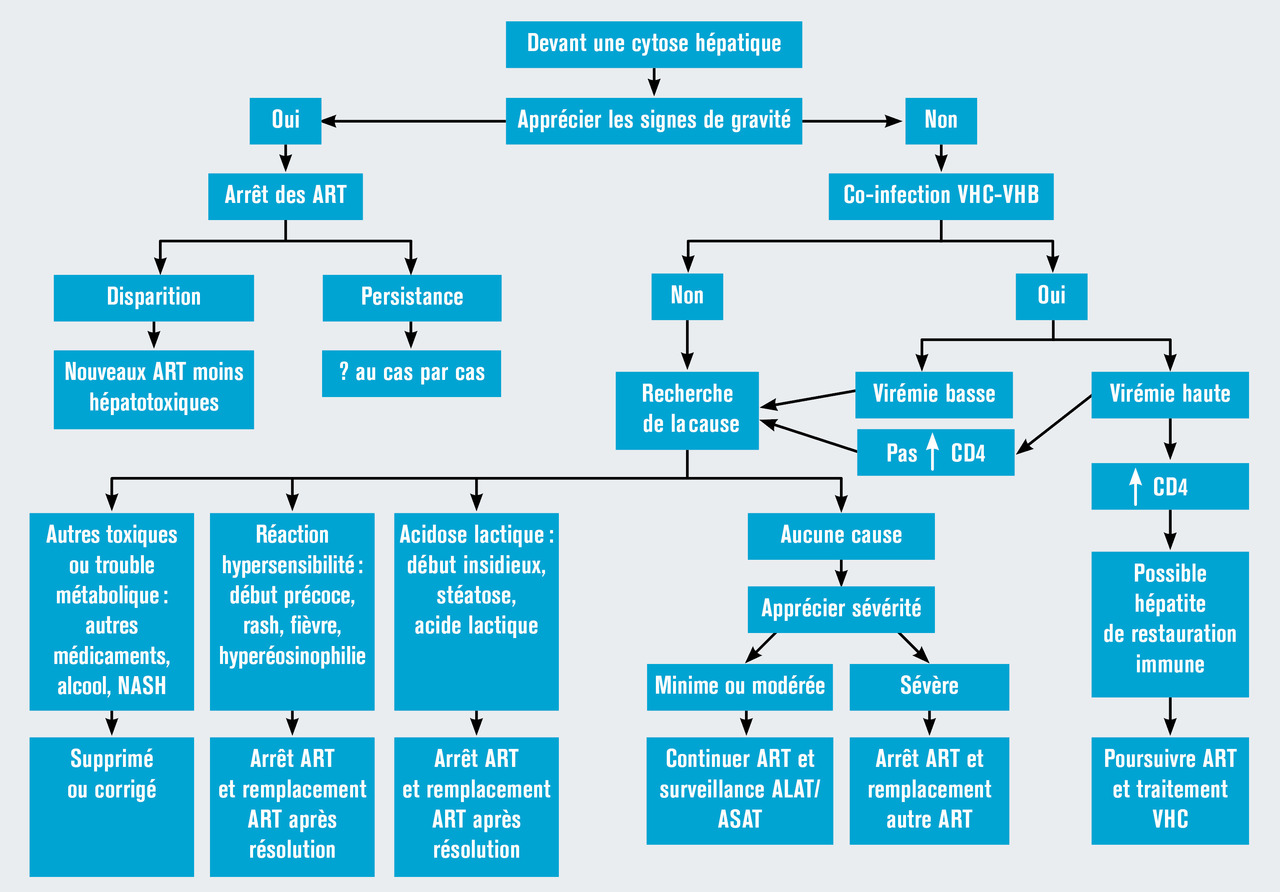
Devant une cytolyse de grade 2, celle-ci pouvant disparaître spontanément, une attitude d’attente s’impose le plus souvent.
En cas d’élévation des transaminases de grade plus sévère, il faut modifier le traitement antirétroviral en essayant de remplacer les antirétroviraux les plus hépatotoxiques.
En cas d’élévation des transaminases de grade plus sévère, il faut modifier le traitement antirétroviral en essayant de remplacer les antirétroviraux les plus hépatotoxiques.
Quelles causes ?
En cas d’élévation asymptomatique des transaminases, il faut d’abord rechercher par l’interrogatoire la prise d’autres nouveaux médicaments et la chronologie des événements ainsi que la consommation d’autres toxiques (alcool ou drogues) ou la présence d’une stéato-hépatite non alcoolique liée le plus souvent à une insulinorésistance.
Il est aussi nécessaire de vérifier l’absence d’hépatite aiguë virale A ou B chez les malades non vaccinés ou C chez les malades ayant des pratiques à risque, sans oublier de rechercher une hépatite à CMV, EBV ou herpétique ou liée à une syphilis.
Dans cette situation, il s’agit d’une élévation des transaminases de faible grade 2.
Il n’y a pas eu de prise de toxique récente, aucune comorbidité ou co-infection n’a été mise en évidence chez ce patient.
La valeur des transaminases est finalement rentrée dans l’ordre 2 mois après l’instauration du traitement antirétroviral. Les anomalies du bilan hépatique sont fréquentes sous antirétroviraux, mettant en jeu plusieurs mécanismes. À l’initiation du traitement, il s’agit le plus souvent d’une hépatite immuno-allergique (fig. 2 ).
Il est aussi nécessaire de vérifier l’absence d’hépatite aiguë virale A ou B chez les malades non vaccinés ou C chez les malades ayant des pratiques à risque, sans oublier de rechercher une hépatite à CMV, EBV ou herpétique ou liée à une syphilis.
Dans cette situation, il s’agit d’une élévation des transaminases de faible grade 2.
Il n’y a pas eu de prise de toxique récente, aucune comorbidité ou co-infection n’a été mise en évidence chez ce patient.
La valeur des transaminases est finalement rentrée dans l’ordre 2 mois après l’instauration du traitement antirétroviral. Les anomalies du bilan hépatique sont fréquentes sous antirétroviraux, mettant en jeu plusieurs mécanismes. À l’initiation du traitement, il s’agit le plus souvent d’une hépatite immuno-allergique (
*Pour le score de Mac Isaac voir www.has-sante.fr ou https://bit.ly/2HYhuKI
Références
1. Yeni P. Prise en charge médicale des personnes infectées par le VIH. Recommandation du groupe d’experts. Rapport 2010. Paris : Médecines‐Sciences Flammarion Paris, 2010:210.
2. Ghosn J, Persoz M, Zitoun Y, et al. Thrombocytopenia during primary HIV-1 infection predicts the risk of recurrence during chronic infection. JAIDS 2012;60:112-5.
3. Cohen MS, Shaw GM, McMichael AJ, Haynes BF. Acute HIV-1 infection. N Engl J Med 2011;364:1943-54.
4. Morlat P. Prise en charge médicale des personnes vivant avec le VIH. Recommandations du groupe d’experts. Primo-infection à VIH (décembre 2016). Rapport 2018.
5. Laanani M, Ghosn J, Essat A, et al. Impact of the timing of initiation of antiretroviral therapy during primary HIV-1 infection on the decay of cell-associated HIV-DNA. Clin Infect Dis 2015;60:1715-21.
6. Krastinova E, Seng R, Yeni P, et al. Is clinical practice concordant with the changes in guidelines 262 for antiretroviral therapy initiation during primary and chronic HIV-1 infection? The ANRS PRIMO 263 and COPANA cohorts. PLoS One 2013;8:e71473.
7. National Institutes of Health. Severity grading in drug induced liver injury. National Institutes of Health: Bethesda. Record updated, 16 October 2017. https://livertox.nih.gov/Severity.html#top
8. Bourlière M, Diclos-Vallée JC, Pol S. Liver and antiretrovirals: hepatotoxicity, steatosis and monitoring of patients with liver disease. Gastroenterol Clin Biol 2007;31:895-905.
2. Ghosn J, Persoz M, Zitoun Y, et al. Thrombocytopenia during primary HIV-1 infection predicts the risk of recurrence during chronic infection. JAIDS 2012;60:112-5.
3. Cohen MS, Shaw GM, McMichael AJ, Haynes BF. Acute HIV-1 infection. N Engl J Med 2011;364:1943-54.
4. Morlat P. Prise en charge médicale des personnes vivant avec le VIH. Recommandations du groupe d’experts. Primo-infection à VIH (décembre 2016). Rapport 2018.
5. Laanani M, Ghosn J, Essat A, et al. Impact of the timing of initiation of antiretroviral therapy during primary HIV-1 infection on the decay of cell-associated HIV-DNA. Clin Infect Dis 2015;60:1715-21.
6. Krastinova E, Seng R, Yeni P, et al. Is clinical practice concordant with the changes in guidelines 262 for antiretroviral therapy initiation during primary and chronic HIV-1 infection? The ANRS PRIMO 263 and COPANA cohorts. PLoS One 2013;8:e71473.
7. National Institutes of Health. Severity grading in drug induced liver injury. National Institutes of Health: Bethesda. Record updated, 16 October 2017. https://livertox.nih.gov/Severity.html#top
8. Bourlière M, Diclos-Vallée JC, Pol S. Liver and antiretrovirals: hepatotoxicity, steatosis and monitoring of patients with liver disease. Gastroenterol Clin Biol 2007;31:895-905.
Une question, un commentaire ?
Sur le même thème
Article Web
Article Web
Article Web