Or, en 2018, la couverture vaccinale française contre l’infection à papillomavirus n’est que de 29,4 % pour l’injection d’au moins une dose à 15 ans et de 23,7 % pour deux doses à 16 ans. Elle n’a jamais dépassé 30 %, en dépit des preuves de l’efficacité des vaccins contre les HPV en vie réelle et d’une littérature scientifique indépendante démontrant leur sécurité. La situation de la France est atypique par rapport à ce qui est observé dans la majorité des pays européens voisins qui affichent des taux de couverture vaccinale supérieurs à 80 % (Royaume-Uni, Portugal, Suède, Norvège, Islande).
Une infection sexuellement transmissible
Les infections à HPV font partie des infections sexuellement transmissibles les plus fréquentes au niveau mondial. La plupart des femmes et des hommes sexuellement actifs seront infectés par ces virus au cours de leur vie.
Près de 90 % des infections détectées sont éliminées naturellement dans les 2 ans. Mais si l’infection persiste, elle peut entraîner, selon le degré de risque oncogène de la souche HPV en cause, le développement de condylomes ou de lésions précancéreuses et cancéreuses atteignant le col de l’utérus mais aussi l’anus, l’oropharynx, la vulve, le vagin, le pénis, la cavité orale et le larynx.
Ces infections peuvent être transmises malgré l’usage de préservatifs via les zones génitales non couvertes par celui-ci. Le sexe oral est aussi un mode de transmission de ces virus.
Cancers liés aux infections par les HPV
Les principaux enjeux de santé publique relatifs aux cancers liés aux HPV sont :
– les conséquences des traitements utilisés (conisations) contre les lésions précancéreuses du cancer du col de l’utérus qui exposent au risque d’accouchement prématuré et de décès périnatal. Or au moins 18 000 femmes de moins de 39 ans ont été traitées pour des lésions précancéreuses en 2016. À partir d’une méta-analyse, il a été estimé que la réalisation de 143 conisations à l’anse diathermique entraîne une naissance avant 32 à 34 semaines d’aménorrhée ;5
– l’âge de survenue des cancers du col de l’utérus ; la moitié des cancers sont diagnostiqués avant 51 ans, contre 63 ans pour le cancer du sein et 75 ans pour le cancer colorectal chez la femme ;6
– la part des femmes ayant réalisé un dépistage sur la période 2010-2013 (taux de couverture en participation spontanée) était seulement de 61 % sur 4 ans et variait de 52 % à 72 % selon les départements ;
– l’augmentation de l’incidence annuelle du cancer de l’anus : + 3,3 % chez les hommes et + 5,7 % chez les femmes, entre 2010 et 2018 ;7
– l’augmentation de l’incidence des cancers oropharyngés dans certains pays (États-Unis, Danemark, Suède) ;
– la survie nette à 5 ans des femmes atteintes de cancer du col de l’utérus tend à se dégrader, passant de 68 % pour celles diagnostiquées entre 1989 et 1993 à 63 % pour celles diagnostiquées entre 2005 et 2010.8 L’hypothèse évoquée pour expliquer ce phénomène est qu’avec le développement du dépistage les cancers restants sont de plus mauvais pronostic (cancers non dépistés, cancers de femmes n’effectuant pas de dépistage).
Prévention du cancer du col utérin : deux moyens complémentaires
Concernant la vaccination (prévention primaire), la recommandation actuelle du Haut Conseil de la santé publique est de vacciner prioritairement les jeunes filles (deux doses entre 11 et 14 ans, ou trois doses entre 15 et 19 ans) et les hommes qui ont des relations sexuelles avec des hommes (trois doses jusqu’à 26 ans), avec Gardasil 9.
Le dépistage du cancer du col de l’utérus (prévention secondaire) est recommandé à toutes les femmes de 25 à 65 ans, ayant ou ayant eu des rapports sexuels. Il doit être poursuivi après la ménopause.
En France, le programme national de dépistage organisé du cancer du col de l’utérus, déployé à partir de 2018, concerne l’ensemble des femmes de 25 à 65 ans. Son objectif est de réduire l’incidence et le nombre de décès par cancer du col de l’utérus de 30 % à 10 ans, en atteignant 80 % de taux de couverture dans la population cible et en rendant le dépistage plus facilement accessible aux populations vulnérables et/ou les plus éloignées du système de santé. Le programme vise aussi à améliorer la qualité des pratiques de dépistage et de suivi des femmes (action 1.1 du Plan cancer 2014-2019).
Il s’adresse également aux femmes qui sont vaccinées contre les HPV. Le dépistage se pratique tous les 3 ans, après deux premiers frottis réalisés à un an d’intervalle et dont les résultats sont normaux. L’examen cytologique de cellules prélevées au niveau du col de l’utérus, suivi d’une recherche d’HPV en cas de résultat positif permet de dépister les lésions précancéreuses et les cancers à un stade permettant plus facilement leur traitement et leur guérison. À noter que chaque année en France environ 10 % des frottis sont réalisés chez des femmes âgées de moins de 25 ans alors que les recommandations précisent que celui-ci doit être initié à 25 ans.9 Ces actes, pour la plupart non nécessaires, peuvent entraîner des traitements inutiles. Par ailleurs, le nombre de frottis réalisés en 2003-2005 correspondait à un taux de couverture de près de 90 % de la population cible si les femmes ne faisaient qu’un seul frottis tous les 3 ans. Or le taux de couverture 2003-2005 était de 58 % de la population cible, signifiant que certaines femmes se font dépister à un rythme plus fréquent tandis que d’autres se font peu ou pas dépister.10
Des inégalités socio-économiques de recours d’accès à ces deux méthodes de prévention ont été décrites, notamment chez les femmes ne disposant pas de couverture complémentaire privée et vivant dans une famille à faibles revenus.11
Données sur l’efficacité et la sécurité de la vaccination contre les HPV
Actuellement, trois vaccins ont obtenu une autorisation de mise sur le marché (AMM), en Europe :
– le vaccin bivalent Cervarix qui protège contre les HPV 16, 18 ;
– le vaccin quadrivalent Gardasil qui protège contre les HPV 6, 11, 16, 18 ;
– le vaccin nonavalent Gardasil 9 qui protège contre les HPV 6, 11, 16, 18, 31, 33, 45, 52, 58.
Ces trois vaccins sont commercialisés en France.
Efficacité attendue des vaccins
Selon les données de la littérature,12-14 les HPV16 et 18 couverts par les vaccins Gardasil et Cervarix sont à l’origine de 45 à 60 % des lésions précancéreuses (CIN2/3) et 70 % des cancers du col de l’utérus. Commercialisé depuis 2018, le vaccin Gardasil 9 cible un plus grand nombre d’HPV oncogènes : les HPV 16/18/31/33/45/52/58, en cause dans 80 % des lésions CIN2+ et 90 % des cancers du col de l’utérus. Par ailleurs, les HPV 6 et 11 couverts par les vaccins Gardasil et Gardasil 9 sont responsables de 90 % des condylomes. En raison de la meilleure protection offerte par le vaccin Gardasil 9, le calendrier vaccinal recommande que les nouvelles vaccinations soient initiées préférentiellement avec Gardasil 9.
On dispose aujourd’hui de données solides démontrant leur efficacité en vie réelle sur plusieurs indicateurs précoces (réduction de la prévalence des infections à HPV, des condylomes, et de l’incidence des lésions précancéreuses du col de l’utérus chez les femmes vaccinées par rapport aux non vaccinées) et leur impact (diminution des infections à HPV, des condylomes et des lésions précancéreuses) dans la population en comparaison avec la situation prévaccinale. Par exemple, en Australie, le taux de détection des lésions précancéreuses du col de l’utérus parmi les femmes dépistées a fortement diminué entre 2004-2006 et 2016, passant de 13,6 à 3,9 (soit divisé par 3 et demi) pour 1 000 femmes âgées de moins de 20 ans, et de 20,1 à 10,6 (soit divisé par 2) pour 1 000 femmes âgées de 20 à 24 ans.15
Par ailleurs, une revue systématique de 2016, incluant 58 articles mesurant l’efficacité en vie réelle du vaccin quadrivalent, a conclu que les réductions maximales attendues étaient de 90 % pour les infections à HPV de sérotypes 6, 11, 16 et 18, de 90 % pour les condylomes, de 45 % pour les anomalies cervicales de bas grade, et de 85 % pour les anomalies cervicales de haut grade.
Sécurité des vaccins contre les HPV et interrogations autour du syndrome de Guillain-Barré
Une étude française,17 menée conjointement par l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) et la Caisse nationale d’assurance maladie, a été réalisée afin de déterminer si le vaccin était à l’origine de maladies auto-immunes. L’étude a analysé une cohorte de 2,2 millions de jeunes filles âgées de 13 à 16 ans, montrant que la vaccination par Gardasil ou Cervarix n’entraînait pas d’augmentation du risque global de survenue de maladies auto-immunes, confirmant ainsi les données déjà publiées. Cette étude a cependant montré qu’une augmentation du risque de syndrome de Guillain- Barré après vaccination contre les HPV apparaissait probable. Ce syndrome était déjà identifié dans l’AMM du produit. De surcroît, les conséquences potentielles de la vaccination sont limitées (1 ou 2 cas pour 100 000 filles vaccinées). Compte tenu de la rareté de la maladie, les deux institutions estiment que les résultats de cette étude ne remettent pas en cause la balance bénéfice-risque des vaccins concernés.
En outre, des études internationales récentes18,19 ne trouvent pas d’association entre le syndrome de Guillain- Barré et la vaccination contre les HPV, dont une étude incluant une population ayant reçu 10,4 millions de doses.
L’analyse de la littérature montre que les effets indésirables graves allégués des vaccins contre les papillomavirus ne sont pas confirmés scientifiquement. Cependant, la médiatisation de controverses non validées scientifiquement a eu un impact négatif sur les couvertures vaccinales dans certains pays (France, Danemark, Japon).
Acceptabilité de la vaccination contre les HPV
Par ailleurs, près d’un médecin sur trois ne proposait que rarement ou jamais cette vaccination en 2014.20
Cette situation est problématique dans un contexte de vaccination non organisée, et ce d’autant qu’une étude française a montré que le premier facteur ayant un impact significatif sur la probabilité des filles d’être vaccinées était le fait d’avoir un médecin traitant favorable à la vaccination.21 De plus, selon les analyses du Baromètre santé 2016, la majorité des parents (81 %) déclarent s’informer prioritairement auprès d’un médecin pour obtenir des informations sur les vaccinations.
Une vaccination à revaloriser
– le site du ministère chargé de la Santé et de Santé publique France :
– le dossier « La vaccination contre les infections liées aux papillomavirus humains (HPV) pour prévenir le cancer du col de l’utérus » et la fiche repère « Papillomavirus et cancer » sur le site
Par ailleurs, la recommandation de l’extension de la vaccination aux garçons dans un nombre croissant de pays (Australie, Royaume-Uni, Norvège, États-Unis, Canada, etc.) est un autre levier de prévention des cancers liés aux HPV. La Haute Autorité de santé est en cours d’évaluation de l’opportunité de l’extension aux garçons de la vaccination contre les HPV en France. >>>
Comment expliquer l’augmentation de l’incidence du cancer du col utérin chez les femmes de moins de 50 ans Dans certains pays ?
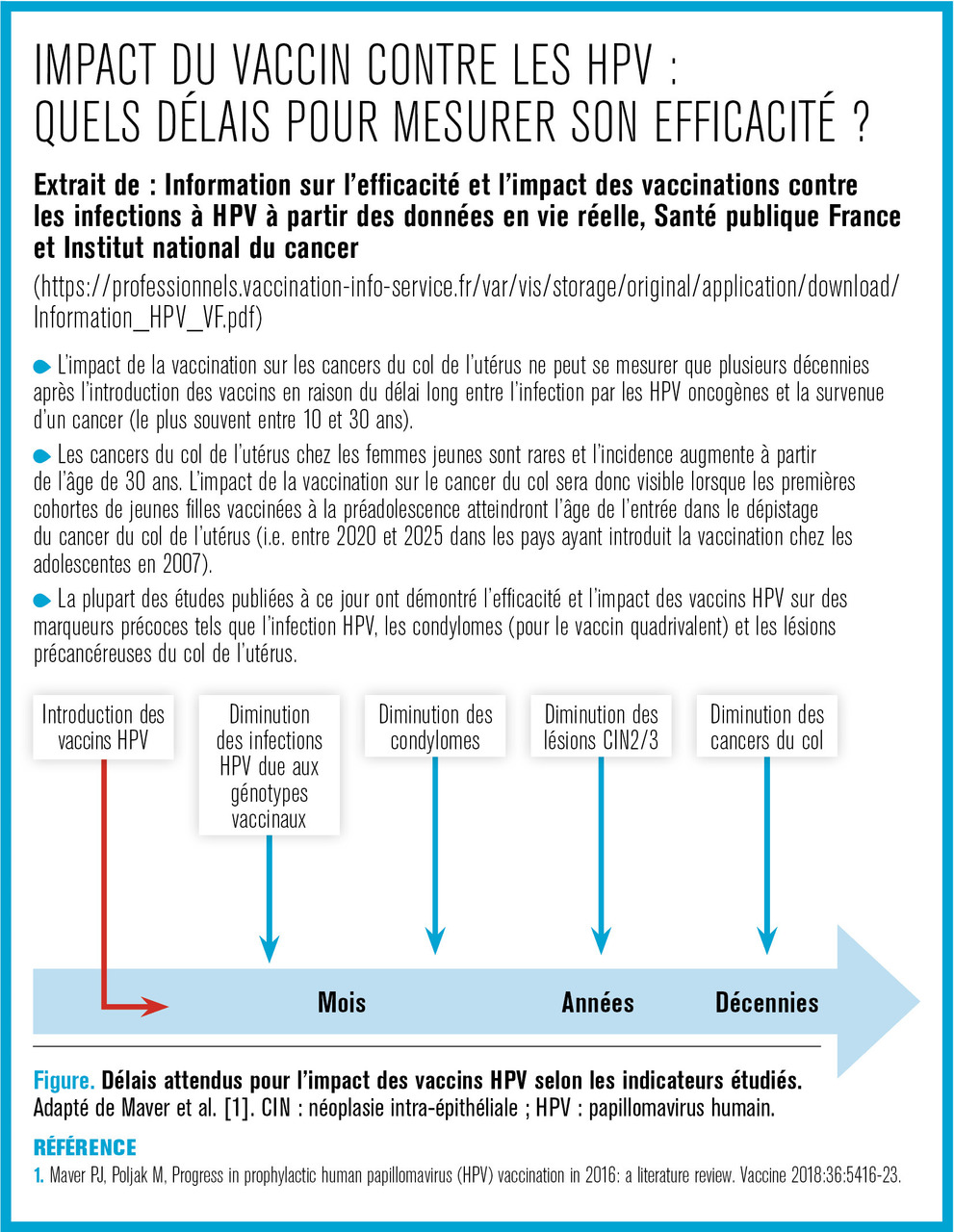
Extrait de : Information sur l’efficacité et l’impact des vaccinations contre les infections à HPV à partir des données en vie réelle, Santé publique France et Institut national du cancer
(https://professionnels.vaccination-info-service.fr/var/vis/storage/original/application/download/Information_HPV_VF.pdf)
Dans certains pays ayant mis en place des programmes de vaccination avec des couvertures vaccinales élevées, il est observé une augmentation de l’incidence du cancer du col de l’utérus depuis quelques années chez les femmes âgées de moins de 50 ans (Angleterre, Japon, Suède, Australie).1-3 Des publications sur Internet et dans les médias ont repris ces données en remettant en question l’efficacité des vaccins contre les HPV. En effet, si les données disponibles ne montrent pas de lien entre la vaccination et ces augmentations d’incidence, elles plaident surtout en faveur de la nécessité de promouvoir la vaccination pour les filles dans un contexte d’augmentation de l’incidence du cancer du col de l’utérus dans certains pays.
En tout premier lieu, il est important de noter que les premières années concernées par des augmentations d’incidence de cancer du col de l’utérus dans ces pays se situent au tout début des années 2000, soit en amont de l’introduction des vaccins contre les infections à HPV. De plus, les données d’incidence disponibles sont au mieux celles des années 2014-2015 avec des tendances marquées chez les femmes à partir de 25 ans. Ainsi, les femmes appartenant à cette tranche d’âge n’ont, dans leur très grande majorité, pas été vaccinées, ou si elles l’ont été, ont été vaccinées après 17 ans, en rattrapage (soit potentiellement après une infection par HPV).
Les raisons de ces évolutions sont à investiguer en fonction du contexte de chaque pays car les causes de l’évolution de l’incidence du cancer du col de l’utérus peuvent être multiples, par exemple : évolution du taux de participation et des modalités de dépistage du cancer du col de l’utérus, évolution des comportements sexuels (âge des premiers rapports sexuels, nombre de partenaires, type de pratique sexuelle), avec pour conséquence une augmentation de l’exposition aux HPV.
En Angleterre, une augmentation de l’incidence du cancer du col utérin a été observée dès le début des années 2000 (soit bien avant l’introduction des vaccins contre les HPV en 2008) chez les femmes âgées de 25 à 35 ans. Une augmentation a également été observée chez les femmes âgées de 20 à 24 ans. Toutefois, cette dernière augmentation a été mise en relation avec les changements dans la stratégie de dépistage avec l’abaissement de l’âge de la première invitation au dépistage de 25 ans à 24,5 ans.1 Les données publiées montrent l’absence d’augmentation de l’incidence du cancer du col de l’utérus pour les femmes de moins de 24,5 ans.
Au Japon, l’incidence du cancer du col utérin est en augmentation depuis la fin des années 1990 chez les femmes de 20 à 49 ans, soit avant l’arrivée des vaccins contre les HPV (commercialisés à partir de 2009 et intégrés dans le calendrier vaccinal en 2013). Cette augmentation serait en relation avec un changement dans les comportements sexuels ayant entraîné une augmentation des infections par HPV chez les femmes de moins de 50 ans.2
En Suède, une augmentation de l’incidence du cancer du col a été observée à partir du début des années 2000 chez les femmes de 20 à 39 ans. Pour interpréter ces données, il faut considérer que les jeunes femmes de 20-24 ans en 2014 ont été peu vaccinées, et que les femmes vaccinées l’ont surtout été en rattrapage. Au 31/12/2011, la couverture vaccinale était estimée entre 13 et 34 % selon l’année de naissance chez les femmes nées entre 1990 et 1994 (soit âgées de 17 à 21 ans en 2011, et de 20 à 24 ans en 2014).3 Les femmes vaccinées dans le cadre du programme organisé de vaccination scolaire, mis en place en Suède en 2012 pour les filles âgées de 10-12 ans, entreront dans le dépistage à partir de 2023. Il est trop tôt pour observer un impact de la vaccination sur les cancers du col à partir des données des registres.
En Australie, une augmentation de l’incidence des cancers du col de l’utérus a été observée depuis le milieu des années 2000 chez les femmes âgées de 25 à 44 ans. En revanche, l’analyse des données sur la période 2007-2014 ne montre pas d’augmentation d’incidence du cancer du col chez les femmes de 20 à 24 ans dont certaines ont pu être vaccinées (essentiellement en rattrapage). Les premières cohortes de femmes vaccinées à 12-13 ans en 2007 entreront dans le programme de dépistage du cancer du col de l’utérus en 2019-2020. Il est encore trop tôt pour observer un impact de la vaccination sur les cancers du col de l’utérus à partir des données des registres.
En tout état de cause, les nombres de cancer et les tendances rapportés chez les femmes de moins 25 ans sont à interpréter avec une grande prudence compte tenu du très faible nombre de cas dans cette classe d’âge et du délai entre l’infection et le cancer (le plus souvent au moins 10 ans, rarement inférieur à 8 ans). Un cancer diagnostiqué en 2015 est donc très vraisemblablement lié à une infection antérieure à 2007, année des premières introductions des vaccins contre les HPV chez les adolescentes dans le monde. Dans leur très grande majorité, les cancers diagnostiqués jusqu’en 2015 ne pouvaient donc pas être évités par la vaccination, y compris chez les femmes vaccinées à partir de 2007. L’impact de la vaccination sera visible lorsque les premières jeunes femmes vaccinées entreront dans les programmes de dépistage du cancer du col de l’utérus.
2. Utada M, Chernyavskiy P, Lee WJ, et al. Increasing risk of uterine cervical cancer among young Japanese women: Comparison of incidence trends in Japan, South Korea and Japanese-Americans between 1985 and 2012. Int J Cancer 2019;144:2144-52.
3. Dillner J, Nygard M, Munk C, Hortlund M, Hansen BT, Lagheden C, et al. Decline of HPV infections in Scandinavian cervical screening populations after introduction of HPV vaccination programs. Vaccine 2018;36:3820-9.
2. Données PMSI, 2016 (Extraction du nombre d’actes [code JKFA031] réalisés en 2016 - Traitements INCa).
3. Shield KD, Marant Micallef C, de Martel C, et al. New cancer cases in France in 2015 attributable to infectious agents: a systematic review and meta-analysis. Eur J Epidemiol 2018;33:263-74.
4. Shield KD, Micallef CM, de Martel C, et al. New cancer cases in France in 2015 attributable to infectious agents: a systematic review and meta-analysis. Eur J Epidemiol 2018;33 :263-74.
5. Arbyn M, Kyrgiou M, Simoens C, et al. Perinatal mortality and other severe adverse pregnancy outcomes associated with treatment of cervical intraepithelial neoplasia:meta-analysis. BMJ 2008;337:a1284.
6. Binder-Foucard F, Belot A, Delafosse P, et al. Estimation nationale de l’incidence et de la mortalité par cancer en France entre 1980 et 2012. Partie 1 – Tumeurs solides. Saint-Maurice (Fra) : Institut de veille sanitaire, 2013.
7. Defossez G, Le Guyader-Peyrou S, Uhry Z, et al. Estimations nationales de l’incidence et de la mortalité par cancer en France métropolitaine entre 1990 et 2018. Étude à partir des registres des cancers du réseau Francim. Résultats préliminaires. Rapport. Saint-Maurice (Fra) : Santé publique France, 2019.
8. Cowppli-Bony A, Uhry Z, Remontet L, et al. Survie des personnes atteintes de cancer en France métropolitaine, 1989-2013. Partie 1. Tumeurs solides. Saint-Maurice : Institut de veille sanitaire, 2016.
9. Maura G, Chaignot C, Weill A, et al. Dépistage du cancer du col de l’utérus et actes associés chez les femmes de moins de 25 ans entre 2007 et 2013 en France : une étude sur les bases de données médico-administratives françaises. Bull Epidemiol Hebd 2017;2-3:32-8.
10. Duport N. Données épidémiologiques sur le cancer du col de l’utérus. État des connaissances – actualisation 2008. Institut de veille sanitaire.
11. Guthmann JP, Pelat C, Célant N, et al. Inégalités socioéconomiques d’accès à la vaccination contre les infections à papillomavirus humains en France : résultats de l’Enquête santé et protection sociale (ESPS), 2012. Bull Epidémiol Hebd 2016;16-17:288-97.
12. de Martel C, Plummer M, Vignat J, Franceschi S. Worldwide burden of cancer attributable to HPV by site, country and HPV type. Int J Cancer 2017;141:664-70.
13. De Vuyst H, Clifford G, Li N, Franceschi S. HPV infection in Europe. Eur J Cancer 2009;45:2632-9.
14. Hartwig S, St Guily JL, Dominiak-Felden G, Alemany L, de Sanjose S. Estimation of the overall burden of cancers, precancerous lesions, and genital warts attributable to 9-valent HPV vaccine types in women and men in Europe. Infect Agent Cancer 2017;12:19
15. Cervical screening in Australia. Australian Institute of Health and Welfare, 2018.
16. Arbyn M, Xu L, Simoens C, Martin-Hirsch PP. Prophylactic vaccination against human papillomaviruses to prevent cervical cancer and its precursors. Cochrane Database Syst Rev 2018 May 9;5:CD009069.
17. Agence nationale de sécurité du médicament et des produits de santé, Caisse nationale d’Assurance maladie. Vaccins anti-HPV et risques de maladies auto-immunes : étude pharmacologique. Rapport final, ANSM 2015. https://ansm.sante.fr ou http://bit.ly/2vIgVgK
18. Andrews N, Stowe J, Miller E, et al. No increased risk of Guillain-Barré syndrome after human papilloma virus vaccine: a self-controlled case-series study in England. Vaccine 2017;35:1729-32.
19. Deceuninck G, Sauvageau C, Gilca V, Boulianne N, De Serres G. Absence of association between Guillain-Barré syndrome hospitalizations and HPV-vaccine. Expert Rev Vaccines 2018;17:99-102.
20. Collange F, Fressard L, Pulcini C, Sebbah R, Peretti-Watel P, Verger P. General practitioners’ attitudes and behaviors toward HPV vaccination: A French national survey. Vaccine 2016;34:762-8.
21. Gautier A, Verger P, Jestin C, et al. Source d’information, opinions et pratiques des parents en matière de vaccination en France en 2016. Bull Epidemiol Hebd 2017; Hors-série Vaccination des jeunes enfants : des données pour mieux comprendre l’action publique:28-35.

 Encadrés
Encadrés