En France, on parle d’âge préscolaire pour les enfants de moins de 36 mois, tandis que dans les pays anglo-saxons ce terme s’applique aux enfants jusqu’à 6 ans. Cet article s’intéresse de façon globale à l’asthme chez l’enfant de moins de six ans.
Définition clinique
L’asthme est la maladie chronique non transmissible la plus courante chez les enfants, de tout âge, touchant jusqu’à 20 % d’entre eux selon les régions du monde.1 Il est plus fréquent chez les garçons, de la petite enfance jusqu’à l’adolescence, où la tendance s’inverse et la prévalence devient plus élevée chez les filles.
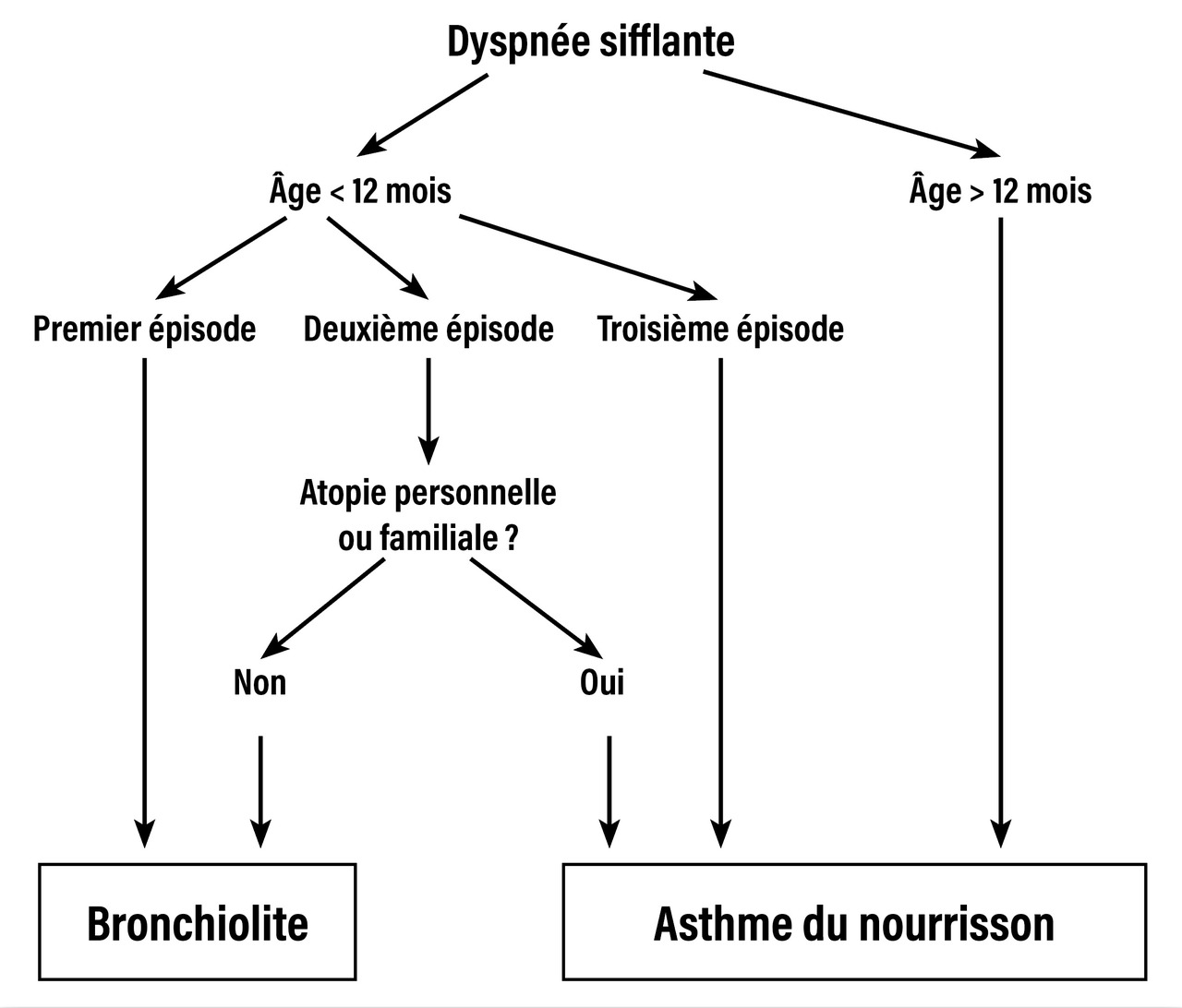
Les recommandations de la Haute Autorité de santé (HAS) de novembre 2009, toujours d’actualité, définissent l’asthme préscolaire comme « tout épisode dyspnéique avec râles sibilants, qui s’est produit au moins trois fois depuis la naissance, et cela quels que soient l’âge de début, la cause déclenchante, l’existence ou non d’une atopie ». Autrement dit, trois épisodes de « bronchiolite » avant l’âge de 3 ans doivent faire poser ce diagnostic. Les recommandations de 2019 élargissent encore cette définition, considérant comme asthme a priori toute dyspnée sifflante survenant après l’âge de 12 mois (fig. 1).2,3 De plus, d’autres tableaux cliniques doivent faire évoquer l’asthme : toux induite par l’exercice, toux nocturne, toux chronique ou récidivante, toux persistant après une bronchiolite, sifflements persistants. La Global Initiative for Asthma (GINA) définit une probabilité forte d’asthme en cas d’association de ces symptômes :4
- toux, sifflements, difficulté respiratoire persistant plus de dix jours lors des viroses ;
- plus de trois exacerbations par an ou existence d’exacerbations sévères et/ou aggravation nocturne ;
- symptômes intercritiques aux pleurs, aux rires ;
- atopie personnelle ou familiale au premier degré.
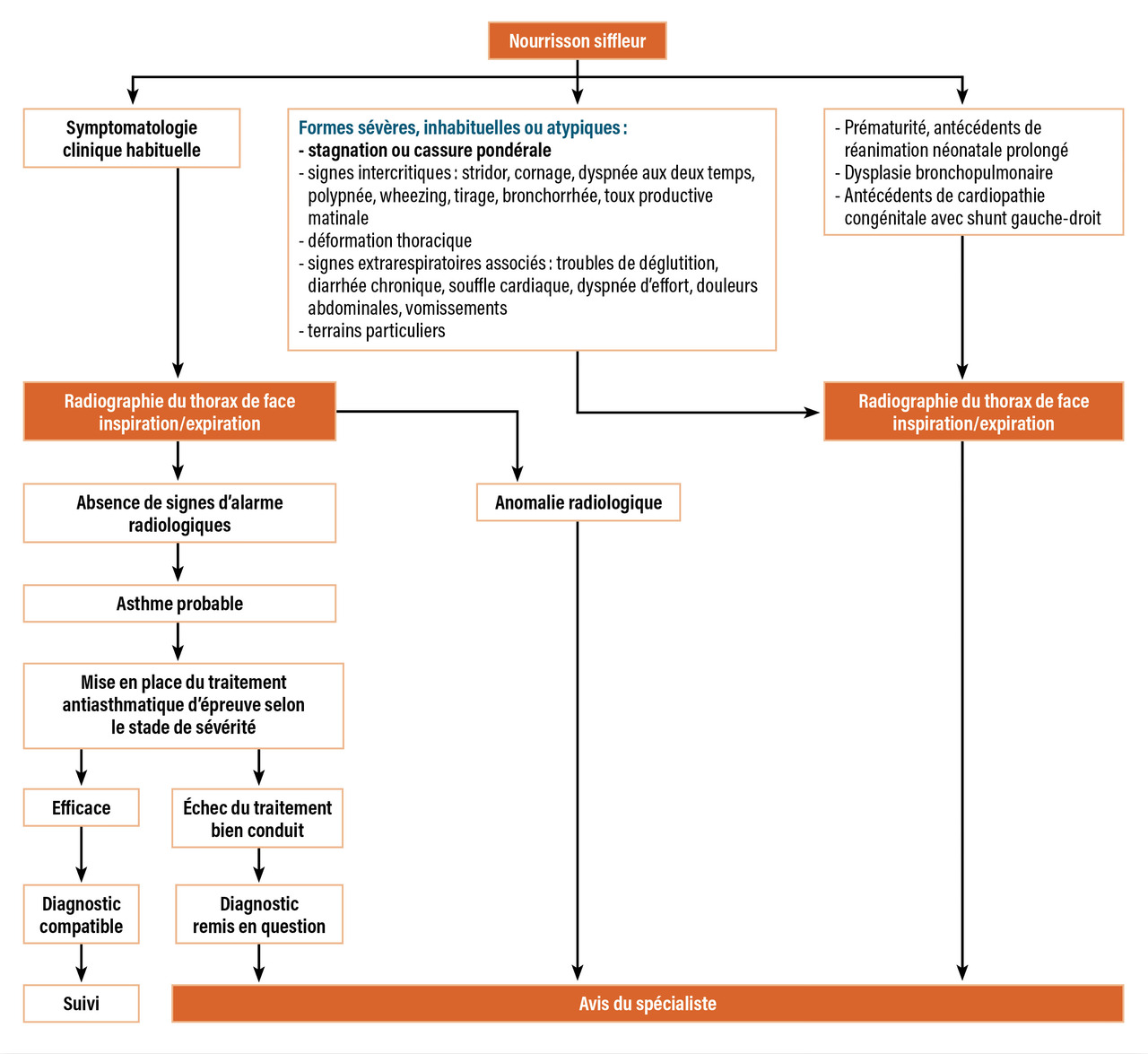
Certains signes cliniques doivent alerter : ils sont rapportés dans la figure 2.5 Ces symptômes peuvent amener à des diagnostics différentiels tels que des obstructions des voies aériennes proximales (inhalation de corps étranger, anomalies dynamiques, compression extrinsèque) ou distales (dysplasie bronchopulmonaire, mucoviscidose et autres bronchopneumopathies chroniques obstructives [BPCO] de l’enfant, séquelle de virose) mais également des pathologies d’inhalation (reflux gastro-œsophagien [RGO] en particulier), cardiopathies congénitales ou immunosuppression.
Mécanismes physiopathologiques mieux connus
L’asthme est défini par une inflammation chronique des voies aériennes et une hyper-réactivité bronchique responsable des symptômes caractéristiques que sont les sifflements, la toux et la dyspnée.
« L’hypothèse hygiéniste » veut que la diminution d’exposition aux agents infectieux au cours de l’accouchement et de la petite enfance favorise la polarisation du système immunitaire vers la voie T2 et donc vers le développement de l’atopie. Cette théorie s’est affinée, et les hypothèses actuelles prennent en compte la diversité du microbiote normal qui favorise le développement des lymphocytes T régulateurs (Treg) ayant une fonction immunosuppressive. Le mode de vie occidental entraîne une perte de diversité du microbiote conduisant à un déficit en Treg et à l’apparition des maladies atopiques. L’inflammation des voies aériennes est variable, contribuant à la définition des différents phénotypes d’asthme de l’enfant d’âge préscolaire.
Différents phénotypes d’asthme préscolaire
Au-delà des mécanismes physiopathologiques généraux de l’atopie, il existe plusieurs phénotypes d’asthme, impliquant des voies physiopathologiques différentes, avec pour conséquences des caractéristiques cliniques (symptômes, réponse au traitement, évolution) et biologiques variables. Chez l’enfant d’âge préscolaire, les principaux phénotypes décrits sont l’asthme léger viro-induit, l’asthme allergique et l’asthme modéré à sévère non atopique (tableau 1).6
Des explorations plus approfondies, incluant en particulier la fibroscopie bronchique avec lavage broncho-alvéolaire, réservées aux asthmes sévères (5 à 10 % de la population des enfants asthmatiques), permettent d’établir des phénotypes d’asthme préscolaire sévères ou résistant au traitement.7
Explorations recommandées
Indispensable radiographie thoracique
La radiographie thoracique est indispensable, car elle permet d’éliminer des diagnostics différentiels. Réalisée en période intercritique, comprenant un cliché en inspiration et un en expiration (début et fin d’un pleur), elle doit être normale en cas d’asthme « simple ».
Bilan allergologique en cas d’asthme persistant
Le bilan allergologique est recommandé pour tout asthme persistant nécessitant un traitement de fond. Il comprend des tests cutanés allergologiques en première intention, qui peuvent être réalisés à tout âge, chez un allergologue en ville ou à l’hôpital et, si besoin, des IgE spécifiques. Il est utile de le faire précocement pour préciser le phénotype de l’asthme et afin d’initier rapidement, si nécessaire, la prise en charge allergologique, qui est alors d’autant plus efficace.
Explorations fonctionnelles respiratoires à partir de trois ans et demi
Les explorations fonctionnelles respiratoires (EFR) peuvent être réalisées dès l’âge de trois ans et demi, avec la mesure des résistances des voies aériennes, et vers 6 ans pour la courbe débit-volume. La réalisation des EFR est recommandée pour tout asthme dès que l’âge de l’enfant le permet, au moins une fois par an, voire plus souvent selon la sévérité de l’asthme. Elles peuvent confirmer le diagnostic en cas de syndrome obstructif réversible et permettent d’évaluer de façon objective la sévérité et le contrôle de l’asthme. Les EFR sont cependant le plus souvent normales chez l’enfant asthmatique, n’excluant absolument pas le diagnostic.
Traitement environnemental et médicamenteux
Prise en compte de l’environnement
La prise en charge environnementale est un élément crucial dans la gestion de l’asthme chez l’enfant. Réduire l’exposition aux allergènes et aux irritants environnementaux peut significativement améliorer les symptômes et la qualité de vie des enfants asthmatiques.
Les irritants et polluants intérieurs sont à éviter systématiquement : fumée de tabac, parfums, produits de nettoyage chimiques et moisissures. L’amélioration de la ventilation intérieure et l’aération des pièces de vie plusieurs fois par jour sont également nécessaires.
Selon le contexte, les mesures incluent également le contrôle de l’exposition aux acariens, en utilisant des housses anti-acariens principalement pour les oreillers et en lavant régulièrement la literie à haute température. L’éviction des animaux domestiques, en particulier dans les zones de sommeil et de jeu de l’enfant, est également conseillée.
La vaccination antigrippale est préconisée à partir de l’âge de 6 mois.
Traitement médicamenteux
Les enfants ayant des exacerbations viro-induites répétées et/ou des symptômes intercritiques nécessitent un traitement de fond, avec, en première intention, des corticostéroïdes inhalés (CSI) à dose faible, administrés à l’aide d’une chambre d’inhalation avec masque adapté à l’âge de l’enfant (tableau 2).
La seule alternative thérapeutique à cet âge est le traitement par antileucotriènes (montélukast), possible à partir de 2 ans (GINA 2024).8 Ces derniers sont toutefois à utiliser avec prudence et font l’objet d’une mise en garde de l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) du fait de la survenue possible de troubles neuropsychiatriques (irritabilité, agressivité, troubles du sommeil).
D’autres options, non validées à l’heure actuelle chez l’enfant mais qui pourraient arriver dans les années à venir, sont celles des CSI à forte dose au coup par coup lors des exacerbations4 et des traitements antibiotiques par macrolides.9
En cas d’inefficacité du traitement de première ligne, il convient, comme toujours, de vérifier le diagnostic, la technique d’inhalation et l’observance.
L’escalade thérapeutique se fait préférentiellement avec des CSI à dose modérée ou avec une association CSI dose faible et antileucotriènes (autorisation de mise sur le marché [AMM] dès six mois dans cette indication), avec les mêmes réserves.
Selon le profil phénotypique, l’éosinophilie et l’atopie prédisent une meilleure réponse avec les doses modérées de CSI (vs CSI doses faibles + antileucotriènes).10 Les associations fixes CSI dose faible et bronchodilatateurs de longue durée d’action sont utilisables à partir de l’âge de quatre ans seulement.
Si le contrôle n’est toujours pas obtenu, il est recommandé d’adresser l’enfant à un spécialiste.
À l’inverse, si le contrôle est optimal, il convient d’envisager la décroissance du traitement de fond, en évitant toutefois la période automno-hivernale et la saison pollinique pour les allergiques.
Biothérapies à l’étude
À l’heure actuelle, une seule biothérapie a une AMM à l’âge préscolaire : il s’agit du dupilumab. Son indication à ce jour est celle de la dermatite atopique sévère, mais il s’agit d’un anti-IL- 4/IL- 13, ciblant donc la voie T2, avec un effet démontré sur l’asthme sévère à inflammation éosinophilique de l’enfant de plus de 6 ans. Les études de phase III sont en cours pour étendre cette indication à l’enfant d’âge préscolaire.
Plan d’action
À tout âge, des consignes claires et précises sur la conduite à tenir en cas de crise sont indispensables. Ceci inclut le nombre de bouffées de salbutamol adapté au poids de l’enfant (1 bouffée pour 2 kg de poids, avec un maximum de 10 bouffées par prise, qui peut être répétée si nécessaire), le moment adéquat pour l’administration des corticoïdes systémiques (en cas d’inefficacité des bronchodilatateurs ou de signes de gravité), mais également les signes d’alerte devant amener à consulter rapidement (cyanose des lèvres, difficulté à parler, signes de lutte… ou échec des thérapeutiques).
Évolution variable selon le phénotype
D’après les études de cohorte, on estime qu’environ 60 % des enfants ayant des symptômes d’asthme avant l’âge de trois ans entreront en rémission au cours de l’enfance.11 Il est difficile de prédire à l’échelle individuelle l’évolution de l’asthme. Néanmoins, certains facteurs sont liés à la persistance :12,13
- facteurs environnementaux (exposition au tabac dans la petite enfance) ;
- terrain atopique (atopie parentale, sensibilisation allergénique précoce – avant l’âge de 3 ans – et persistante aux pneumallergènes domestiques – acariens, animaux – et sensibilisation aux trophallergènes) ;
- sévérité de l’asthme (obstruction et hyper-réactivité bronchiques, sévérité des symptômes respiratoires au cours de la petite enfance).
Très schématiquement, l’asthme viro-induit léger répondant bien au traitement est de bon pronostic, tandis que l’asthme allergique à facteurs déclenchants multiples, avec une inflammation éosinophilique, est le plus souvent persistant au cours de la vie (tableau 1).6
Cependant, l’asthme persistant léger à modéré constitue un facteur de risque de développement d’une BPCO. Plusieurs études de cohorte ont mis en évidence que le risque de BPCO est doublé chez les patients ayant un asthme persistant, en particulier d’apparition précoce dans l’enfance.8,14,15 Un contrôle optimal de l’asthme pendant l’enfance et l’éviction des facteurs de risque environnementaux (tabagisme, pollution) pourraient réduire ce risque de progression vers la BPCO.
2. Verstraete M, Cros P, Gouin M, et al. Prise en charge de la bronchiolite aiguë du nourrisson de moins de 1 an : actualisation et consensus médical au sein des Hôpitaux universitaires du Grand Ouest (HUGO). Archives de pédiatrie 2014;21(1):53-62.
3. Haute Autorité de santé. Recommandation de bonne pratique. Prise en charge du premier épisode de bronchiolite aiguë chez le nourrisson de moins de 12 mois. Novembre 2019. https://urls.fr/mr1Vz_
4. 2023 Global Initiative for Asthma (GINA) report: Global strategy for asthma management and prevention. www.ginasthma.org/2023-gina-main-report
5. Société pédiatrique de pneumologie et allergologie. Asthme de l’enfant de moins de 36 mois : diagnostic, prise en charge et traitement en dehors des épisodes aigus. Mars 2009. https://urls.fr/hWhXtM
6. Just J, Saint Pierre P, Amat F, et al. What lessons can be learned about asthma phenotypes in children from cohort studies? Pediatr Allergy Immunol 2015;26(4):300-5.
7. Feleszko W, Jartti T, Bacharier LB. Current strategies for phenotyping and managing asthma in preschool children. Curr Opin Allergy Clin Immunol 2022;22(2):107-14.
8. Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management and prevention of chronic obstructive pulmonary disease: 2024 Report. 2024. www.goldcopd.org
9. Beigelman A, Bacharier LB. Management of preschool recurrent wheezing and asthma: A phenotype-based approach. Curr Opin in Allergy Clin Immunol 2017;17(2):131-8.
10. Fitzpatrick AM, Jackson DJ, Mauger DT, et al. Individualized therapy for persistent asthma in young children. J Allergy Clin Immunol 2016 Dc;138(6):1608-1618.e12.
11. Martinez FD, Wright AL, Taussig LM, et al. Asthma and wheezing in the first six years of life. N Engl J Med 1995;332(3):133-8.
12. Gabet S, Just J, Couderc R, et al. Early polysensitization is associated with allergic multimorbidity in PARIS birth cohort infants. Pediatr Allergy Immunol 2016;27(8):831-7.
13. Martinez FD. Development of wheezing disorders and asthma in preschool children. Pediatrics 2002;109(2 Suppl):362-7.
14. Bisgaard H, Nørgaard S, Sevelsted A, et al. Asthma-like symptoms in young children increase the risk of COPD. J Allergy Clin Immunol 2021;147(2):569-576.e9.
15. McGeachie MJ, Yates KP, Zhou X, et al. Patterns of growth and decline in lung function in persistent childhood asthma. N Engl J Med 2016;374(19):1842-52.