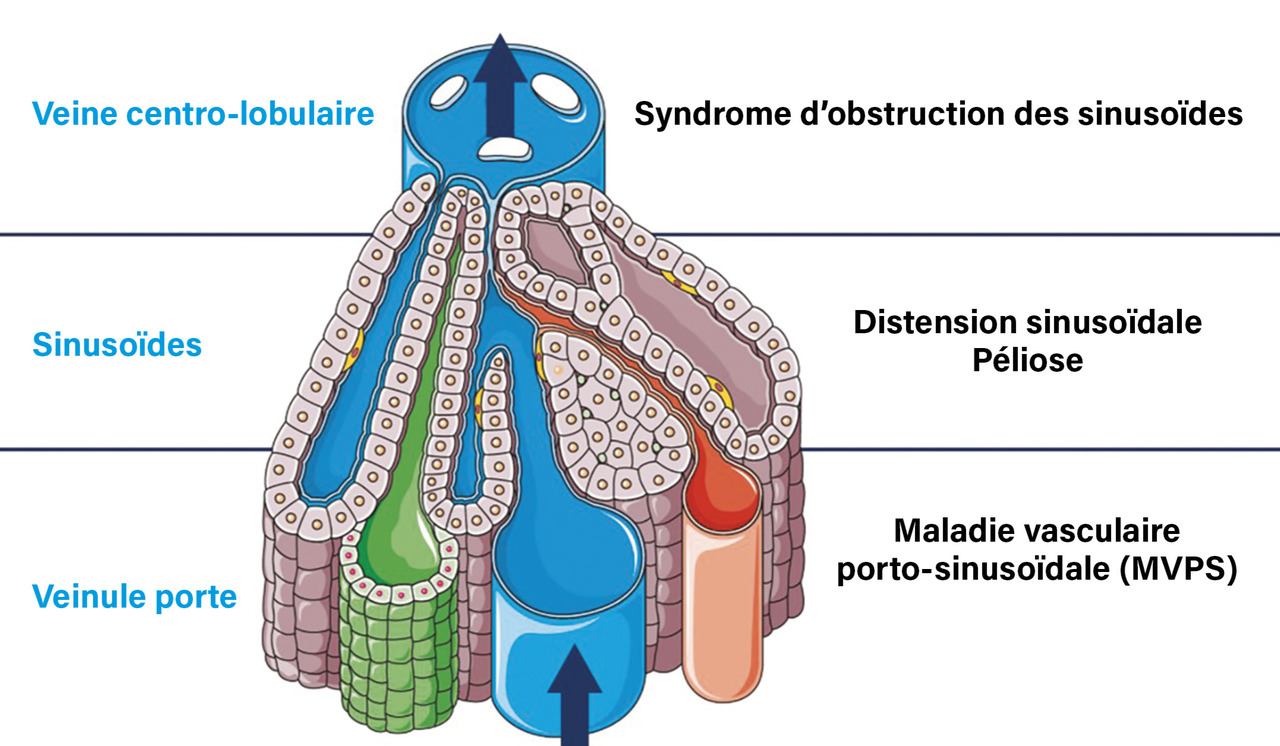
Les atteintes possibles des petits vaisseaux du foie sont au nombre de quatre (fig. 1) :
- la maladie vasculaire porto-sinusoïdale (MVPS) ;
- le syndrome d’obstruction des sinusoïdes, appelé également « maladie veino-occlusive », caractérisé par l’obstruction des sinusoïdes et des veinules hépatiques par des cellules endothéliales lésées, le plus souvent dans les semaines qui suivent une greffe de cellules souches hématopoïétiques, et révélé par une rétention hydrosodée, une hépatomégalie et un ictère ;
- la distension ou dilatation sinusoïdale, définie par un élargissement de la lumière des sinusoïdes en l’absence d’obstruction ;
- la péliose, caractérisée par une dilatation des sinusoïdes remplis de sang.
Pour des raisons d’épidémiologie, nous ne développons, dans cet article, que la maladie vasculaire porto-sinusoïdale, qui est la plus fréquente.
Le terme MVPS a été proposé en 2019 par le réseau européen VALDIG afin de regrouper différentes entités cliniques (« hypertension portale idiopathique », « hypertension portale intra-hépatique non cirrhotique ») et histologiques (« hyperplasie nodulaire régénérative », « veinopathie portale oblitérante », « sclérose hépatoportale »…), caractérisées par une atteinte des veinules portes ou des sinusoïdes (les capillaires du foie), pouvant s’associer à des signes d’hypertension portale.1 La MVPS est une maladie rare, responsable de moins de 5 % des cas d’hypertension portale en Europe, même si elle est vraisemblablement sous-diagnostiquée car méconnue.
États associés à la maladie vasculaire porto-sinusoïdale
Si la physiopathologie de la MVPS est encore mal comprise, des anomalies vasculaires (endothéliales et de l’hémostase) sont suspectées.2,3 Dans les formes génétiques, les gènes impliqués sont majoritairement exprimés par des cellules de l’immunité, suggérant également un rôle de ces dernières dans le développement de la maladie.3
De nombreux états ou affections ont été rapportés comme associés à la MVPS (tableau 1),4 sans que l’on puisse affirmer un lien de causalité. Il est nécessaire de chercher systématiquement l’ensemble de ces affections lors du diagnostic de MVPS. Au moins une affection est identifiée chez 70 % des patients avec MVPS et hypertension portale.5
Modalités diagnostiques et diagnostics différentiels de la MVPS
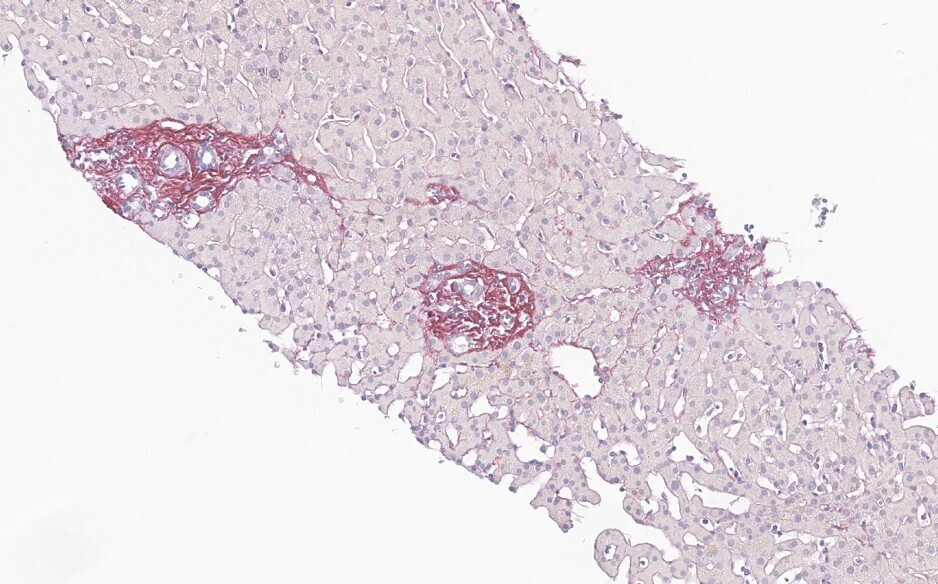
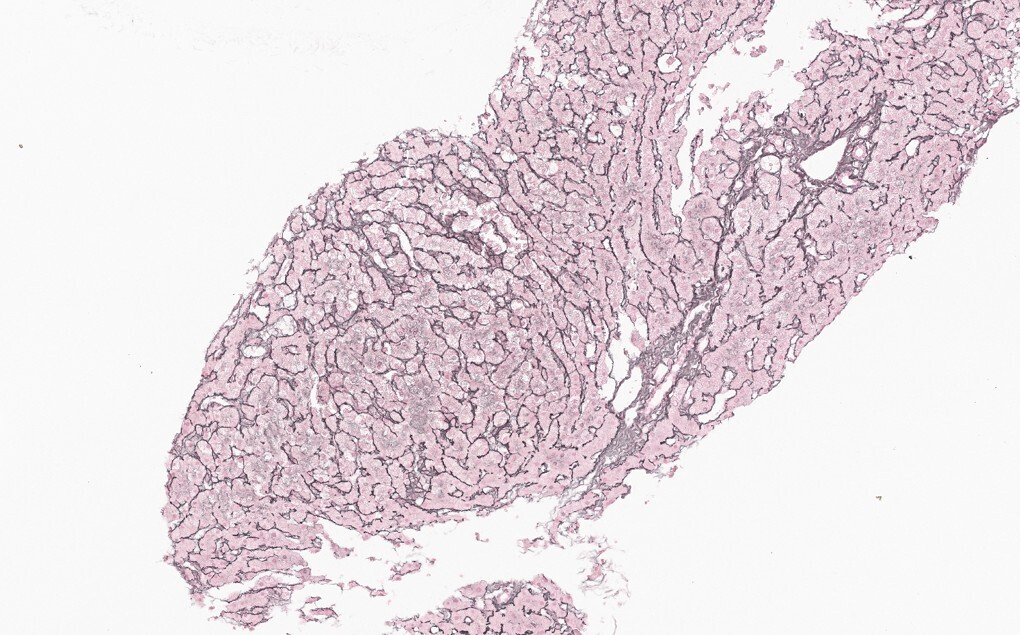
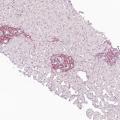
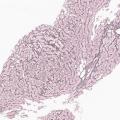
Dans un tiers des cas environ, la MVPS se révèle par une complication de l’hypertension portale (rupture de varices œsophagiennes et ascite, à parts égales).4 Le reste du temps, le diagnostic est posé lors d’explorations d’anomalies du bilan hépatique6 ou à la suite de la découverte fortuite de signes d’hypertension portale (splénomégalie, thrombopénie, varices œsophagiennes ou gastriques, voies de dérivation porto-systémiques en imagerie). Dans tous les cas, le diagnostic nécessite une biopsie hépatique, réalisée préférentiellement par voie transjugulaire (fig. 2 et 3).
La MVPS est en effet définie par l’absence de cirrhose attestée par une biopsie hépatique de bonne qualité, associée à au moins un signe histologique spécifique de MVPS, ou à au moins un signe spécifique d’hypertension portale, ou à au moins un signe histologique non spécifique de MVPS et à un signe non spécifique d’hypertension portale (tableau 2).7 Les signes d’hypertension portale ne sont donc pas systématiquement présents dans la MVPS.8
Le diagnostic différentiel principal de la MVPS est la cirrhose, qui est plus de cent fois plus fréquente que la MVPS. Il faut savoir évoquer une MVPS devant des signes marqués d’hypertension portale contrastant avec des fonctions hépatiques préservées ou avec une élasticité hépatique basse (généralement inférieure à 10 kPa),9 particulièrement en l’absence de cause évidente de cirrhose ou en présence d’un état connu comme associé à la MVPS (tableau 1).
Le diagnostic de MVPS nécessite par ailleurs d’éliminer d’autres causes d’hypertension portale, dont la thrombose complète de la veine porte ou le cavernome porte (qui peuvent aussi être des complications de la MVPS à condition qu’elles apparaissent après le diagnostic de cette dernière) et la bilharziose hépatique. Une autre cause d’hépatopathie chronique (consommation chronique excessive de boissons alcoolisées, syndrome métabolique, hépatite virale) peut, en revanche, coexister avec la MVPS.10
Prise en charge de la MVPS
Il n’y a actuellement pas de traitement spécifique de la MVPS. Les principales complications doivent être prises en charge de la même manière qu’au cours de la cirrhose : bêtabloquant non sélectif en prévention de la rupture de varices œsophagiennes si elles sont de grande taille ou ont déjà saigné, anticoagulants en cas de thrombose de la veine porte, diurétiques pour l’ascite. Lorsque ces complications sont réfractaires au traitement médical, un shunt porto-systémique intrahépatique (TIPS),11 voire une transplantation hépatique,12 peuvent être envisagés.
Les comorbidités associées à la MVPS doivent également être prises en charge. Ce sont elles qui dictent en partie le pronostic des patients.
Comme il s’agit d’une maladie rare, il est recommandé que la prise en charge des patients atteints de MVPS se fasse dans un centre expert des maladies des vaisseaux du foie dont la liste est disponible à l’adresse suivante : https ://www.filfoie.com/ou-consulter/reseau-maladies-vasculaires-foie/ , où hépato-gastroentérologues, radiologues et pathologistes sont familiers de cette entité. Il faut également informer les patients de l’existence de l’Association des Malades des Vaisseaux du Foie (https ://www.amvf.asso.fr/). Enfin, cette vidéo explicative destinée aux patients est très utile : https ://youtu.be/aHe2Y2d0UQw.
Perspectives thérapeutiques
En s’opposant à l’occlusion des veinules porte et à la thrombose de la veine porte, les anticoagulants pourraient ralentir l’évolution de la maladie. Le programme hospitalier de recherche clinique APIS, dans lequel ont été randomisés 166 patients atteints de MVPS pour recevoir de l’apixaban à la dose de 2,5 mg matin et soir ou un placebo, et qui est en cours, devrait permettre de répondre à cette question.
Surveillance et évolution
La surveillance des patients atteints de MVPS repose sur une imagerie abdominale (écho-Doppler ou imagerie en coupe avec injection de produit de contraste) semestrielle pour le dépistage de la thrombose porte.7
Le dépistage des signes endoscopiques d’hypertension portale repose sur l’endoscopie œso-gastro-duodénale, qui doit être répétée tous les deux ans en l’absence de varice de grande taille. L’élasticité splénique mesurée par FibroScan peut aider à identifier les patients ayant une très faible probabilité d’avoir des varices de grande taille.13 Le carcinome hépatocellulaire étant en revanche une complication rarissime au cours de la MVPS, son dépistage systématique n’est pas recommandé, contrairement à celui de la cirrhose.
La survie sans transplantation hépatique des patients atteints de MVPS avec au moins un signe d’hypertension portale est bonne : 97 % à un an et 83 % à cinq ans. L’incidence des trois complications les plus fréquentes de la MVPS – hémorragie digestive par hypertension portale, thrombose de la veine porte et ascite – est de l’ordre de 15 % à cinq ans pour chacune.4 Si l’histoire naturelle des patients atteints de MVPS sans signe d’hypertension portale est mal connue, l’évolution est probablement très lente, et le suivi peut donc reposer sur une imagerie tous les trois à cinq ans pour dépister l’apparition de signes d’hypertension portale.
Connaître les signes d’alerte
Il faut savoir évoquer le diagnostic de MVPS devant des signes d’hypertension portale contrastant avec une fonction hépatique préservée, ou avec une élasticité hépatique basse, et également devant des anomalies inexpliquées du bilan biologique hépatique. Il convient alors d’adresser le patient à un centre expert des maladies des vaisseaux du foie, où une biopsie hépatique permet de confirmer ou d’infirmer le diagnostic.
2. Hernández-Gea V, Campreciós G, Betancourt F, et al. Co-expression gene network analysis reveals novel regulatory pathways involved in porto-sinusoidal vascular disease. J Hepatol 2021;75(4):924‑34.
3. Ciriaci N, Bertin L, Rautou PE. Genetic predisposition to porto-sinusoidal vascular disorder. Hepatology 2024; doi:10.1097/HEP.000000000000973
4. De Gottardi A, Sempoux C, Berzigotti A. Porto-sinusoidal vascular disorder. J Hepatol 2022;77(4):1124‑35.
5. Magaz M, Giudicelli-Lett H, G Abraldes J, et al. Porto-sinusoidal vascular liver disorder with portal hypertension: Natural History and Long-Term Outcome. J Hepatol 2025;82(1):72-83.
6. Pugliese N, Ponziani FR, Cerini F, et al. Link between persistent, unexplained gamma-glutamyltransferase elevation and porto-sinusoidal vascular disorder. JHEPRep 2024;6(9):101150 [cité le 21 août 2024];0(0). Disponible sur: https://www.jhep-reports.eu/article/S2589-5559(24)00154-X/fulltext
7. de Franchis R, Bosch J, Garcia-Tsao G, et al. ; Baveno VII Faculty. Baveno VII - Renewing consensus in portal hypertension. J Hepatol 2022;76(4):959‑74.
8. Cazals-Hatem D, Hillaire S, Rudler M, et al. Obliterative portal venopathy: Portal hypertension is not always present at diagnosis. J Hepatol 2011;54(3):455‑61.
9. Elkrief L, Lazareth M, Chevret S, Paradis V, Magaz M, Blaise L, et al. Liver stiffness by transient elastography to detect porto-sinusoidal vascular liver disease with portal hypertension. Hepatology 2021;74(1):364‑78.
10. Olivas P, Perez-Campuzano V, Orts L, Montironi C, Magaz M, Ruiz P, et al. Porto-sinusoidal vascular disorder in chronic HBV: A significant coexistence not to be overlooked. JHEP Rep 2025;6(3):100996.
11. Bissonnette J, Garcia-Pagán JC, Albillos A, et al. Role of the transjugular intrahepatic portosystemic shunt in the management of severe complications of portal hypertension in idiopathic noncirrhotic portal hypertension. Hepatology 2016;64(1):224‑31.
12. Magaz M, Giudicelli-Lett H, Nicoară-Farcău O, et al. Liver transplantation for porto-sinusoidal vascular liver disorder: Long-term outcome. Transplantation 2023;107(6):1330‑40.
13. Moga L, Paradis V, Ferreira-Silva J, et al. Performance of spleen stiffness measurement to rule out high-risk varices in patients with porto-sinusoidal vascular disorder. Hepatology 2025;81(2):546-59.