L’asthme est une maladie inflammatoire chronique des voies respiratoires dont la fréquence, la morbidité et la mortalité constituent des enjeux de santé publique. En France, on estime que 4 millions de personnes sont asthmatiques, dont 2 à 5 % ont une forme sévère de la maladie. Contrairement à l’asthme léger ou modéré, l’asthme sévère est une forme réfractaire aux traitements par corticostéroïdes inhalés (CSI), même administrés à forte dose et malgré l’ajout de traitements supplémentaires, comme les bêta- 2 agonistes de longue durée d’action (LABA).1 Cette sous-population de patients présente des symptômes respiratoires persistants et des exacerbations nécessitant le recours fréquent à des corticostéroïdes par voie orale en cure courte. L’émergence de thérapies innovantes est devenue cruciale pour ces patients, dont l’asthme est non seulement une source majeure de morbidité mais aussi un fardeau socio-économique important en raison d’hospitalisations récurrentes, de consultations médicales fréquentes, d’absentéisme au travail et de complications dues à la corticothérapie orale.
Parmi ces nouveaux horizons thérapeutiques, les biothérapies ont marqué une avancée significative dans la prise en charge de l’asthme sévère au cours des dernières années.2 Elles ont un mode d’action très différent de celui des corticostéroïdes, ciblant directement des molécules impliquées dans les voies de l’inflammation asthmatique. Cinq biothérapies sont désormais disponibles en France, ciblant toutes des éléments clés de l’inflammation T2 au niveau des voies respiratoires : omalizumab, mépolizumab, benralizumab, dupilumab et tézépélumab. Ces molécules, leurs mécanismes d’action, leur efficacité, leurs indications et leur tolérance sont résumés dans le tableau.
Physiopathologie de l’inflammation T2 et mécanismes d’action des biothérapies
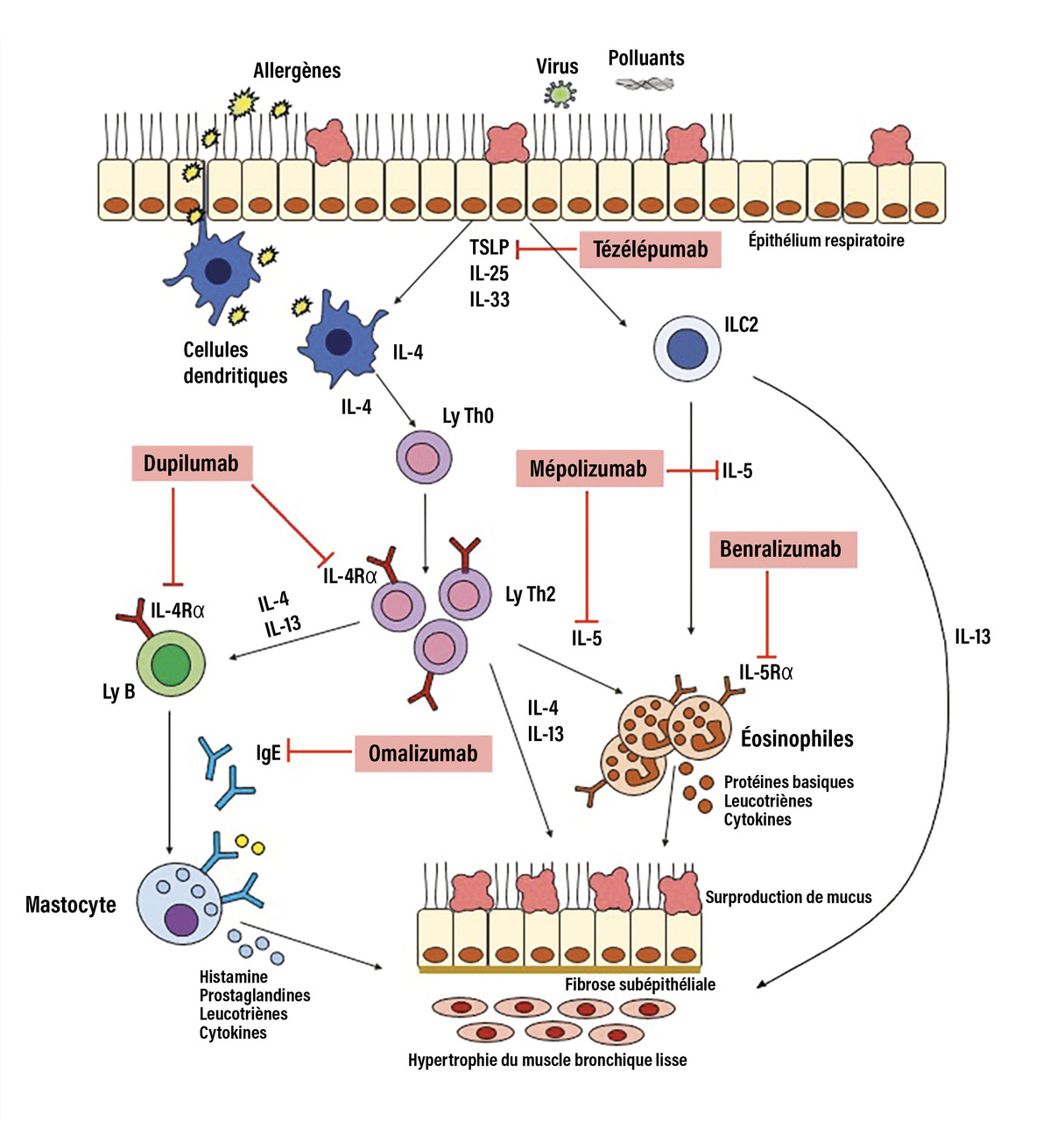
Toutes les biothérapies actuellement disponibles pour le traitement de l’asthme sévère sont des anticorps monoclonaux. Elles ciblent des composants spécifiques des mécanismes de la réponse inflammatoire de type 2 dans les voies respiratoires (figure).
Réaction inflammatoire de l’asthme sévère
La réponse inflammatoire de type 2 est le signe le plus courant et le plus distinctif de l’asthme sévère ; elle est caractérisée par une accumulation d’éosinophiles dans la muqueuse bronchique.3 Une faible fraction des cas d’asthme sévère ne présente aucun marqueur de T2, qualifiée de « non T2 », et ne répond pas aux biothérapies actuellement disponibles.4
Il est possible de différencier, de manière schématique, l’asthme de type 2 en deux phénotypes cliniques distincts : d’une part, l’asthme allergique, qui est déclenché par des allergènes respiratoires et souvent associé à d’autres maladies atopiques telles que la rhinite allergique ou l’eczéma ; d’autre part, l’asthme éosinophilique, qui se développe sans terrain atopique sous-jacent et est fréquemment associé à une polypose naso-sinusienne. Il est important de noter cependant qu’un chevauchement entre ces deux sous-phénotypes est possible.3
L’épithélium respiratoire est désormais reconnu pour être un élément clé dans l’initiation de la réponse inflammatoire de type 2 au sein des voies respiratoires. En réponse à des allergènes, des micro-organismes (virus, bactéries) ou des irritants tels que la fumée de tabac, les cellules épithéliales libèrent des alarmines (cytokines pro-inflammatoires), en particulier la thymic stromal lymphopoietin (TSLP), l’interleukine (IL)- 25 et l’IL- 33, qui initient la réponse inflammatoire de type 2. Deux mécanismes principaux sont impliqués : d’abord, chez les individus génétiquement prédisposés à l’allergie, ces cytokines stimulent les cellules présentatrices d’antigènes, ce qui oriente la différenciation des lymphocytes T naïfs (Th0) vers des lymphocytes Th2, spécifiques d’un aéroallergène.5 Ces Th2 produisent les cytokines caractéristiques de l’inflammation T2 : IL- 4, IL- 5 et IL- 13.
L’IL- 4 renforce l’induction de lymphocytes Th2 spécifiques à un aéroallergène et, en synergie avec l’IL- 13, stimule la production d’IgE par les lymphocytes B qui se lient au récepteur de haute affinité (FcεRI) sur les mastocytes et les basophiles.Au niveau des voies respiratoires, l’IL- 13 induit une hyperproduction de mucus, agit directement sur les cellules musculaires lisses, provoquant une hyperactivité bronchique et stimule la synthèse d’oxyde nitrique (NO) dans les cellules épithéliales. Il convient de noter que l’IL- 4 et l’IL- 13 partagent un récepteur commun pour leur signalisation, qui est la chaîne alpha du récepteur de l’IL- 4.
L’IL- 5, quant à elle, favorise la croissance, la différenciation et le recrutement des éosinophiles. Ces derniers ne sont pas seulement des marqueurs de l’inflammation de type 2 mais jouent un rôle actif dans les manifestations physiopathologiques de l’asthme. Ils contribuent notamment à l’hyper-réactivité, à l’hyperproduction de mucus, aux lésions épithéliales et au remodelage tissulaire en libérant divers médiateurs pro-inflammatoires et cytotoxiques.3 Outre la voie impliquant les Th2, il existe également d’autres mécanismes menant à une réponse T2. En effet, les cytokines épithéliales TSLP, IL- 25 et IL- 33 peuvent agir directement sur les cellules lymphoïdes innées de type 2 (ILC2), qui, en retour, produisent les cytokines IL- 4, IL- 5 et IL- 13, conduisant ainsi également à une inflammation éosinophilique.6 Enfin, la réponse inflammatoire de type 2 est perpétuée et entretenue par l’activation chronique des mastocytes, basophiles et éosinophiles, qui à leur tour sécrètent de nombreux médiateurs inflammatoires, dont les cytokines de type 2.
Modes d’action des anticorps monoclonaux
L’omalizumab est un anticorps monoclonal qui cible le fragment Fc des immunoglobulines E (IgE) circulantes, empêchant ainsi la fixation des IgE au FcεRI présent sur les mastocytes et les basophiles (figure). Cette action diminue l’activation de ces cellules et la libération de médiateurs inflammatoires, particulièrement lors d’une réponse allergique.
Le mépolizumab se lie à l’IL- 5 circulant, neutralisant ainsi les actions de cette cytokine sur les éosinophiles et leurs précurseurs précoces.
Le benralizumab se lie au récepteur de l’IL- 5 (IL- 5R) exprimé sur les éosinophiles.
Ces deux biothérapies induisent ainsi une forte réduction des éosinophiles sanguins et bronchiques.
Le dupilumab est un anticorps monoclonal qui inhibe les actions à la fois de l’IL- 4 et de l’IL- 13 en se liant à la sous-unité alpha du récepteur de l’IL- 4 (IL4Rα) qu’ils partagent.
Enfin, le tézépélumab inhibe la TSLP, cytokine sécrétée par les cellules épithéliales respiratoires.
Données d’efficacité probantes
L’omalizumab a été la première biothérapie développée pour le traitement de l’asthme sévère. Cette biothérapie a été particulièrement étudiée dans l’asthme d’origine allergique. Une méta-analyse récente incluant les essais randomisés a démontré une réduction globale d’environ 35 % du nombre d’exacerbations de l’asthme.7 Ces résultats ont été confirmés par des données provenant d’études en vraie vie.8 Son impact sur les symptômes, la fonction respiratoire et la qualité de vie est inconstant.7,9 Bien qu’il n’existe pas d’étude spécifique, des analyses rétrospectives ont suggéré que l’omalizumab permet une réduction de l’utilisation de corticoïdes oraux chez les patients corticodépendants.10 Bien qu’il n’existe pas de facteurs prédictifs évidents, certaines analyses post hoc suggèrent qu’une éosinophilie sanguine supérieure ou égale à 260/µL ou une fraction expirée de monoxyde d’azote (FeNO) supérieure ou égale à 20 ppb pourraient indiquer une meilleure réponse au traitement.11
Le mépolizumab et le benralizumab, ciblant la voie de l’IL- 5, ont démontré leur efficacité chez les patients asthmatiques avec un taux d’éosinophiles d’au moins 150 - 300/µL. Une méta-analyse récente, incluant les essais de phase III pour ces molécules, a montré une réduction moyenne d’environ 50 % des exacerbations annuelles, avec une amélioration plus modeste des symptômes, de la qualité de vie et du volume expiratoire maximal par seconde (VEMS).12 Ces résultats sont confirmés également dans une méta-analyse sur des études en vraie vie.13,14 Plusieurs études ont aussi rapporté une réduction significative de l’utilisation des corticoïdes oraux chez les patients sévères corticodépendants, tout en diminuant les exacerbations.15,16
Un nombre accru d’exacerbations dans l’année précédente et un taux élevé d’éosinophiles sanguins sont les principaux indicateurs d’une meilleure réponse aux biothérapies ciblant la voie de l’IL- 5.17 La présence d’une polypose nasosinusienne est également un facteur bien identifié de meilleure réponse à ces deux biothérapies.14,18
Dans l’essai pivot de phase III, le dupilumab a réduit de manière significative les exacerbations sévères, y compris celles conduisant à des visites aux urgences ou à une hospitalisation, par rapport au placebo.19 Il a également démontré un effet bénéfique sur le contrôle de l’asthme, le VEMS et la qualité de vie.20,21 Ces améliorations sont indépendantes du fait que les patients présentent un asthme allergique ou non allergique. Les facteurs prédictifs de bonne réponse sont au nombre de deux : un taux d’éosinophiles sanguins supérieur ou égal à 150/µL et une FeNO supérieure ou égale à 25 ppb avant l’initiation. Tout comme pour les anti-IL- 5, des études randomisées spécifiques ont montré que le dupilumab permet une réduction des doses de corticoïdes oraux chez les asthmatiques corticodépendants.22
Le tézépélumab est la biothérapie la plus récente dans le domaine. L’essai pivot de phase III a montré qu’il permet une diminution de 50 % des exacerbations asthmatiques, une amélioration du contrôle de l’asthme, du VEMS et de la qualité de vie des patients.23 Sa plus grande efficacité est constatée chez les patients avec un phénotype de T2 élevé, caractérisé par un taux d’éosinophiles sanguins supérieur ou égal à 450/µL et une FeNO supérieure ou égale à 50 ppb. Toutefois, bien que moins marquée, l’efficacité clinique du tézépélumab reste significative même chez les patients présentant un phénotype T2 faible, avec un taux d’éosinophiles inférieur à 150/µL ou une FeNO inférieure à 25 ppb.23 En revanche, l’étude SOURCE n’a pas mis en évidence de réduction significative dans l’utilisation de corticoïdes oraux chez les patients corticodépendants.24
Un bilan préthérapeutique approfondi est nécessaire
Avant d’initier une biothérapie pour asthme sévère, une évaluation approfondie est nécessaire. Cette évaluation, pouvant s’étendre sur plusieurs mois, a pour objectif de confirmer le diagnostic d’asthme sévère, de gérer les facteurs aggravants et de caractériser le phénotype T2.
Avant tout, il est important d’éliminer un diagnostic alternatif tel que la bronchopneumopathie chronique obstructive (BPCO), les dilatations des bronches, les bronchiolites et autres maladies bronchiques rares qui peuvent présenter des tableaux similaires à ceux de l’asthme sévère. Il est aussi crucial d’exclure un asthme sévère évoluant dans le cadre d’une maladie systémique telle que la granulomatose éosinophilique avec polyangéite ou qui est en lien avec une aspergillose bronchopulmonaire allergique. La réalisation d’un scanner thoracique est souvent indispensable, et, dans certains cas, des examens plus approfondis tels qu’une endoscopie bronchique peuvent également être requis.
En parallèle, il est essentiel de repérer et d’ajuster les facteurs aggravants contribuant au mauvais contrôle de l’asthme. Cela comprend les problèmes d’utilisation des dispositifs inhalés, la non-adhésion au traitement et les comorbidités telles que les pathologies ORL, l’obésité, le reflux gastro-œsophagien et le syndrome d’apnées–hypopnées obstructives du sommeil. Des facteurs environnementaux comme l’exposition aux polluants, irritants et allergènes (domestiques et professionnels), ainsi que le tabagisme, doivent également être considérés et gérés.
Enfin, le phénotypage de l’asthme, axé sur la caractérisation de l’inflammation de type 2, est important. Les marqueurs communs pour détecter l’inflammation de type 2 incluent un taux élevé d’éosinophiles sanguins ou de l’expectoration, une FeNO élevée, des tests cutanés positifs aux pneumallergènes, ou encore la mise en évidence de comorbidités dites T2 comme la polypose nasosinusienne et la dermatite atopique. Les mesures de l’éosinophilie sanguine, comme de la FeNO, doivent être répétées compte tenu de la grande variabilité de ces paramètres, notamment par les traitements à base de corticostéroïdes.
Indications en deuxième intention
Les biothérapies sont recommandées pour les cas d’asthme qui restent non contrôlés malgré une gestion optimale des facteurs aggravants et malgré un traitement de fond inhalé associant au minimum un CSI à dose moyenne ou élevée et un LABA.25 Les biothérapies doivent toujours être prescrites en complément de ce traitement de base.
Cinq molécules
L’omalizumab, commercialisé en France depuis 2006, est indiqué dans l’asthme sévère en rapport avec une allergie perannuelle documentée par un test cutané ou par la détection d’IgE spécifiques sériques, et associé à une fonction respiratoire dégradée (VEMS < 80 % de la théorique).
Le mépolizumab, disponible depuis 2018, et le benralizumab, disponible depuis 2019, sont indiqués dans l’asthme sévère à éosinophiles avec un taux d’éosinophiles sanguins supérieur ou égal à 150/µL dans les douze derniers mois pour le mépolizumab ou à l’instauration pour le benralizumab, et associés à deux épisodes d’exacerbation d’asthme ayant nécessité un traitement par un corticostéroïde oral (d’au moins trois jours chacun) ou un traitement par corticothérapie orale pendant au moins six mois au cours des douze derniers mois.
Le dupilumab, commercialisé depuis 2019, est indiqué pour les patients (asthmatiques sévères T2) avec un taux d’éosinophiles sanguins supérieur ou égal à 150/µL et/ou une FeNO supérieure ou égale à 20 ppb.
Le tézépélumab, disponible depuis 2023, est indiqué dans l’asthme sévère non contrôlé malgré une corticothérapie inhalée à forte dose associée à un autre traitement de fond ; son efficacité augmente avec le nombre d’éosinophiles et/ou la FeNO.
Quelle biothérapie choisir ?
Une proportion significative de patients se trouve ainsi éligible à plusieurs biothérapies. Cependant, il n’existe actuellement aucune recommandation spécifique pour orienter de manière univoque le choix entre les différentes options. Il est ainsi recommandé de discuter la prescription de ces biothérapies de manière collégiale dans le cadre de réunion de concertation pluriprofessionnelle (réunion de concertation asthme sévère [RCA]). La discussion sur le choix de la molécule doit ainsi prendre en compte plusieurs éléments essentiels, dont les caractéristiques de la maladie, les critères associés à une bonne réponse au traitement ainsi que les objectifs recherchés, qui peuvent être différents selon les patients : diminution, voire disparition, des symptômes, réduction des exacerbations, amélioration de la fonction respiratoire et/ou réduction et, si possible, sevrage de la corticothérapie générale chez les patients corticodépendants. La prise en compte des comorbidités (comme la polypose ou la dermatite atopique) et l’impact éventuel de la biothérapie sur celles-ci est aussi un paramètre important à considérer, car certaines biothérapies ont des autorisations de mise sur le marché (AMM) en parallèle pour ces comorbidités (tableau).
Administration par voie sous-cutanée
Toutes les biothérapies disponibles actuellement sont administrées par voie sous-cutanée et sont proposées sous forme de seringues préremplies à usage unique. Pour le mépolizumab, le benralizumab, le dupilumab et le tézépelumab, des stylos auto-injectables sont également disponibles. Ces stylos facilitent l’auto-administration par les patients mais nécessitent une éducation adéquate pour leur utilisation correcte. Chaque biothérapie a ses propres rythmes et conditions d’administration.
L’omalizumab est administré toutes les deux à quatre semaines, à une dose variant de 75 à 600 mg, en fonction du poids corporel et du taux d’IgE totales avant le traitement.
Le mépolizumab est administré à une dose de 100 mg toutes les quatre semaines tandis que le benralizumab requiert deux doses initiales de 30 mg à quatre semaines d’intervalle, suivies d’une dose toutes les huit semaines.
Le dupilumab doit être injecté toutes les deux semaines. Pour les patients ayant un asthme nécessitant un traitement par corticostéroïdes oraux au long cours ou associé à une polypose nasosinusienne ou une dermatite atopique, la posologie recommandée est une première dose de 600 mg, suivie de 300 mg. Dans les autres cas, la dose initiale est de 400 mg, puis de 200 mg toutes les deux semaines.
Enfin, le tézépélumab est administré à une dose de 210 mg toutes les quatre semaines.
Bon profil de tolérance
Les biothérapies sont généralement très bien tolérées. L’effet indésirable le plus fréquent est une réaction au site d’injection, qui se produit dans moins de 5 % des cas. Cela peut inclure des symptômes comme une douleur, un érythème, un prurit ou un œdème au niveau du site d’injection. Il existe également un risque, bien que très rare, d’anaphylaxie (inférieur à 0,5 %).26
L’omalizumab est l’une des biothérapies les plus anciennement établies, avec plus de quinze ans d’utilisation à travers le monde, y compris chez les enfants et les adolescents. Les effets indésirables les plus fréquemment rapportés dans une étude en vraie vie, en dehors des réactions au niveau du site d’injection, ont été les céphalées et les arthralgies.27 Aucun de ces événements n’a nécessité l’arrêt du traitement. De plus, l’omalizumab se distingue par des données rassurantes concernant son usage pendant la grossesse.28
Les données de suivi sur une période d’environ cinq ans pour le mépolizumab confirment son très bon profil de tolérance. Les effets indésirables les plus fréquemment rapportés sont des céphalées, des infections respiratoires et des arthralgies, ce qui est cohérent avec ceux observés dans les essais cliniques randomisés.29
Pour le benralizumab, les effets indésirables les plus courants ont été des céphalées (8 %) et des pharyngites (3 %).30 Pour ces biothérapies, il est à noter qu’aucune infection opportuniste évidente n’a été rapportée, soulignant l’absence de conséquences liées à la déplétion prolongée des éosinophiles.
Concernant le dupilumab, un effet indésirable notable est l’augmentation transitoire de l’éosinophilie circulante sanguine. Cette augmentation, parfois intense, notamment chez les patients présentant une forte éosinophilie avant l’introduction du traitement, reste généralement asymptomatique.31 Dans les essais de phase III sur l’asthme sévère, cet effet concernait entre 2 et 13 % des patients.19 Les autres effets indésirables les plus courants sont des arthralgies, une asthénie, les infections et les céphalées.19,32
Dans les essais cliniques, le tézépélumab a montré un profil de tolérance satisfaisant, sans effets inattendus majeurs observés.33,23 Les effets indésirables les plus fréquemment rapportés sont des arthralgies (3,8 %) et des pharyngites (4,1 %). Cependant, des études supplémentaires et un suivi à plus long terme sont nécessaires pour confirmer pleinement sa sécurité.
L’utilisation des anticorps monoclonaux, qui modulent l’immunité de type 2, suscite des interrogations théoriques quant à leur impact sur la défense de l’organisme contre les infections, notamment parasitaires. Toutefois, les données provenant des essais cliniques et des observations en pratique courante n’ont pas révélé d’augmentation des infections parasitaires chez les patients traités par ces biothérapies, y compris dans les zones endémiques.26 En ce qui concerne le risque potentiel de malignité à long terme, les études cliniques et les suivis prolongés n’ont, jusqu’à présent, pas révélé d’augmentation du risque par rapport à celui observé dans la population générale.26
Surveillance régulière de la tolérance et de l’efficacité
La surveillance des biothérapies dans le traitement de l’asthme chez l’adulte est indispensable. Une première évaluation est habituellement réalisée trois mois après l’initiation pour évaluer l’adhésion et la tolérance au traitement.
Concernant l’efficacité, une évaluation de la réponse à la biothérapie ne devrait pas être réalisée avant six mois, voire douze, après la mise en place du traitement.34 Il est important de noter que les effets des biothérapies, notamment en ce qui concerne la réduction des exacerbations, ne sont pas immédiats et exigent une évaluation sur le long terme. Par conséquent, la couverture de la « saison d’intérêt », telle que la période hivernale, est souvent nécessaire.
L’évaluation de la réponse au traitement doit se concentrer sur des critères clés tels que le contrôle de l’asthme, la réduction des exacerbations, la diminution de la dépendance aux corticoïdes et le suivi du VEMS. Il est également important de considérer l’impact du traitement sur les comorbidités, comme la polypose nasosinusienne.
La décision de poursuivre ou d’arrêter le traitement dépend essentiellement des objectifs initiaux fixés, tout en intégrant l’avis et la satisfaction du patient. En cas de non-réponse ou de réponse insuffisante, il faut envisager de passer à une autre biothérapie ciblée anti-T2.34
Chez les patients répondeurs à la biothérapie, il n’existe pas actuellement de données scientifiques précises permettant de déterminer la durée optimale du traitement. Toutefois, un nombre croissant d’études et d’observations cliniques suggèrent que, chez l’adulte, l’efficacité des biothérapies est majoritairement maintenue uniquement durant la période de traitement, et une rechute de la maladie est souvent constatée après son interruption.35 - 37 La réponse à la biothérapie et sa gestion peuvent par ailleurs varier chez les enfants et les adolescents.
Enfin, il est essentiel, lors du suivi d’un patient asthmatique sévère sous biothérapie, de s’assurer régulièrement de son observance au traitement et de la prise en charge adéquate des comorbidités et des facteurs environnementaux, particulièrement si une perte de contrôle de la maladie se manifeste alors que le traitement était initialement efficace.
Prescription réservée à certains spécialistes
Les biothérapies sont classées comme des médicaments d’exception et nécessitent une prescription initiale hospitalière annuelle. La prescription et le renouvellement des biothérapies destinées au traitement de l’asthme sévère chez l’adulte sont exclusivement réservés aux spécialistes en pneumologie et en allergologie.
Ces médicaments sont remboursables à hauteur de 65 %. Il est habituel de demander une exonération en affectation de longue durée (ALD). Le coût de chaque seringue ou stylo est indiqué dans le tableau. Le coût mensuel varie en fonction du schéma thérapeutique administré.
Stratégie de traitement personnalisée
L’évolution du traitement de l’asthme sévère grâce à l’introduction des biothérapies a marqué une avancée considérable et a transformé de manière significative la prise en charge. Ces traitements, ciblant les voies inflammatoires T2, ont démontré leur efficacité à améliorer le contrôle de la maladie, en réduisant notamment les exacerbations et en diminuant la dépendance aux corticostéroïdes oraux.
Le succès des biothérapies repose sur une stratégie de traitement personnalisée, exigeant un phénotypage précis et détaillé des patients pour identifier la biothérapie la plus adaptée à chaque cas spécifique. Cette approche individualisée, en tenant compte des particularités de chaque patient, assure une optimisation des résultats thérapeutiques.
Bien que le coût et les exigences d’une approche spécialisée puissent représenter des défis, l’impact bénéfique de ces traitements sur le contrôle de l’asthme sévère justifie leur place essentielle dans l’arsenal thérapeutique actuel.
2. Brusselle GG , Koppelma GH. Biologic therapies for severe asthma. N Engl J Med 2022;386(2):157-71.
3. Jackson DJ, Akuthota P, Roufosse F. Eosinophils and eosinophilic immune dysfunction in health and disease. Eur Respir Rev 2022;31(163):210150.
4. Hinks TSC, Levine SJ, Brusselle GG. Treatment options in type-2 low asthma. Eur Respir J 2021;57(1):2000528.
5. Whetstone CE, Ranjbar M, Omer H, et al. The role of airway epithelial cell alarmins in asthma. Cells 2022;11(7):1105.
6. Bartemes KR, Kita H. Roles of innate lymphoid cells (ILCs) in allergic diseases: The 10-year anniversary for ILC2s. J Allergy Clin Immunol 2021;147(5):1531-47.
7. Henriksen DP, Bodtger U, Sidenius K, et al. Efficacy of omalizumab in children, adolescents, and adults with severe allergic asthma: A systematic review, meta-analysis, and call for new trials using current guidelines for assessment of severe asthma. Allergy Asthma Clin Immunol 2020;16:49.
8. Bousquet J, Himbert M, Gibson PG, et al. Real-world effectiveness of omalizumab in severe allergic asthma: A meta-analysis of observational studies. J Allergy Clin Immunol Pract 2021;9(7):2702-14.
9. Normansell R, Walker S, Milan SJ, et al. Omalizumab for asthma in adults and children. Cochrane Database Syst Rev 2014(1):CD003559.
10. Siergiejko Z, Swiebocka E, Smith N, Wenzel S, Rosen K, et al. Oral corticosteroid sparing with omalizumab in severe allergic (IgE-mediated) asthma patients. Curr Med Res Opin 2011;27(11):2223-8.
11. Hanania NA, et al. Exploring the effects of omalizumab in allergic asthma: An analysis of biomarkers in the EXTRA study. Am J Respir Crit Care Med 2013;187(8):804-11.
12. Farne HA, Wilson A, Milan S, et al. Anti-IL-5 therapies for asthma. Cochrane Database Syst Rev 2022;7(7):p. CD010834.
13. Li H, Zhang Q, Vang J, et al. Real-world effectiveness of mepolizumab in severe eosinophilic asthma: A systematic review and meta-analysis. Clin Ther 2021;43(6):e192-e208.
14. Kavanagh JE, Hearn AP, Dhariwal J, et al. Real-world effectiveness of benralizumab in severe eosinophilic asthma. Chest 2021;159(2):496-506.
15. Bel EH, Wenzel SE, Thompson PJ, et al. Oral glucocorticoid-sparing effect of mepolizumab in eosinophilic asthma. N Engl J Med 2014;371(13):1189-97.
16. Menzies-Gow A, Gurnell M, Heaney LG, et al. Oral corticosteroid elimination via a personalised reduction algorithm in adults with severe, eosinophilic asthma treated with benralizumab (PONENTE): A multicentre, open-label, single-arm study. Lancet Respir Med 2022;10(1):47-58.
17. Krings JG, McGregor MC, Bacharier LB, et al. Biologics for severe asthma: Treatment-specific effects are important in choosing a specific agent. J Allergy Clin Immunol Pract 2019;7(5):1379-92.
18. Howarth P, Chupp G, Nelsen LM, et al. Severe eosinophilic asthma with nasal polyposis: A phenotype for improved sinonasal and asthma outcomes with mepolizumab therapy. J Allergy Clin Immunol 2020;145(6):1713-5.
19. Castro M, Corren J, Pavord ID, et al. Dupilumab efficacy and safety in moderate-to-severe uncontrolled asthma. N Engl J Med 2018;378(26):2486-96.
20. Castro M, Rabe KF, Corren J, et al. Dupilumab improves lung function in patients with uncontrolled, moderate-to-severe asthma. ERJ Open Res 2020;6(1):00204-2019.
21. Corren, J, Castro M, Chanez P, et al. Dupilumab improves symptoms, quality of life, and productivity in uncontrolled persistent asthma. Ann Allergy Asthma Immunol 2019;122(1):41-9 e2.
22. Rabe KF, Nair P, Brusselle G, et al. Efficacy and safety of dupilumab in glucocorticoid-dependent severe asthma. N Engl J Med 2018;378(26):2475-85.
23. Menzies-Gow A, Corren J, Bourdin A, et al. Tezepelumab in adults and adolescents with severe, uncontrolled asthma. N Engl J Med 2021;384(19):1800-9.
24. Wechsler ME, Menzies-Gow A, Brightling CE, et al. Evaluation of the oral corticosteroid-sparing effect of tezepelumab in adults with oral corticosteroid-dependent asthma (SOURCE): A randomised, placebo-controlled, phase 3 study. Lancet Respir Med 2022;10(7):650-60.
25. Haute Autorité de santé. Fiche Bon usage du médicament. Dupixent, Fasenra, Nucala, Tezspire et Xolair dans le traitement de l’asthme sévère. 28 mars 2024. https://urls.fr/vjzPCx
26. Sitek AN, Li JT, Pongdee T. Risks and safety of biologics: A practical guide for allergists. World Allergy Organ J 2023;16(1):100737.
27. Tzortzaki EG, Georgiou A, Kampas D, et al. Long-term omalizumab treatment in severe allergic asthma: The South-Eastern Mediterranean “real-life” experience. Pulm Pharmacol Ther 2012;25(1):77-82.
28. Namazy JA, Blais L, Andrews EB, et al. Pregnancy outcomes in the omalizumab pregnancy registry and a disease-matched comparator cohort. J Allergy Clin Immunol 2020;145(2):528-36 e1.
29. Khatri S, Moore W, Gibson PG, et al. Assessment of the long-term safety of mepolizumab and durability of clinical response in patients with severe eosinophilic asthma. J Allergy Clin Immunol 2019;143(5):1742-51 e7.
30. Busse WW, Bleecker ER, FitzGerald JM, et al. Long-term safety and efficacy of benralizumab in patients with severe, uncontrolled asthma: 1-year results from the BORA phase 3 extension trial. Lancet Respir Med 2019;7(1):46-59.
31. Eger K, Pet L, Weersink EJM, et al. Complications of switching from anti-IL-5 or anti-IL-5R to dupilumab in corticosteroid-dependent severe asthma. J Allergy Clin Immunol Pract 2021;9(7):2913-15.
32. Dupin C, Belhadi D, Guilleminault L, et al. Effectiveness and safety of dupilumab for the treatment of severe asthma in a real-life French multi-centre adult cohort. Clin Exp Allergy 2020;50(7):789-98.
33. Corren J, Parnes JR, Wang L, et al. Tezepelumab in adults with uncontrolled asthma. N Engl J Med 2017;377(10):936-46.
34. Global initiative for asthma (GINA). Diagnosis and management of difficult-to-treat & severe asthma 2022.
35. Moore WC, Kornmann O, Humbert M, et al. Stopping versus continuing long-term mepolizumab treatment in severe eosinophilic asthma (COMET study). Eur Respir J 2022;59(1):2100396.
36. Ledford D, Busse W, Trzaskoma B, et al. A randomized multicenter study evaluating Xolair persistence of response after long-term therapy. J Allergy Clin Immunol 2017;140(1):162-9.e2.
37. Menzies-Gow AN, McBrien C, Unni B, et al. Real world biologic use and switch patterns in severe asthma: Data from the international severe asthma registry and the US CHRONICLE study. J Asthma Allergy 2022;15:63-78.
Dans cet article
- Physiopathologie de l’inflammation T2 et mécanismes d’action des biothérapies
- Données d’efficacité probantes
- Un bilan préthérapeutique approfondi est nécessaire
- Indications en deuxième intention
- Administration par voie sous-cutanée
- Bon profil de tolérance
- Surveillance régulière de la tolérance et de l’efficacité
- Prescription réservée à certains spécialistes
- Stratégie de traitement personnalisée