Longtemps considérées à tort comme maladie orpheline, voire confondues avec la BPCO, les dilatations des bronches ou bronchectasies sont désormais reconnues comme une entité clinique, aux confins de plusieurs maladies respiratoires. La prévalence augmente avec l’âge, le sexe féminin. Tous âges confondus, elle va de 53 à 556 cas pour 100 000 habitants, atteignant au moins 200/100 000 habitants chez les plus de 75 ans (les plus de 65 ans représentent plus de la moitié des cohortes suivies), voire beaucoup plus en Grande-Bretagne.1, 2 Depuis 5 ans, on les connaît mieux, notamment grâce au registre européen EMBARC (European Multicentre Bronchiectasis Auditand Research Collaboration).
Sur un plan physiopathologique sont associées des anomalies morphologiques bronchiques, une altération de la clairance mucociliaire, une inflammation des bronches essentiellement médiée par les polynucléaires neutrophiles, une infection bactérienne chronique. Conséquences : hypersécrétion bronchique, hypervascularisation artérielle des bronches favorisant les complications infectieuses et/ou hémorragiques qui émaillent l’évolution, insuffisance ventilatoire puis respiratoire.
Sur un plan physiopathologique sont associées des anomalies morphologiques bronchiques, une altération de la clairance mucociliaire, une inflammation des bronches essentiellement médiée par les polynucléaires neutrophiles, une infection bactérienne chronique. Conséquences : hypersécrétion bronchique, hypervascularisation artérielle des bronches favorisant les complications infectieuses et/ou hémorragiques qui émaillent l’évolution, insuffisance ventilatoire puis respiratoire.
Faire le diagnostic : clinique et scanner thoracique
Une toux chronique (> 8 semaines), productive ou non, et des infections bronchopulmonaires récidivantes sont évocatrices. Peuvent y être associées dyspnée, fatigue, hémoptysies, douleurs thoraciques.3 L’auscultation peut être normale ou révéler des râles bronchiques ou sous-crépitants des deux bases. La radio suffit rarement à bien voir les parois bronchiques.
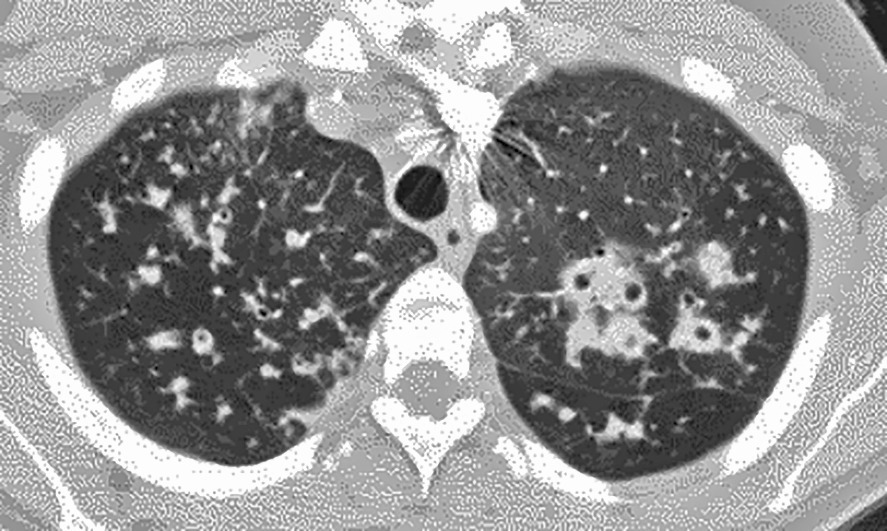
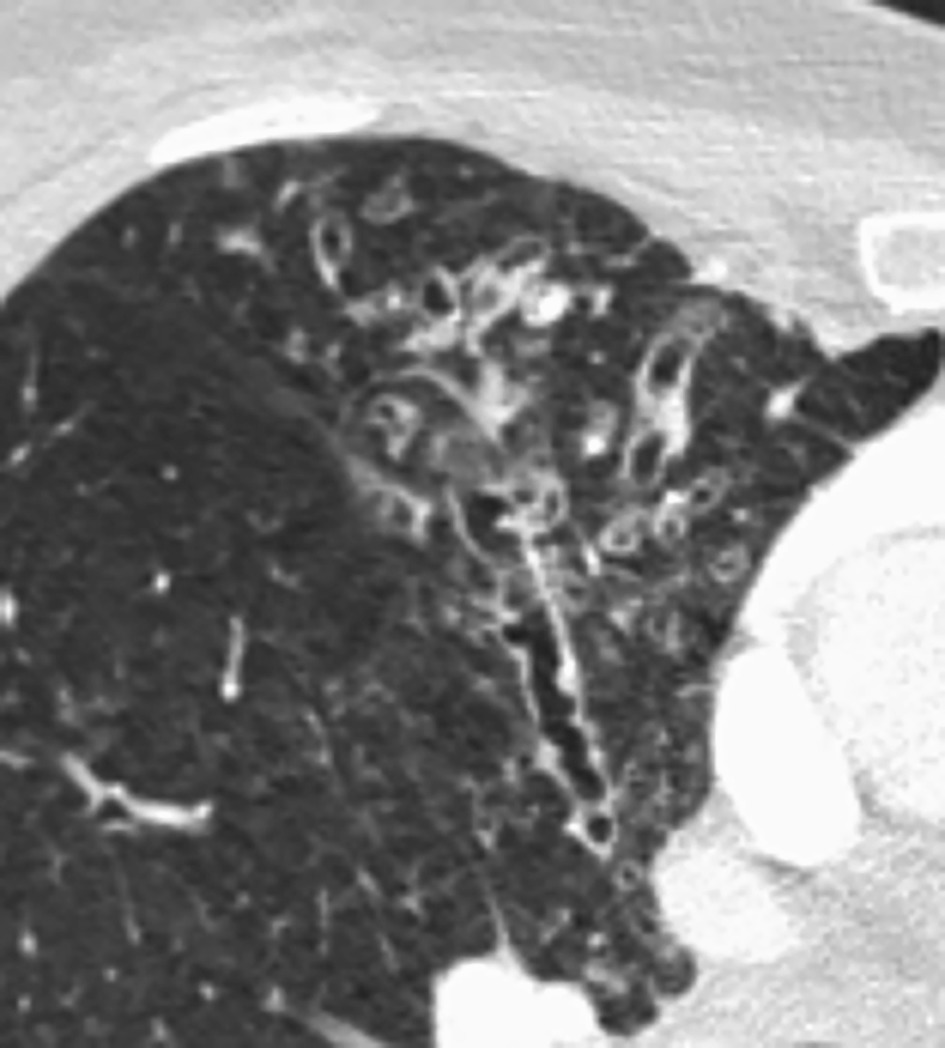
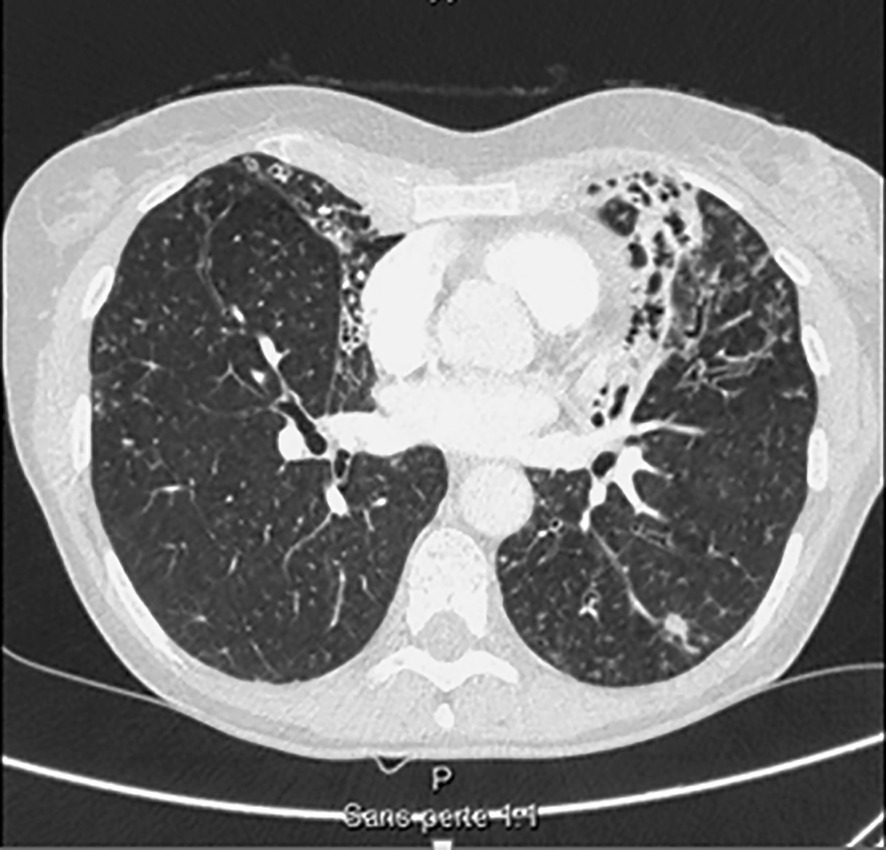
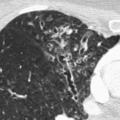
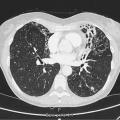
Seul un scanner thoracique haute résolution confirme le diagnostic anatomique : augmentation permanente et irréversible du calibre des bronches sous-segmentaires, cylindriques, variqueuses ou kystiques, localisées à un lobe ou diffuses. On élimine une autre cause de toux chronique comme un cancer bronchique. Toux, expectoration, infections bronchiques répétées + bronchectasies au scanner définissent le syndrome bronchectasique.
Seul un scanner thoracique haute résolution confirme le diagnostic anatomique : augmentation permanente et irréversible du calibre des bronches sous-segmentaires, cylindriques, variqueuses ou kystiques, localisées à un lobe ou diffuses. On élimine une autre cause de toux chronique comme un cancer bronchique. Toux, expectoration, infections bronchiques répétées + bronchectasies au scanner définissent le syndrome bronchectasique.
Bilan de première intention
Ses objectifs : trouver une éventuelle cause requérant un traitement spécifique ; détecter des comorbidités ; apprécier la sévérité de la maladie.
Outre le scanner thoracique, des clichés pulmonaires face et profil servent de référence pour toute interprétation ultérieure.
Une analyse bactériologique avec recherche de mycobactéries atypiques, de Pseudomonas aeruginosa et un examen mycologique de l’expectoration s’imposent. Consulter un pneumologue est indispensable.4 En effet, une exploration fonctionnelle respiratoire avec test de réversibilité sous bêta-2 mimétiques vise à évaluer le retentissement de la maladie : absent, obstructif, puis restrictif en cas de destruction importante du parenchyme pulmonaire. Elle peut aussi mettre en évidence un asthme ou une BPCO associés.
Un bilan étiologique de 1re ligne peut être réalisé en ville : NFS à la recherche d’une hyperéosinophilie (faisant suspecter une aspergillose bronchopulmonaire allergique), une lymphopénie ou une neutropénie (traduisant un déficit immunitaire primaire ou secondaire), une lymphocytose (déficit secondaire associé à une hémopathie). Un dosage pondéral des immunoglobulines A, M et G oriente vers un déficit immunitaire commun variable. Ces pathologies sont rares et représentent environ 10% des étiologies.
Le dosage des IgE totales et spécifiques aspergillaires, une sérologie concordante peuvent confirmer un diagnostic d’aspergillose bronchopulmonaire allergique. Selon les signes associés, le pneumologue ira plus loin dans l’enquête et dirigera le patient vers un centre de maladies rares (si suspicion de dyskinésie ciliaire) ou un centre de ressources et de compétences pour la mucoviscidose (CRCM). L’impact thérapeutique peut être important.5 En effet, ces causes sont rares mais curables. Dans les autres cas, les étiologies les plus fréquentes sont les bronchectasies post-infectieuses puis dites idiopathiques sans cause retrouvée.
Si le scanner montre souvent des bronchectasies dans la BPCO sévère, un syndrome clinique est rarement associé. Difficile alors de trancher entre cause ou comorbidité (même traitement).
Outre le scanner thoracique, des clichés pulmonaires face et profil servent de référence pour toute interprétation ultérieure.
Une analyse bactériologique avec recherche de mycobactéries atypiques, de Pseudomonas aeruginosa et un examen mycologique de l’expectoration s’imposent. Consulter un pneumologue est indispensable.4 En effet, une exploration fonctionnelle respiratoire avec test de réversibilité sous bêta-2 mimétiques vise à évaluer le retentissement de la maladie : absent, obstructif, puis restrictif en cas de destruction importante du parenchyme pulmonaire. Elle peut aussi mettre en évidence un asthme ou une BPCO associés.
Un bilan étiologique de 1re ligne peut être réalisé en ville : NFS à la recherche d’une hyperéosinophilie (faisant suspecter une aspergillose bronchopulmonaire allergique), une lymphopénie ou une neutropénie (traduisant un déficit immunitaire primaire ou secondaire), une lymphocytose (déficit secondaire associé à une hémopathie). Un dosage pondéral des immunoglobulines A, M et G oriente vers un déficit immunitaire commun variable. Ces pathologies sont rares et représentent environ 10% des étiologies.
Le dosage des IgE totales et spécifiques aspergillaires, une sérologie concordante peuvent confirmer un diagnostic d’aspergillose bronchopulmonaire allergique. Selon les signes associés, le pneumologue ira plus loin dans l’enquête et dirigera le patient vers un centre de maladies rares (si suspicion de dyskinésie ciliaire) ou un centre de ressources et de compétences pour la mucoviscidose (CRCM). L’impact thérapeutique peut être important.5 En effet, ces causes sont rares mais curables. Dans les autres cas, les étiologies les plus fréquentes sont les bronchectasies post-infectieuses puis dites idiopathiques sans cause retrouvée.
Si le scanner montre souvent des bronchectasies dans la BPCO sévère, un syndrome clinique est rarement associé. Difficile alors de trancher entre cause ou comorbidité (même traitement).
Définir le profil de sévérité
Des scores cliniques existent, ils sont faciles à calculer. Un des plus utilisés est le BSI (Bronchectasis Severity Index) qui classe le risque d’hospitalisation et de mortalité en faible, modéré ou élevé.
Les patients ayant un phénotype dit sévère sont les sujets âgés (dès 70 ans), ayant une ou des comorbidités – BPCO, polyarthrite rhumatoïde – colonisés chroniques à P. aeruginosa, staphylocoque doré multirésistant, mycobactéries atypiques, et exacerbateurs fréquents (au moins 3 épisodes dans l’année). Le traitement est alors plus lourd et la surveillance accrue (notamment pneumologique).
Une expectoration mucopurulente ou l’isolement d’un pathogène ne définissent pas l’exacerbation. Pour les essais cliniques, c’est l’aggravation d’au moins 3 symptômes parmi les suivants : toux, expectoration (volume et/ou aspect), purulence, dyspnée et/ou tolérance à l’exercice, fatigue, hémoptysie depuis plus de 48 heures, ayant motivé une modification de la prise en charge.6 Sauf virose ou grippe associée, ces événements sont rarement fébriles.
Contrôler ces épisodes est un objectif crucial car plus ils sont fréquents, plus l’inflammation bronchique et même systémique est importante, favorisant les lésions bronchiques et parenchymateuses et le déclin du VEMS, aggravant encombrement, fatigue et surmortalité.7 Ils sont en outre un facteur de risque indépendant de pathologie cardiovasculaire.8
Les patients ayant un phénotype dit sévère sont les sujets âgés (dès 70 ans), ayant une ou des comorbidités – BPCO, polyarthrite rhumatoïde – colonisés chroniques à P. aeruginosa, staphylocoque doré multirésistant, mycobactéries atypiques, et exacerbateurs fréquents (au moins 3 épisodes dans l’année). Le traitement est alors plus lourd et la surveillance accrue (notamment pneumologique).
Une expectoration mucopurulente ou l’isolement d’un pathogène ne définissent pas l’exacerbation. Pour les essais cliniques, c’est l’aggravation d’au moins 3 symptômes parmi les suivants : toux, expectoration (volume et/ou aspect), purulence, dyspnée et/ou tolérance à l’exercice, fatigue, hémoptysie depuis plus de 48 heures, ayant motivé une modification de la prise en charge.6 Sauf virose ou grippe associée, ces événements sont rarement fébriles.
Contrôler ces épisodes est un objectif crucial car plus ils sont fréquents, plus l’inflammation bronchique et même systémique est importante, favorisant les lésions bronchiques et parenchymateuses et le déclin du VEMS, aggravant encombrement, fatigue et surmortalité.7 Ils sont en outre un facteur de risque indépendant de pathologie cardiovasculaire.8
Grands principes thérapeutiques
L’arrêt du tabac chez le fumeur et une hydratation suffisante d’au moins 1,5 à 2 litres par jour sont indispensables (eau, tisanes, soupes, thé… quantité difficile à faire ingérer aux plus âgés).
La kinésithérapie de drainage bronchique est indispensable si le patient sécrète, les séances étant quotidiennes ou au moins bi- ou trihebdomadaires. Elles doivent drainer la distalité bronchique, avec un professionnel rompu aux méthodes de désencombrement ou par autodrainage après apprentissage. Alors que la plupart des sujets bronchectasiques expectorent des quantités allant de 1 à 2 mL, jusqu’à parfois plus de 80 mL par jour, il n’est pas rare que le patient refuse la kiné, pensant que sa toux spontanée est efficace, ce qui n’est pas toujours le cas. Plusieurs techniques peuvent être associées au cours d’une séance dont la durée varie : 20, 30 ou 40 minutes. Selon la morphologie du patient, ses comorbidités, un éventuel encombrement distal, sa fatigabilité musculaire, son niveau de distension thoracique, d’obstruction bronchique, un recours à diverses modalités (positionnelles, modification du flux expiratoire…) et/ou à des aides instrumentales peut être utile (par exemple Flutter, Acapella, Pep Mask). Aucun de ces outils n’est pris en charge par l’Assurance maladie.
Prescrire un réentraînement à l’exercice et la pratique d’une activité physique régulière (au moins 45 minutes, 3 fois par semaine) voire quotidienne est recommandé. Ce réentraînement peut être initié au décours d’un séjour en réhabilitation respiratoire où les séances de drainage sont également assurées et enseignées. L’activité physique contribue au désencombrement et allège les symptômes quotidiens (toux, expectoration, dyspnée). Elle améliore la qualité de vie et réduit la fréquence des exacerbations.5
Lutter contre la dénutrition favorisée par l’infection chronique et maintenir un état nutritionnel correct (IMC > 20).
Uniquement en cas d’asthme ou de BPCO avérés, un traitement de fond par corticoïdes inhalés et/ou bêta-2 mimétiques de longue durée d’action peut avoir un intérêt.
Il est recommandé de vaccinercontre la grippe et contre le pneumocoque selon le schéma « prime boost », soit le vaccin conjugué 13 valences (Prevenar 13), suivi au moins 8 semaines après par une injection de Pneumovax (polyosidique 23 valences ; prévoir un rappel à 5 ans par le polyosidique). Penser à mettre à jour les vaccinations DTPC, même chez les patients ayant un antécédent de coqueluche. La protection post-infectieuse n’étant que transitoire, la revaccination a un intérêt. Cela peut aussi éviter de majorer la toux d’un tousseur chronique…
Au moindre signe de rhinite chronique, proposer des soins locaux comme le lavage simple des fosses nasales matin et soir au sérum physiologique, rechercher une éventuelle composante allergique ou infectieuse et la traiter.
Faire contrôler l’état buccodentaire, source infectieuse potentielle.
Gérer les comorbidités liées à la toux, RGO, incontinence urinaire d’effort.
La kinésithérapie de drainage bronchique est indispensable si le patient sécrète, les séances étant quotidiennes ou au moins bi- ou trihebdomadaires. Elles doivent drainer la distalité bronchique, avec un professionnel rompu aux méthodes de désencombrement ou par autodrainage après apprentissage. Alors que la plupart des sujets bronchectasiques expectorent des quantités allant de 1 à 2 mL, jusqu’à parfois plus de 80 mL par jour, il n’est pas rare que le patient refuse la kiné, pensant que sa toux spontanée est efficace, ce qui n’est pas toujours le cas. Plusieurs techniques peuvent être associées au cours d’une séance dont la durée varie : 20, 30 ou 40 minutes. Selon la morphologie du patient, ses comorbidités, un éventuel encombrement distal, sa fatigabilité musculaire, son niveau de distension thoracique, d’obstruction bronchique, un recours à diverses modalités (positionnelles, modification du flux expiratoire…) et/ou à des aides instrumentales peut être utile (par exemple Flutter, Acapella, Pep Mask). Aucun de ces outils n’est pris en charge par l’Assurance maladie.
Prescrire un réentraînement à l’exercice et la pratique d’une activité physique régulière (au moins 45 minutes, 3 fois par semaine) voire quotidienne est recommandé. Ce réentraînement peut être initié au décours d’un séjour en réhabilitation respiratoire où les séances de drainage sont également assurées et enseignées. L’activité physique contribue au désencombrement et allège les symptômes quotidiens (toux, expectoration, dyspnée). Elle améliore la qualité de vie et réduit la fréquence des exacerbations.5
Lutter contre la dénutrition favorisée par l’infection chronique et maintenir un état nutritionnel correct (IMC > 20).
Uniquement en cas d’asthme ou de BPCO avérés, un traitement de fond par corticoïdes inhalés et/ou bêta-2 mimétiques de longue durée d’action peut avoir un intérêt.
Il est recommandé de vaccinercontre la grippe et contre le pneumocoque selon le schéma « prime boost », soit le vaccin conjugué 13 valences (Prevenar 13), suivi au moins 8 semaines après par une injection de Pneumovax (polyosidique 23 valences ; prévoir un rappel à 5 ans par le polyosidique). Penser à mettre à jour les vaccinations DTPC, même chez les patients ayant un antécédent de coqueluche. La protection post-infectieuse n’étant que transitoire, la revaccination a un intérêt. Cela peut aussi éviter de majorer la toux d’un tousseur chronique…
Au moindre signe de rhinite chronique, proposer des soins locaux comme le lavage simple des fosses nasales matin et soir au sérum physiologique, rechercher une éventuelle composante allergique ou infectieuse et la traiter.
Faire contrôler l’état buccodentaire, source infectieuse potentielle.
Gérer les comorbidités liées à la toux, RGO, incontinence urinaire d’effort.
Traiter une exacerbation
L’antibiothérapie ne doit pas être systématique mais précocement proposée. L’analyse de l’expectoration sert à adapter les molécules en cas d’échec d’un premier traitement. On n’en attend pas le résultat pour débuter une thérapie empirique qui cible les pyogènes habituellement retrouvés : S. pneumoniae, H. influenzae, M. catarrhalis, S. aureus et P. aeruginosa. En première intention par voie orale et pour une durée moyenne de 14 jours (amoxicilline-acide clavulanique qui couvre les pyogènes habituels hors pyocyanique et en l’absence d’allergie connue). Dans les cas les moins sévères, 7 à 10 jours peuvent suffire. En cas d’échec, il faut contrôler la bactériologie des crachats à la recherche du bacille pyocyanique.5
L’hydratation doit être renforcée, le drainage bronchique également, éventuellement au domicile avec l’aide d’un professionnel. Pas d’AINS ni de corticothérapie systémique ou nébulisée.
En cas d’atteinte rhinosinusienne, répéter le lavage des fosses nasales au sérum physiologique.
L’hydratation doit être renforcée, le drainage bronchique également, éventuellement au domicile avec l’aide d’un professionnel. Pas d’AINS ni de corticothérapie systémique ou nébulisée.
En cas d’atteinte rhinosinusienne, répéter le lavage des fosses nasales au sérum physiologique.
Rôle du pneumologue
Lors du diagnostic, il fait une première évaluation clinique, fonctionnelle respiratoire, s’assure de l’absence de comorbidité, asthme ou BPCO, MICI, polyarthrite rhumatoïde, connectivites (volontiers associées), recherche des signes de dyskinésie ciliaire, de mucoviscidose et propose une stratégie médicale et/ou chirurgicale si les bronchectasies sont localisées.
Son évaluation clinique et fonctionnelle respiratoire est au moins annuelle, plus fréquente si comorbidités, insuffisance respiratoire, phénotype évolutif sévère. Ce d’autant plus qu’on peut proposer à ces patients de participer à des protocoles de recherche clinique.
Si le malade a plus de 3 exacerbations par an, on discute le bénéfice/risque d’une antibiothérapie au long cours par un macrolide, essentiellement azithromycine 250 mg 3 jours par semaine (per os) après s’être assuré de l’absence de mycobactérie atypique dans l’expectoration et une éventuelle contre-indication cardiologique (ECG de référence) ou association médicamenteuse pouvant allonger le QT et favoriser des troubles du rythme.
En cas d’isolement d’une mycobactérie atypique, d’un staphylocoque doré métirésistant, de P. aeruginosa, le spécialiste propose des stratégies d’éradication et/ou une antibiothérapie inhalée (actuellement hors AMM : colimycine, voire tobramycine inhalées).
Un pyocyanique est un facteur de mauvais pronostic, qui augmente le risque d’hospitalisation, altère la qualité de vie et multiplie par 3 la mortalité.
Une dyspnée se majorant peut témoigner de l’évolution vers une insuffisance respiratoire chronique, voire faire discuter une oxygénothérapie. Le malade, s’il est jeune, peut être orienté vers un projet de transplantation.
Le traitement d’une exacerbation à P. aeruginosa requiert fréquemment une hospitalisation première car il repose une double antibiothérapie intraveineuse pendant 14 jours (bêtalactamine ciblant le pyocyanique et aminoside, puis adaptée à l’antibiogramme), associée à une augmentation du drainage bronchique.
Une hémoptysie de faible abondance mais récidivante requiert un avis pneumologique.
Maladie et soins impactent grandement la qualité de vie du patient. L’adhésion aux drainages et aux inhalations d’antibiotiques est de l’ordre de 50 %. La surmortalité est respiratoire mais aussi cardiovasculaire chez les patients les plus sévères (probablement liée à l’inflammation systémique associée).
La gestion de la fin de vie chez les plus âgés très symptomatiques peut être difficile notamment en cas de comorbidités, de troubles cognitifs associés et doit faire l’objet d’une prise en charge concertée.
Son évaluation clinique et fonctionnelle respiratoire est au moins annuelle, plus fréquente si comorbidités, insuffisance respiratoire, phénotype évolutif sévère. Ce d’autant plus qu’on peut proposer à ces patients de participer à des protocoles de recherche clinique.
Si le malade a plus de 3 exacerbations par an, on discute le bénéfice/risque d’une antibiothérapie au long cours par un macrolide, essentiellement azithromycine 250 mg 3 jours par semaine (per os) après s’être assuré de l’absence de mycobactérie atypique dans l’expectoration et une éventuelle contre-indication cardiologique (ECG de référence) ou association médicamenteuse pouvant allonger le QT et favoriser des troubles du rythme.
En cas d’isolement d’une mycobactérie atypique, d’un staphylocoque doré métirésistant, de P. aeruginosa, le spécialiste propose des stratégies d’éradication et/ou une antibiothérapie inhalée (actuellement hors AMM : colimycine, voire tobramycine inhalées).
Un pyocyanique est un facteur de mauvais pronostic, qui augmente le risque d’hospitalisation, altère la qualité de vie et multiplie par 3 la mortalité.
Une dyspnée se majorant peut témoigner de l’évolution vers une insuffisance respiratoire chronique, voire faire discuter une oxygénothérapie. Le malade, s’il est jeune, peut être orienté vers un projet de transplantation.
Le traitement d’une exacerbation à P. aeruginosa requiert fréquemment une hospitalisation première car il repose une double antibiothérapie intraveineuse pendant 14 jours (bêtalactamine ciblant le pyocyanique et aminoside, puis adaptée à l’antibiogramme), associée à une augmentation du drainage bronchique.
Une hémoptysie de faible abondance mais récidivante requiert un avis pneumologique.
Maladie et soins impactent grandement la qualité de vie du patient. L’adhésion aux drainages et aux inhalations d’antibiotiques est de l’ordre de 50 %. La surmortalité est respiratoire mais aussi cardiovasculaire chez les patients les plus sévères (probablement liée à l’inflammation systémique associée).
La gestion de la fin de vie chez les plus âgés très symptomatiques peut être difficile notamment en cas de comorbidités, de troubles cognitifs associés et doit faire l’objet d’une prise en charge concertée.
Encadre
Que dire à vos patients
Il existe un groupe européen de patients atteints de maladies respiratoires chroniques, notamment de bronchectasies.
Renseignez-vous sur le site en français de l’European Lung Foundation : europeanlung.org/fr/
Version française des recommandations européennes : https://bit.ly/2U9v4kq
Références
1. Quint JK, Millett ER, Joshi M, et al. Changes in the incidence, prevalence and mortality of bronchiectasis in the UK from 2004 to 2013: a population-based cohort study. Eur Respir J 2016;47:186-93.
2. Quinn TM, Hill A. Non-cystic fibrosis bronchiectasis in the elderly: current perspectives. Clin Interv Aging 2018;13:1649-56.
3. King PT, Holdsworth SR, Freezer NJ, Villanueva E, Holmes PW. Characterisation of the onset and presenting clinical features of adult bronchiectasis. Respir Med 2006;100:2183-9.
4. Gruffydd-Jones K, Keeley D, Knowles V, el al. Primary care implications of British Thoracic Society Guidelines for bronchiectasis in adults. NPJ Prim Care Respir Med 2019;29:24.
5. Polverino E, Goeminne PC, McDonnell MJ, et al. European Respiratory Society guidelines for the management of adult bronchiectasis. Eur Respir J 2017;50:1700629.
6. Hill AT, Haworth CS, Aliberti S, et al. Pulmonary exacerbation in adults with bronchiectasis: a consensus definition for clinical research. Eur Respir J 2017;49:1700051.
7. Chalmers JD, Moffitt KL, Suarez-Cuartin G, et al. Neutrophil elastase activity is associated with exacerbations and lung function decline in bronchiectasis. Am J Respir Crit Care Med 2017;195:1384-93.
8. Evans IE, Bedi P, Quinn TM, Hill AT. Bronchiectasis severity is an independent risk factor for vascular disease in a bronchiectasis cohort. Chest 2017;151:383-8.
2. Quinn TM, Hill A. Non-cystic fibrosis bronchiectasis in the elderly: current perspectives. Clin Interv Aging 2018;13:1649-56.
3. King PT, Holdsworth SR, Freezer NJ, Villanueva E, Holmes PW. Characterisation of the onset and presenting clinical features of adult bronchiectasis. Respir Med 2006;100:2183-9.
4. Gruffydd-Jones K, Keeley D, Knowles V, el al. Primary care implications of British Thoracic Society Guidelines for bronchiectasis in adults. NPJ Prim Care Respir Med 2019;29:24.
5. Polverino E, Goeminne PC, McDonnell MJ, et al. European Respiratory Society guidelines for the management of adult bronchiectasis. Eur Respir J 2017;50:1700629.
6. Hill AT, Haworth CS, Aliberti S, et al. Pulmonary exacerbation in adults with bronchiectasis: a consensus definition for clinical research. Eur Respir J 2017;49:1700051.
7. Chalmers JD, Moffitt KL, Suarez-Cuartin G, et al. Neutrophil elastase activity is associated with exacerbations and lung function decline in bronchiectasis. Am J Respir Crit Care Med 2017;195:1384-93.
8. Evans IE, Bedi P, Quinn TM, Hill AT. Bronchiectasis severity is an independent risk factor for vascular disease in a bronchiectasis cohort. Chest 2017;151:383-8.

 Encadrés
Encadrés