Un patient âgé de 66 ans est admis aux urgences pour une insuffisance respiratoire aiguë nécessitant une oxygénothérapie. Il est connu pour une infection au virus de l’immunodéficience humaine (VIH) depuis seize ans (stade C3 multirésistant depuis quatorze ans), avec un suivi régulier en infectiologie et sans antécédent de lithiase urinaire. Le patient est normocarde, normotendu, apyrétique et désaturant à 86 % en air ambiant. Le bilan biologique est sans particularité hormis les D-dimères (ajustés pour l’âge) augmentés. Le scanner thoracique met en évidence une embolie pulmonaire et, fortuitement, un calcul rénal, sans signes cliniques de colique rénale, sans insuffisance rénale et sans hématurie.
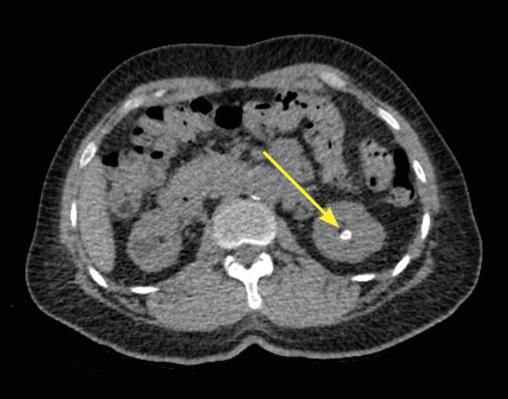
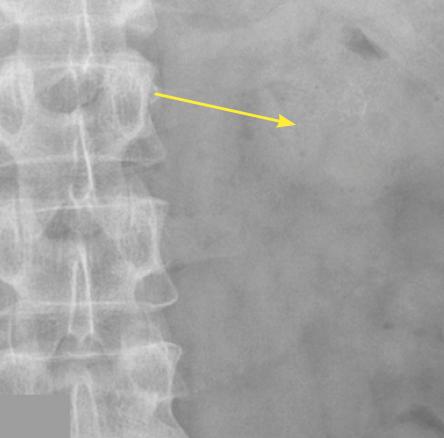
Lors de son hospitalisation, un scanner abdominal permet de localiser avec précision un calcul caliciel rénal radio-opaque gauche de 6 × 8 mm, de faible densité (354 UH), sans dilatation calicielle (fig. 1). En corrélation avec la lecture du scanner, le pourtour du calcul est difficilement visualisé sur la radiographie de l’abdomen sans préparation (fig. 2).
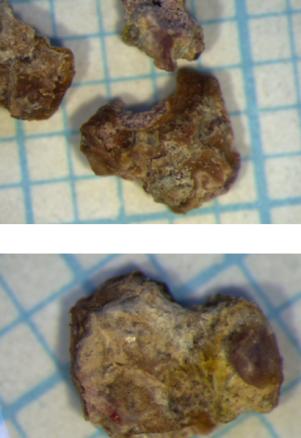
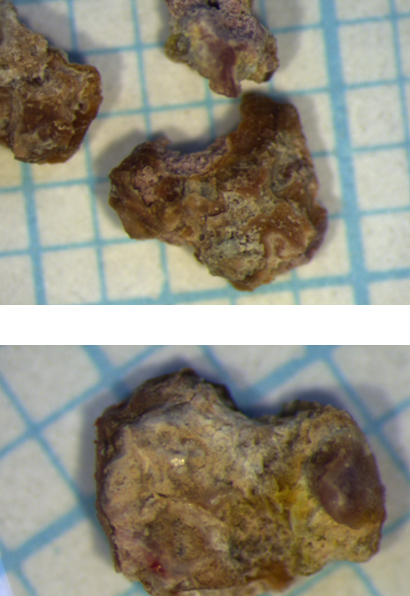
En raison de la taille du calcul, qui expose à un risque de migration symptomatique urétérale, l’ablation urétéroscopique est décidée et réalisée de manière élective une fois le traitement anticoagulant de l’embolie pulmonaire terminé. L’intervention se déroule sans complication (lithotripsie au laser in situ et extraction du calcul) [fig. 3]. Le patient est rentré chez lui vingt-quatre heures heures plus tard.
L’analyse du calcul par spectrophotométrie infrarouge révèle une formation étonnante, entièrement composée de sulfate d’atazanavir, un inhibiteur de protéase, utilisé en association avec du ritonavir. Cette origine médicamenteuse exclusive, extrêmement rare, a entraîné un signalement de pharmacovigilance pour effet indésirable auprès de Swissmedic(autorité suisse d’autorisation et de surveillance des produits thérapeutiques). Le patient avait débuté cet antirétroviral il y a onze ans, l’avait pris pendant quatre ans à une dose quotidienne de 300 mg, puis l’avait arrêté il y a sept ans.
Lors de son hospitalisation, un scanner abdominal permet de localiser avec précision un calcul caliciel rénal radio-opaque gauche de 6 × 8 mm, de faible densité (354 UH), sans dilatation calicielle (fig. 1). En corrélation avec la lecture du scanner, le pourtour du calcul est difficilement visualisé sur la radiographie de l’abdomen sans préparation (fig. 2).
En raison de la taille du calcul, qui expose à un risque de migration symptomatique urétérale, l’ablation urétéroscopique est décidée et réalisée de manière élective une fois le traitement anticoagulant de l’embolie pulmonaire terminé. L’intervention se déroule sans complication (lithotripsie au laser in situ et extraction du calcul) [fig. 3]. Le patient est rentré chez lui vingt-quatre heures heures plus tard.
L’analyse du calcul par spectrophotométrie infrarouge révèle une formation étonnante, entièrement composée de sulfate d’atazanavir, un inhibiteur de protéase, utilisé en association avec du ritonavir. Cette origine médicamenteuse exclusive, extrêmement rare, a entraîné un signalement de pharmacovigilance pour effet indésirable auprès de Swissmedic(autorité suisse d’autorisation et de surveillance des produits thérapeutiques). Le patient avait débuté cet antirétroviral il y a onze ans, l’avait pris pendant quatre ans à une dose quotidienne de 300 mg, puis l’avait arrêté il y a sept ans.
Les auteurs remercient le service de radiologie et le service de pathologie des Hôpitaux universitaires de Genève (HUG) pour les images fournies.
Références
1. Reyataz (atazanavir sulfate): Full prescription information. European Medicines Agency. 28/09/2016. https://www.ema.europa.eu/en/medicines/human/EPAR/reyataz
2. Lebovitch S, Mydlo JH. HIV-AIDS : Urologic considerations. Urol Clin North Am 2008;35(1):59-68.
3. Wang LC, Osterberg EC, David SC, et al. Recurrent nephrolithiasis associated with atazanavir use. BMJ Case Rep 2014;2014:bcr2013201565.
4. Laditi F, Khan AI, Ghiraldi EM, et al. Endourological management of a rare radiopaque ritonavir-composed urinary calculus. Urol Case Rep 2021;39(1):101763.
5. Couzigou C, Daudon M, Meynard JL, et al. Urolithiasis in HIV-positive patients treated with atazanavir. Clin Infect Dis 2007;45(8):105-8.
6. Raheem OA, Mirheydar HS, Palazzi K, et al. Prevalence of nephrolithiasis in human immunodeficiency virus infected patients on the highly active antiretroviral therapy. J Endourol 2012;26(8):1095-8.
7. Hamada Y, Nishijima T, Watanabe K, et al. High incidence of renal stones among HIV-infected patients on ritonavir-boosted atazanavir than in those receiving other protease inhibitor–containing antiretroviral therapy. Clin Infect Dis 2012;55(9):1262-9.
8. Yudkoff BL, Linsenmeyer TA, Oakley A, et al. Urolithiasis associated with indinavir in a patient with spinal cord injury. J Spinal Cord Med 2004;27(3):263-5.
9. Fernández JM, Robles JE, Regojo JM, et al. Renal lithiasis due to indinavir. Rev Med Univ Navarra 2002;46(3):28-32.
10. Lafaurie M, De Sousa B, Ponscarme D, et al. Clinical features and risk factors for atazanavir (ATV)-associated urolithiasis: A case-control study. PLOS One 2014;9(11):e112836.
11. Fabbiani M, Bracciale L, Doino M, et al. Tenofovir discontinuation could predispose to urolithiasis in atazanavir- treated patients. J Infect 2011;62(4),319-21.
12. de Lastours V, Ferrari Rafael De Silva E, Daudon M, et al. High levels of atazanavir and darunavir in urine and crystalluria in asymptomatic patients. J Antimicrob Chemother 2013;68(8):1850-6.
2. Lebovitch S, Mydlo JH. HIV-AIDS : Urologic considerations. Urol Clin North Am 2008;35(1):59-68.
3. Wang LC, Osterberg EC, David SC, et al. Recurrent nephrolithiasis associated with atazanavir use. BMJ Case Rep 2014;2014:bcr2013201565.
4. Laditi F, Khan AI, Ghiraldi EM, et al. Endourological management of a rare radiopaque ritonavir-composed urinary calculus. Urol Case Rep 2021;39(1):101763.
5. Couzigou C, Daudon M, Meynard JL, et al. Urolithiasis in HIV-positive patients treated with atazanavir. Clin Infect Dis 2007;45(8):105-8.
6. Raheem OA, Mirheydar HS, Palazzi K, et al. Prevalence of nephrolithiasis in human immunodeficiency virus infected patients on the highly active antiretroviral therapy. J Endourol 2012;26(8):1095-8.
7. Hamada Y, Nishijima T, Watanabe K, et al. High incidence of renal stones among HIV-infected patients on ritonavir-boosted atazanavir than in those receiving other protease inhibitor–containing antiretroviral therapy. Clin Infect Dis 2012;55(9):1262-9.
8. Yudkoff BL, Linsenmeyer TA, Oakley A, et al. Urolithiasis associated with indinavir in a patient with spinal cord injury. J Spinal Cord Med 2004;27(3):263-5.
9. Fernández JM, Robles JE, Regojo JM, et al. Renal lithiasis due to indinavir. Rev Med Univ Navarra 2002;46(3):28-32.
10. Lafaurie M, De Sousa B, Ponscarme D, et al. Clinical features and risk factors for atazanavir (ATV)-associated urolithiasis: A case-control study. PLOS One 2014;9(11):e112836.
11. Fabbiani M, Bracciale L, Doino M, et al. Tenofovir discontinuation could predispose to urolithiasis in atazanavir- treated patients. J Infect 2011;62(4),319-21.
12. de Lastours V, Ferrari Rafael De Silva E, Daudon M, et al. High levels of atazanavir and darunavir in urine and crystalluria in asymptomatic patients. J Antimicrob Chemother 2013;68(8):1850-6.
Une question, un commentaire ?