En matière de cancers, le premier biais inconscient à redresser est que près de la moitié d’entre eux surviennent après l’âge de 65 à 70 ans. Premier cancer de la femme, le cancer du sein ne fait pas exception à la règle : 40 % sont diagnostiqués à l’âge de 70 ans et plus en France, selon les chiffres de Globocan1 ou de l’European Cancer Information System (ECIS).2
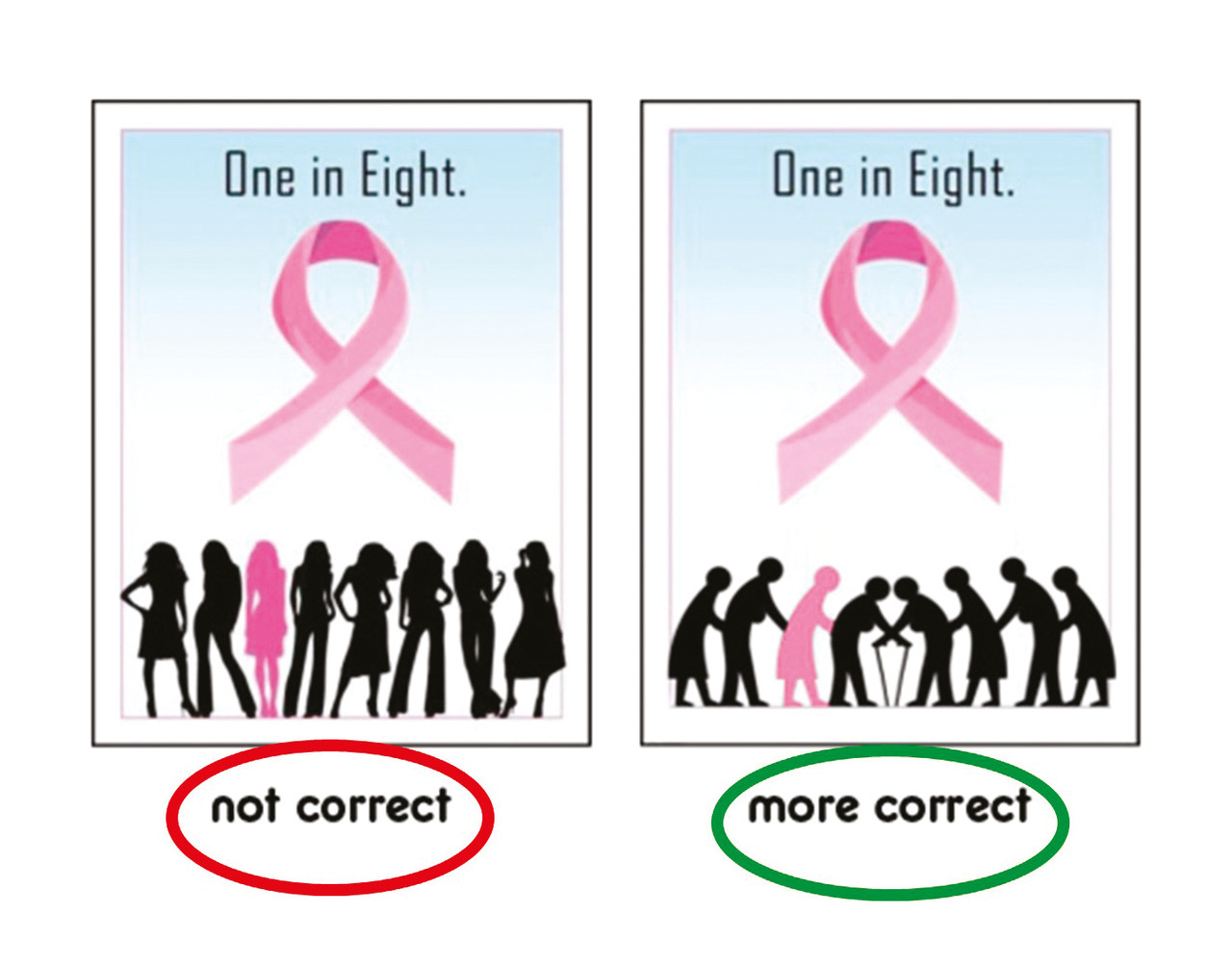
Mais sa représentation médiatique, très tournée vers la femme plus jeune ou d’âge moyen, avec ou sans enfants, est influencée par une discrimination négative sur l’âge dans la société (fig. 1). Son incidence est résumée de manière courante par « une femme sur huit développera un cancer dans son existence », oubliant de préciser que son risque de survenue augmente avec l’âge et est donc beaucoup plus important chez la femme plus âgée (tableau). Cette discrimination s’observe dans la pratique quotidienne mais aussi dans le domaine de la recherche sur le cancer en général, puisque moins de 10 % des sujets inclus dans les études cliniques sont âgés de plus de 70 ans et, s’ils le sont, ils font l’objet d’une sélection spécifique (moins de comorbidités, etc.) ; ils ne sont donc pas représentatifs de la population âgée courante3 dans laquelle la fragilité liée au vieillissement croît progressivement et est présente de manière significative dès l’âge de 70 ans.4
Malgré plusieurs campagnes combattant cet âgisme, les attitudes ont peu changé, tout particulièrement dans le domaine de la recherche. La proportion de sujets âgés dans les études cliniques, alors qu’ils représentent la population la plus touchée par le cancer, ne s’est pas améliorée en deux décennies. La recherche classique continue à produire des données utiles pour faire progresser les traitements et mettre à jour les recommandations, mais le niveau de preuve qu’elle apporte pour les patients âgés, qu’elle inclut peu ou pas, reste faible. Les oncologues ont donc tendance à utiliser des standards développés avec discrimination sur l’âge pour des sujets plus jeunes, puis à les extrapoler sans grand discernement à destination des plus âgés, une autre forme d’âgisme.
Exemple du cancer du sein localisé chez la femme âgée
Chez la femme âgée de plus de 70 ans, le cancer du sein est dit luminal dans 80 % des cas, c’est-à-dire potentiellement hormonosensible car présentant des récepteurs hormonaux. Les formes réputées agressives, avec surexpression de HER2 ou triple négative (sans récepteurs hormonaux ni surexpression de HER2) sont plus rares que chez le sujet jeune. Sauf découverte de métastases, la prise en charge locale consiste généralement en une chirurgie mammaire conservatrice – si elle est possible – et ganglionnaire limitée (ganglion sentinelle), puis en une radiothérapie postopératoire. Pour ce qui concerne les traitements généraux dits « systémiques », l’hormonothérapie adjuvante limite de manière importante le risque de rechute, mais la chimiothérapie, très peu étudiée chez ces sujets âgés, génère des débats réguliers.5 En effet, du fait de la fragilité croissante avec l’âge, l’intensité des traitements doit souvent être ajustée (durée, doses, nombre d’agents cytotoxiques, etc.) et d’autant plus que leurs effets indésirables sont importants.6,7 Les comorbidités sont constamment en compétition avec le cancer pour le pronostic vital : plus de la moitié des patientes avec un cancer du sein meurent d’une autre cause que celui-ci, proportion augmentant rapidement avec le nombre de comorbidités.8 Outre le fait qu’ils n’ont pas été étudiés correctement ou de façon représentative dans la population âgée, certains traitements comme la chimiothérapie, mais aussi les stratégies d’hormonothérapie moderne incluant des inhibiteurs de cyclines, requièrent de nombreuses adaptations de doses, interruptions, arrêts, etc. Paradoxalement, les signatures génomiques, développées pour mieux préciser les indications de chimiothérapie en plus de l’hormonothérapie selon l’agressivité tumorale (l’éviter en cas de bon pronostic, la recommander en cas d’agressivité), l’ont été, comme pour les médicaments, dans la population plus jeune, sans inclure de patients âgés de plus de 70 ans ou très peu.9 L’étude ASTER 70s (Adjuvant Systemic Treatment for œstrogen-receptor [ER]-positive HER2 -negative breast carcinoma in women over 70 according to genomic grade index) participe à combler le manque de données en la matière.10
Essai ASTER 70s
L’étude ASTER 70s a marqué un tournant dans la recherche française en oncogériatrie. Elle a renversé les règles, s’intéressant spécifiquement et exclusivement à la patiente âgée de 70 ans et plus présentant un cancer du sein (40 % des cancers du sein tous âges confondus), localisé et de phénotype luminal, le plus fréquent à cet âge.
Modalités de l’étude
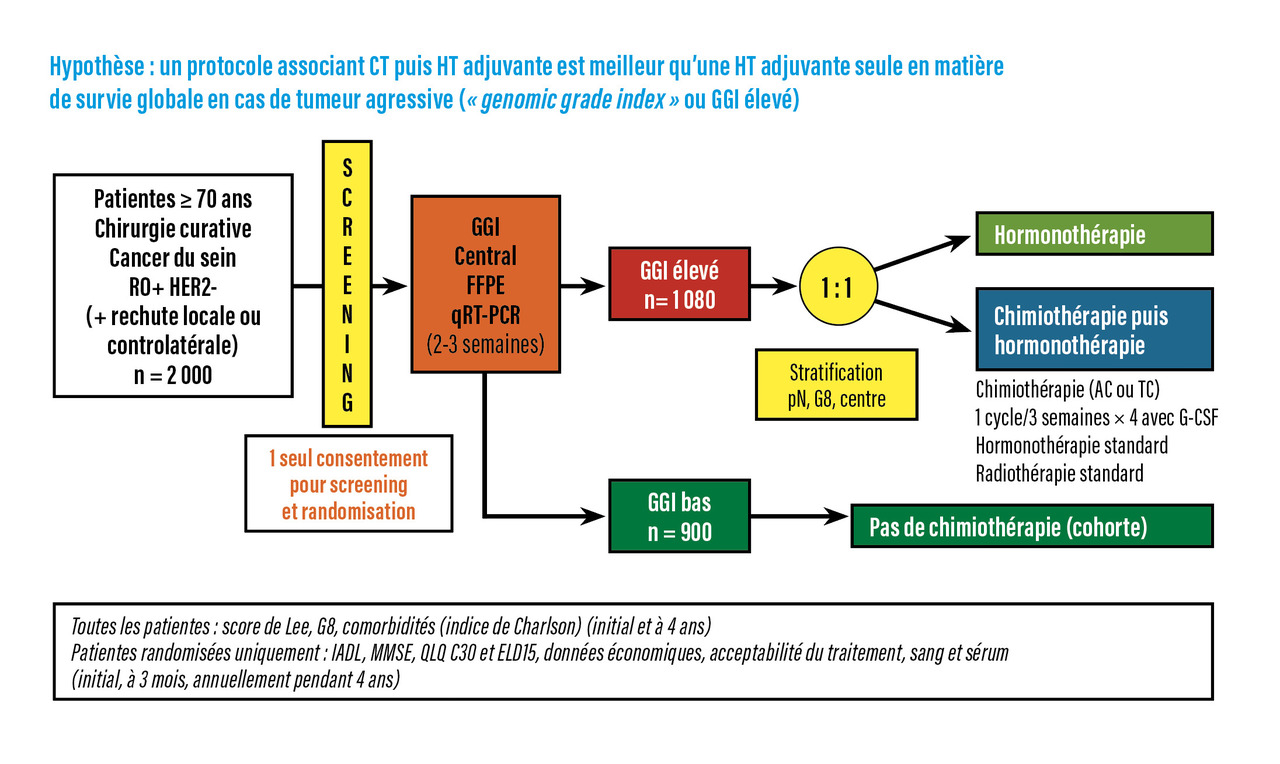
Centrée sur la biologie tumorale, qui était en plein essor à l’époque de son ouverture, l’étude avait plusieurs caractéristiques permettant de faciliter la participation des patientes âgées (fig. 2) :10rationnel reposant sur le principe que, chez ces patientes, l’hormonothérapie est le traitement de référence (et non la chimiothérapie très mal ou pas étudiée chez elles et donc utilisée avec beaucoup d’incertitude) ;design de supériorité ou d’escalade cherchant à démontrer que la chimiothérapie peut apporter un bénéfice à cet âge lorsqu’un cancer du sein luminal possède des signes biologiques modernes d’agressivité au travers d’une signature génomique, le genomic grade index (GGI) [et non design d’infériorité comme dans les études chez le sujet plus jeune où il était plus important de désescalader les indications de chimiothérapie ayant beaucoup crû sans discernement entre 1985 et 2005] ;
- critères d’inclusion très tolérants pour les pathologies associées retrouvées chez les personnes âgées (comorbidités significatives, autre cancer sans limite de délai dès lors que son traitement était terminé, cancer du sein controlatéral, voire rechute locale posant la même question du traitement adjuvant systémique), exigeant seulement un succès d’analyse du GGI. Pragmatiquement, il s’agissait d’une situation dans laquelle l’équipe médicale de prise en charge estimait qu’une chimiothérapie faisait partie des traitements à discuter et dans laquelle le souhait de la patiente était d’avoir une meilleure détermination de son risque de rechute avec un test innovant, le GGI ;
- seules les patientes dont la tumeur était réputée agressive, avec GGI élevé, ont été randomisées entre chimiothérapie avant hormonothérapie ou hormonothérapie seule et avaient un suivi détaillé ;
- suivi simplifié des patientes dont le GGI bas était favorable, non randomisées et ne recevant pas de chimiothérapie, et des patientes non randomisées pour une autre raison (refus du traitement attribué par la randomisation principalement), rassemblées dans la même cohorte ;
- utilisation d’un seul consentement éclairé pour le screening (recherche des tumeurs au GGI élevé) et la randomisation (chimiothérapie ou pas) ;
- analyse du GGI sur fragment tumoral inclus en paraffine facilement transmissible pour analyse centralisée (et non sur matériel congelé comme dans MINDACT) ;11
- recherche d’un bénéfice apporté par la chimiothérapie sur la survie globale, critère de jugement principal robuste, reproductible et centré sur le patient, et qui soit cliniquement significatif (hazard ratio de 0,61, correspondant à un bénéfice absolu de 7,5 % à quatre ans) pour compenser et justifier les effets indésirables attendus de la chimiothérapie ;
- utilisation d’une chimiothérapie de quatre cycles sur douze semaines, adaptée au sujet âgé, à base d’anthracycline (AC) ou de taxane (TC), donc beaucoup plus courte que dans les schémas utilisés chez le patient plus jeune incluant une anthracyline et un taxane, plus agressifs et moins bien tolérés ;
- analyse en intention de traiter, c’est-à-dire quel que soit le traitement randomisé finalement réalisé ;
- collecte longitudinale d’informations relatives à la qualité de vie, à l’état de santé gériatrique, à l’acceptabilité de la chimiothérapie et au coût de la prise en charge ;
- suivi prolongé simplifié jusqu’à dix ans.
Construite de 2008 à 2011 avec un financement par le programme hospitalier de recherche clinique (PHRC) national cancer et plusieurs partenaires industriels (dont Ipsogen, fournissant le GGI) et associatifs, l’étude ASTER 70s a recruté sans difficulté, de 2012 à 2016, près de 2 000 patientes, conformément aux prévisions et contredisant les prédictions pessimistes initiales, dans 72 centres français et 12 centres belges représentant tous les contextes d’exercice (centre de lutte contre le cancer, centre universitaire, hôpital périphérique, clinique privée).
L’analyse du GGI a été possible sur la tumeur de 1 901 patientes sur les 1 969 incluses, retrouvant 1 160 patientes avec une tumeur au GGI élevé (61 %). Parmi elles, 1 089 patientes ont été randomisées pour la chimiothérapie ; 880 autres, majoritairement avec GGI bas (84 %), ont été incluses dans la cohorte parallèle de suivi. D’un âge médian de 75 ans et allant jusqu’à 92 ans, 40 % des patientes randomisées avaient des signaux de fragilité liées au vieillissement (score de dépistage G8 inférieur ou égal à 14), une tumeur de 2 cm ou moins et sans envahissement ganglionnaire dans 44 et 55 % des cas respectivement, et une tumeur du sein controlatérale ou en récidive locale dans 13 % des cas. Les caractéristiques des tumeurs des patientes non randomisées car avec GGI bas étaient naturellement de pronostic un peu meilleur.
Résultats
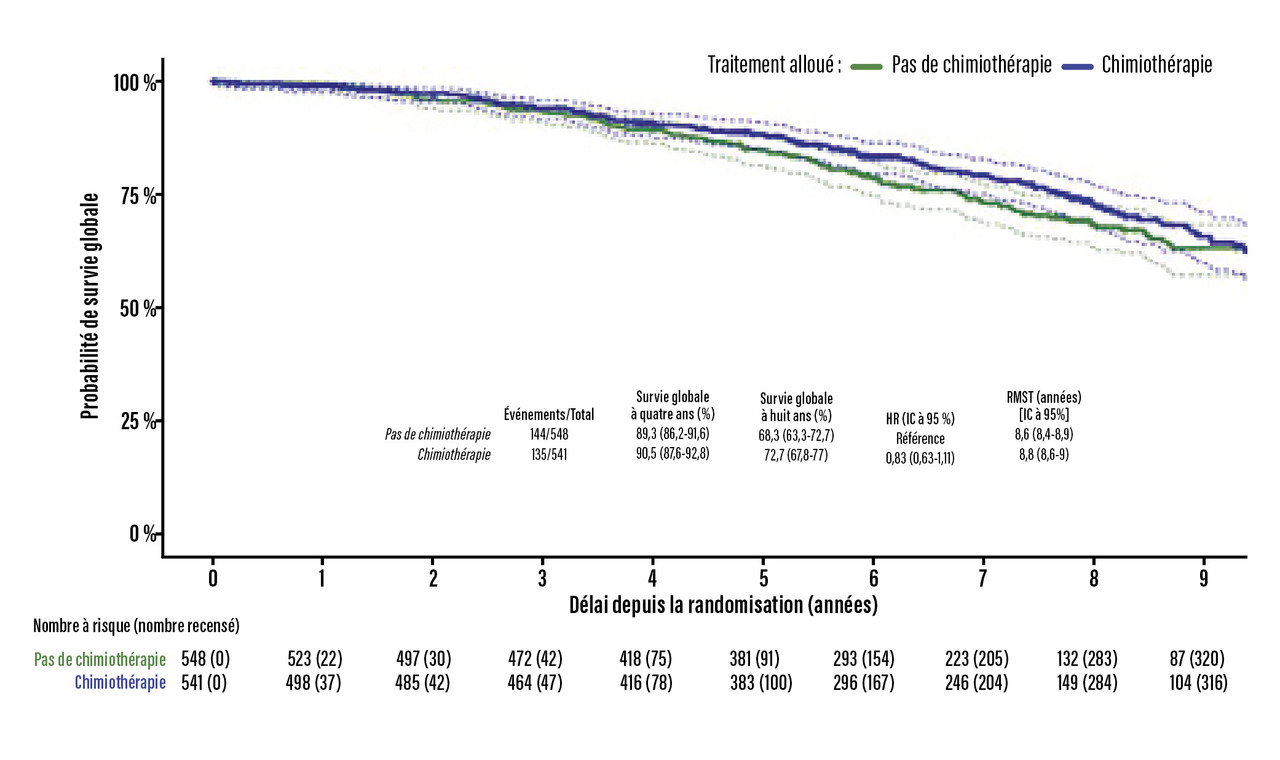
Après huit ans de suivi médian, la survie globale des patientes randomisées pour une chimiothérapie n’était pas statistiquement significativement meilleure que celle des patientes randomisées pour une hormonothérapie seule (fig. 3), avec les comorbidités et autres raisons que le cancer du sein en première cause de décès dans les deux groupes. Ces résultats étaient vrais quel que soit le sous-groupe d’intérêt préspécifié dans le plan d’analyse statistique ou pour la stratification de la randomisation, ne montrant pas d’hétérogénéité du traitement. De même, ces résultats étaient similaires pour les critères de jugement secondaires « survie sans récidive invasive » et « survie spécifique liée au cancer du sein », consolidés par les analyses de sensibilité (analyse per protocole portant sur les seules patientes ayant réellement reçu le traitement déterminé par la randomisation, analyse en risques compétitifs selon le modèle de Fine and Gray, Restricted mean survival time, etc.).
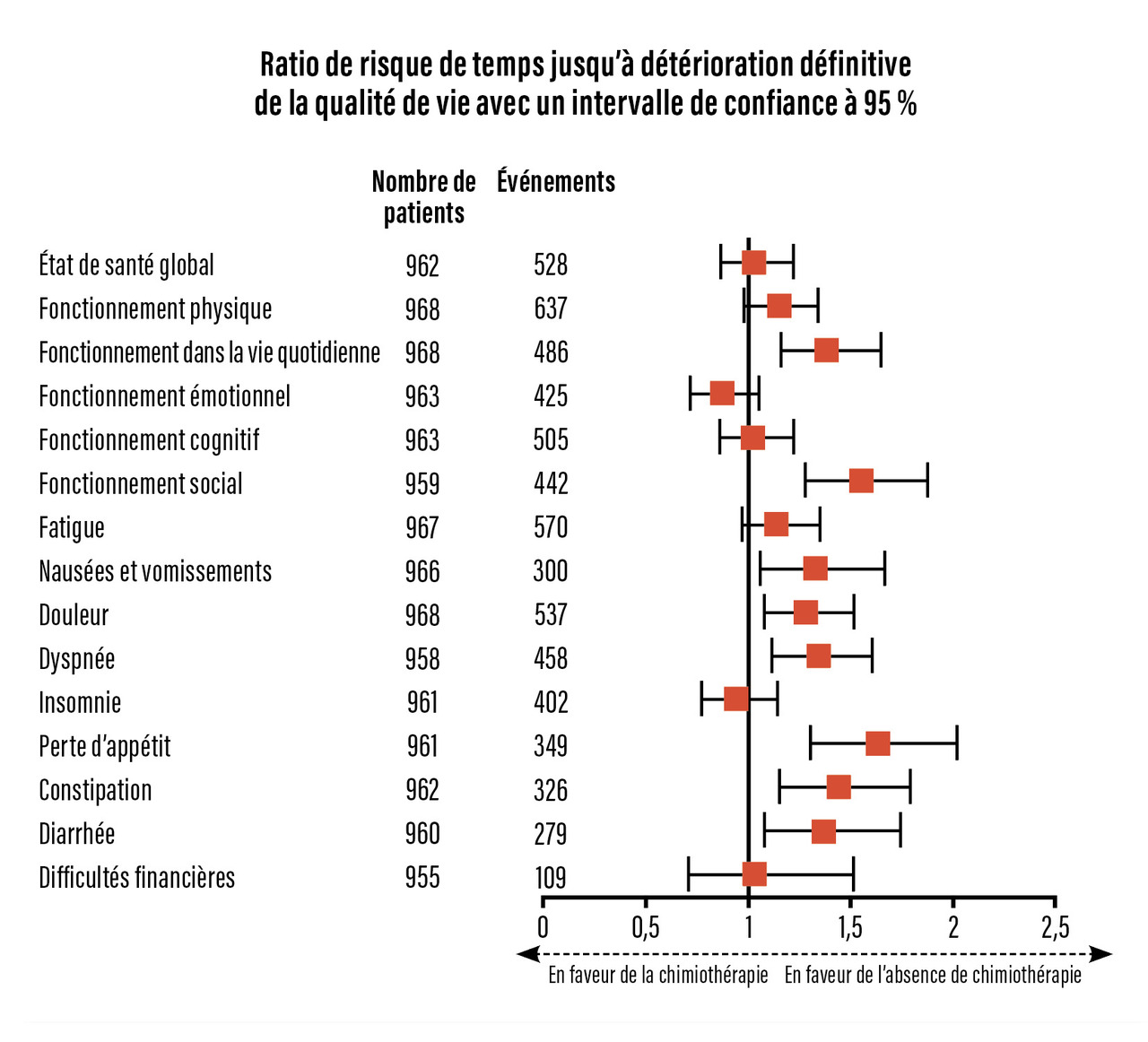
Inversement, et comme on pouvait s’y attendre, il existait davantage d’événements indésirables (graves, de grade ≥ 3 ou tous confondus) et une qualité de vie altérée dans tous les domaines dans le groupe de patientes randomisées pour la chimiothérapie (fig. 4). En revanche, lorsqu’elle était réalisée, la chimiothérapie était rarement interrompue avant la fin des quatre cycles prévus, montrant le respect d’une bonne dose-intensité relative qu’explique certainement le schéma court employé, adapté à l’âge.
Enfin, le GGI était fortement discriminant puisque les patientes non randomisées avaient une survie globale statistiquement significativement supérieure à celle des patientes randomisées (avec ou sans chimiothérapie).
Il faut noter que 21 % des patientes randomisées dans le bras chimiothérapie ne l’ont pas reçue, principalement par refus. Mais il ne s’agirait pas ici d’attribuer les résultats de l’étude « négatifs » pour la chimiothérapie à ce taux de non-adhésion à la chimiothérapie, minimisant leur portée, en prétendant qu’ils concernent une population âgée moins facile à inclure dans un essai clinique (discrimination négative) alors que des taux similaires sont régulièrement décrits dans de grands essais randomisés et l’ont été en particulier pour les essais sur les signatures génomiques pour le cancer du sein luminal ayant inclus des sujets plus jeunes, ce qu’on oublie souvent de signaler et reconnaître (MINDACT11 17 %, TAILORx12 18 %, RxPONDER13 20 % pour la population ménopausée). De plus, la puissance de l’essai et le nombre de patientes à inclure avaient été augmentés pour pallier ce taux de non-adhésion repéré lors du premier comité de surveillance indépendant de l’essai, et l’analyse publiée a été conduite sur 63 % d’événements supplémentaires par rapport aux 171 prévus dans le plan d’analyse statistique.
L’hormonothérapie reste le traitement de référence
La chimiothérapie adjuvante n’apporte donc pas de bénéfice statistiquement significatif sur la survie globale de ces patientes âgées de plus de 70 ans, ni sur la survie sans récidive invasive ou spécifique au cancer du sein, en « intention de traiter » ou en « per protocole », et quel que soit le sous-groupe défini sur la tumeur ou sur la fragilité de la patiente. Elle génère, en revanche, davantage d’effets indésirables responsables d’une détérioration statistiquement significative de la qualité de vie. La chimiothérapie a donc un bénéfice marginal non significatif, en faveur de sa désescalade et d’un recours prudent très optionnel. L’hormonothérapie demeure le traitement de référence.
Ces résultats ont fait l’objet d’une restitution publique pour les patientes, les investigateurs, les associations de patientes et les partenaires (financeurs et soutiens), organisée le 30 octobre 2025 au palais du Luxembourg (Paris), pour clôturer la campagne Octobre rose 2025. Ils ont permis à l’institut Curie, l’Institut des cancers des femmes et Unicancer de rassembler tous les partenaires impliqués dans un collectif citoyen afin de travailler à obtenir une meilleure représentation des sujets âgés atteints de cancer dans la recherche et de porter leur voix.14
2. European Cancer Information System (ECIS). https://urls.fr/rfIp6H
3. Bertagnolli MM, Singh H. Treatment of older adults with cancer. Addressing gaps in evidence. N Engl J Med 2021;385(12):1062-5.
4. Kim DH, Rockwood K. Frailty in older adults. N Engl J Med 2024;391(6):538-48.
5. Biganzoli L, Battisti NML, Wildiers H, et al. Updated recommendations regarding the management of older patients with breast cancer: A joint paper from the European Society of Breast Cancer Specialists (EUSOMA) and the International Society of Geriatric Oncology (SIOG). Lancet Oncol 2021;22(7):e327-e340.
6. Brain EGC. Systemic therapy in older patients with high-risk disease. Am Soc Clin Oncol Educ Book 2023;43:e390456.
7. Brain E. Prise en charge des cancers lors du grand âge : une prise en charge personnalisée est-elle possible ? Bull Acad Natl Med 2023;207:472-7.
8. Derks MGM, van de Velde CJH, Giardiello D, et al. Impact of comorbidities and age on cause-specific mortality in postmenopausal patients with breast cancer. Oncologist 2019;24(7):e467-e474.
9. Battisti NML, De Glas N, Soto-Perez-de-Celis E, et al. Chemotherapy and gene expression profiling in older early luminal breast cancer patients: An International Society of Geriatric Oncology systematic review. Eur J Cancer 2022;172:158-70.
10. Brain E, Mir O, Bourbouloux E, et al; GERICO&UCBG/Unicancer. Adjuvant chemotherapy and hormonotherapy versus adjuvant hormonotherapy alone for women aged 70 years and older with high-risk breast cancer based on the genomic grade index (ASTER 70s): A randomised phase 3 trial. Lancet 2025;406(10502):489-500.
11. Cardoso F, van’t Veer LJ, Bogaerts J, et al., and the MINDACT Investigators. 70-gene signature as an aid to treatment decisions in early-stage breast cancer. N Engl J Med 2016;375:717-29.
12. Sparano JA, Gray RJ, Makower DF, et al. Adjuvant chemotherapy guided by a 21-gene expression assay in breast cancer. N Engl J Med 2018;379:111-21.
13. Kalinsky K, Barlow WE, Gralow JR, et al. 21-gene assay to inform chemotherapy benefit in node-positive breast cancer. N Engl J Med 2021;385:2336-47.
14. Brain E, Le Gouill S, Vincent-Salomon A, et al. Faisons de l’inclusion des seniors dans les essais cliniques un impératif scientifique et un symbole de justice sociale. Le Monde, Science et Médecine, 26 novembre 2025.