Le traitement antibiotique d’une infection bactérienne est dit « probabiliste » lorsqu’il est administré sans documentation microbiologique, ni du germe incriminé, ni de sa sensibilité aux antibiotiques. L’antibiogramme permet d’ajuster précisément l’antibiothérapie, en déterminant la sensibilité des souches identifiées pour un panel de plusieurs antibiotiques.
Techniques d’antibiogramme
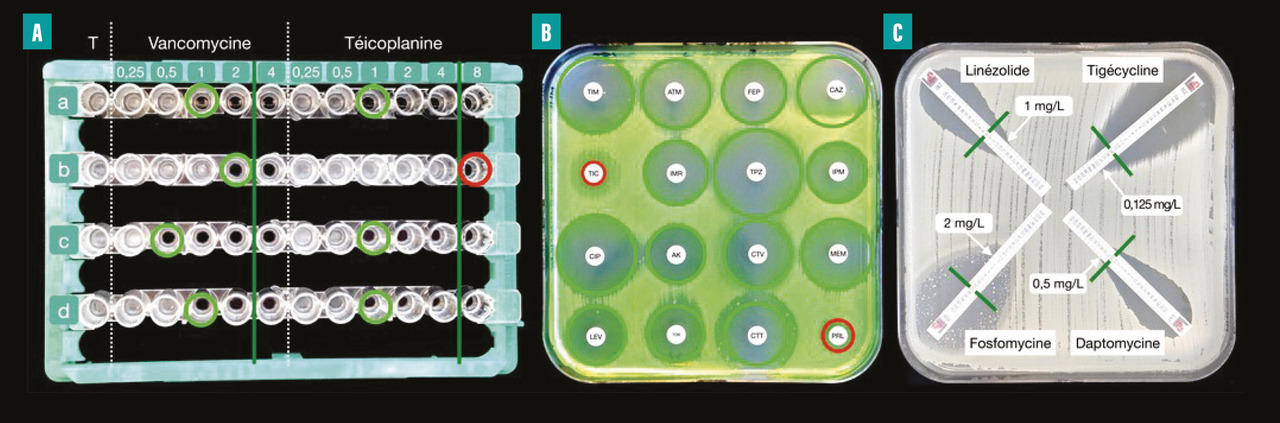
Plusieurs méthodes d’antibiogramme sont utilisées en routine par les laboratoires (fig. 1) :
- la microdilution en milieu liquide permet de déterminer la concentration minimale inhibitrice (CMI) de l’antibiotique (plus petite concentration de l’antibiotique capable d’inhiber la croissance bactérienne) ;
- la diffusion en milieu gélosé utilise des disques imprégnés d’une concentration déterminée d’antibiotique ;
- les bandelettes à gradient de concentration.
Concentrations minimales inhibitrices et diamètres critiques
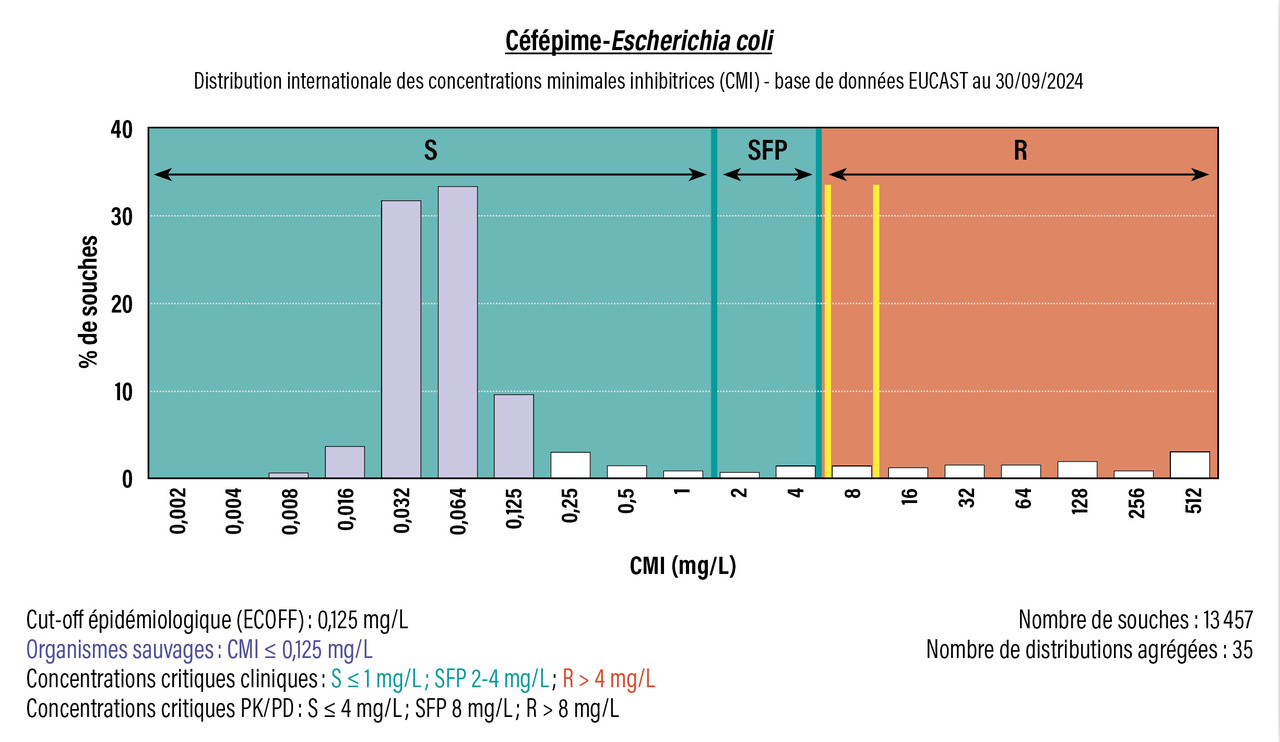
Les résultats de CMI ou les mesures de diamètres sont confrontés à des concentrations ou des diamètres « critiques », correspondant à des seuils au-dessus ou en-dessous desquels la bactérie est considérée comme sensible ou résistante à l’antibiotique testé. Ces valeurs critiques (ou breakpoints dans la terminologie anglophone) sont établies par l’European Committee on Antimicrobial Susceptibility Testing (EUCAST)1 et sont revues et déclinées en France dans un communiqué publié annuellement par le comité de l’antibiogramme de la Société française de microbiologie (CA-SFM).2 Pour un très grand nombre de couples antibiotique-bactérie, il existe des concentrations et des diamètres critiques dits « cliniques ».3 Ces valeurs sont spécifiques d’une espèce ou d’un genre bactérien. Elles sont établies sur la base de critères pharmacocinétiques/pharmacodynamiques (PK/PD), de critères bactériologiques avec l’epidemiological cut-off (ECOFF) défini comme la plus grande CMI pour les souches sauvages d’une espèce spécifique pour un antibiotique donné, et des données cliniques disponibles dans la littérature médicale (fig. 2). Pour une souche à tester et pour un antibiotique donné, la comparaison de la CMI ou du diamètre d’inhibition mesuré par rapport aux valeurs critiques cliniques permet d’établir la « catégorisation clinique » de l’antibiotique.
Anciennes catégories cliniques
Les cliniciens étaient habitués à l’existence de trois catégories cliniques distinctes : « sensible », « intermédiaire » et « résistant ». Si les catégories « sensible » (S) [forte probabilité de succès thérapeutique] et « résistant » (R) [fort risque d’échec thérapeutique] ne posaient généralement aucun problème de compréhension, il n’en allait pas de même pour la catégorie « intermédiaire » (I).4 La définition précise de cette catégorie « intermédiaire » était complexe et finalement méconnue de la plupart des cliniciens. Sous un seul et même terme « intermédiaire » (ou sous la lettre I) étaient regroupées quatre entités distinctes : efficacité de l’antibiotique à la condition d’utiliser de fortes posologies de l’antibiotique, efficacité sous condition d’une forte concentration naturelle de l’antibiotique sur le site infectieux, incertitude sur l’efficacité thérapeutique intrinsèque de la molécule et incertitude « technique » (zone grise du laboratoire). L’impossibilité de déterminer facilement à quelle notion de la définition rattacher le résultat conduisait presque systématiquement les cliniciens à ne pas prescrire un antibiotique rendu « intermédiaire ». En privilégiant les seules molécules rendues « sensibles », et donc en orientant préférentiellement pour les souches non sauvages l’usage d’antibiotiques à large spectre d’activité, l’ancien système de catégorisation clinique impactait négativement l’écologie bactérienne et favorisait l’émergence des résistances aux antibiotiques.5
Nouvelles catégories cliniques
Après plusieurs années de consultation, l’EUCAST a modifié la définition des catégories cliniques.5 Les catégories cliniques rendues avec les concentrations et les diamètres critiques des référentiels CA-SFM 2019 et ultérieurs sont désormais associées aux définitions suivantes :
Le point le plus important est de noter que, « débarrassée » des notions précédentes d’incertitude et « ajustée » sur des posologies bien précises (certes plus élevées que les posologies « usuelles », mais validées), la catégorie « sensible à forte posologie » présente la même garantie d’efficacité clinique que la catégorie « sensible à posologie standard » (à la seule condition que l’antibiotique soit prescrit à la posologie adéquate). Ce sont donc bien là deux catégories « sensibles » dont le clinicien dispose maintenant et auxquelles il peut accorder exactement la même confiance lors du choix de l’antibiotique à prescrire.
- la catégorie « sensible » devient « sensible à posologie standard » (forte probabilité de succès thérapeutique dès lors que la posologie standard de l’antibiotique est utilisée) ;
- la catégorie « résistant » garde la même terminologie (mais la définition précise désormais que le risque d’échec thérapeutique est élevé, même si l’antibiotique est utilisé à la posologie maximale recommandée) ;
- la catégorie « intermédiaire » subit le changement le plus radical, puisqu’elle est remplacée par la catégorie « sensible à forte posologie »* (l’utilisation de l’antibiotique est associée à une probabilité élevée de succès thérapeutique dès lors que la molécule est administrée à forte posologie ou se concentre fortement au site de l’infection).
Le point le plus important est de noter que, « débarrassée » des notions précédentes d’incertitude et « ajustée » sur des posologies bien précises (certes plus élevées que les posologies « usuelles », mais validées), la catégorie « sensible à forte posologie » présente la même garantie d’efficacité clinique que la catégorie « sensible à posologie standard » (à la seule condition que l’antibiotique soit prescrit à la posologie adéquate). Ce sont donc bien là deux catégories « sensibles » dont le clinicien dispose maintenant et auxquelles il peut accorder exactement la même confiance lors du choix de l’antibiotique à prescrire.
Terminologie dans le rendu des résultats
Pour éviter la confusion entre les anciennes et les nouvelles catégories cliniques et faciliter la compréhension des résultats par les cliniciens, les laboratoires sont encouragés à utiliser pour leurs comptes-rendus les nouvelles formulations « sensible à posologie standard » (ou la lettre S) et « sensible à forte posologie » (ou l’acronyme SFP, voire la lettre F).2
Lorsque la catégorisation clinique ne peut pas être établie sans risque d’erreur (résultat en ZIT), différentes formulations sont alors possibles (par exemple « non catégorisé », « CMI sur demande »).
Lorsque les résultats sont fondés uniquement sur les concentrations critiques génériques « PK/PD », voire uniquement sur les ECOFFs, les libellés « utilisation possible » et « utilisation déconseillée » peuvent être utilisés pour nuancer la réponse.
Lorsque des molécules doivent impérativement être utilisées en association, les libellés « sensible à posologie standard (en association) » ou le cas échéant « sensible à forte posologie (en association) » peuvent être utilisés.
Enfin, pour certains couples antibiotique-bactérie, l’antibiogramme se limite à établir si la souche est (ou non) sauvage, ou si la souche présente (ou non) un haut niveau de résistance : les libellés « absence de résistance » et « absence de résistance à haut niveau » peuvent alors être respectivement utilisés pour ces deux situations.
Lorsque la catégorisation clinique ne peut pas être établie sans risque d’erreur (résultat en ZIT), différentes formulations sont alors possibles (par exemple « non catégorisé », « CMI sur demande »).
Lorsque les résultats sont fondés uniquement sur les concentrations critiques génériques « PK/PD », voire uniquement sur les ECOFFs, les libellés « utilisation possible » et « utilisation déconseillée » peuvent être utilisés pour nuancer la réponse.
Lorsque des molécules doivent impérativement être utilisées en association, les libellés « sensible à posologie standard (en association) » ou le cas échéant « sensible à forte posologie (en association) » peuvent être utilisés.
Enfin, pour certains couples antibiotique-bactérie, l’antibiogramme se limite à établir si la souche est (ou non) sauvage, ou si la souche présente (ou non) un haut niveau de résistance : les libellés « absence de résistance » et « absence de résistance à haut niveau » peuvent alors être respectivement utilisés pour ces deux situations.
Qu’est-ce qu’une « forte posologie » ?
Ce changement de « catégories cliniques » a un impact important pour le clinicien prescripteur d’antibiotiques, car là où la lecture de l’antibiogramme se résumait essentiellement au choix d’une molécule parmi d’autres, les nouvelles définitions orientent maintenant non seulement le choix de l’antibiotique, mais également la posologie à utiliser.
En effet, le prescripteur doit maintenant connaître les posologies associées aux catégories « sensible à posologie standard » et « sensible à forte posologie ».
Les posologies standard sont habituellement bien connues des prescripteurs et reposent essentiellement sur les données du dossier d’autorisation de mise sur le marché (AMM), les données cliniques d’efficacité et l’historique d’utilisation de la molécule.
En revanche, les posologies répondant à la définition des fortes posologies n’apparaissent pas dans le résumé des caractéristiques du produit (RCP) et sont mal connues des prescripteurs. Ces posologies correspondent aux posologies minimales requises pour que le résultat de catégorisation clinique « sensible à forte posologie » (SFP) obtenu soit valide. Ces posologies sont essentiellement définies sur des paramètres PK/PD.
Pour la plupart des couples antibiotique-bactérie, des études expérimentales in vitro et in vivo (modèles animaux) ainsi que des études cliniques chez l’homme permettent de déterminer les propriétés pharmacocinétiques des antibiotiques, ainsi que les paramètres pharmacodynamiques prédictifs de leur efficacité (temps pendant lequel les concentrations sériques sont supérieures à la CMI [% T > CMI], rapport entre aire sous la courbe des concentrations sériques ou concentration sérique maximale et la CMI [ASC/CMI ou Cmax/CMI]…). Ces données sont ensuite intégrées dans des modélisations mathématiques (simulation de Monte-Carlo) pour extrapoler – à des effectifs très importants –, les résultats obtenus lors des études initiales, inévitablement effectuées avec des populations de faibles effectifs. Ces simulations permettent de calculer, pour chaque CMI d’un antibiotique et pour une posologie donnée, la probabilité d’être en adéquation avec les prérequis PK/PD de cet antibiotique.
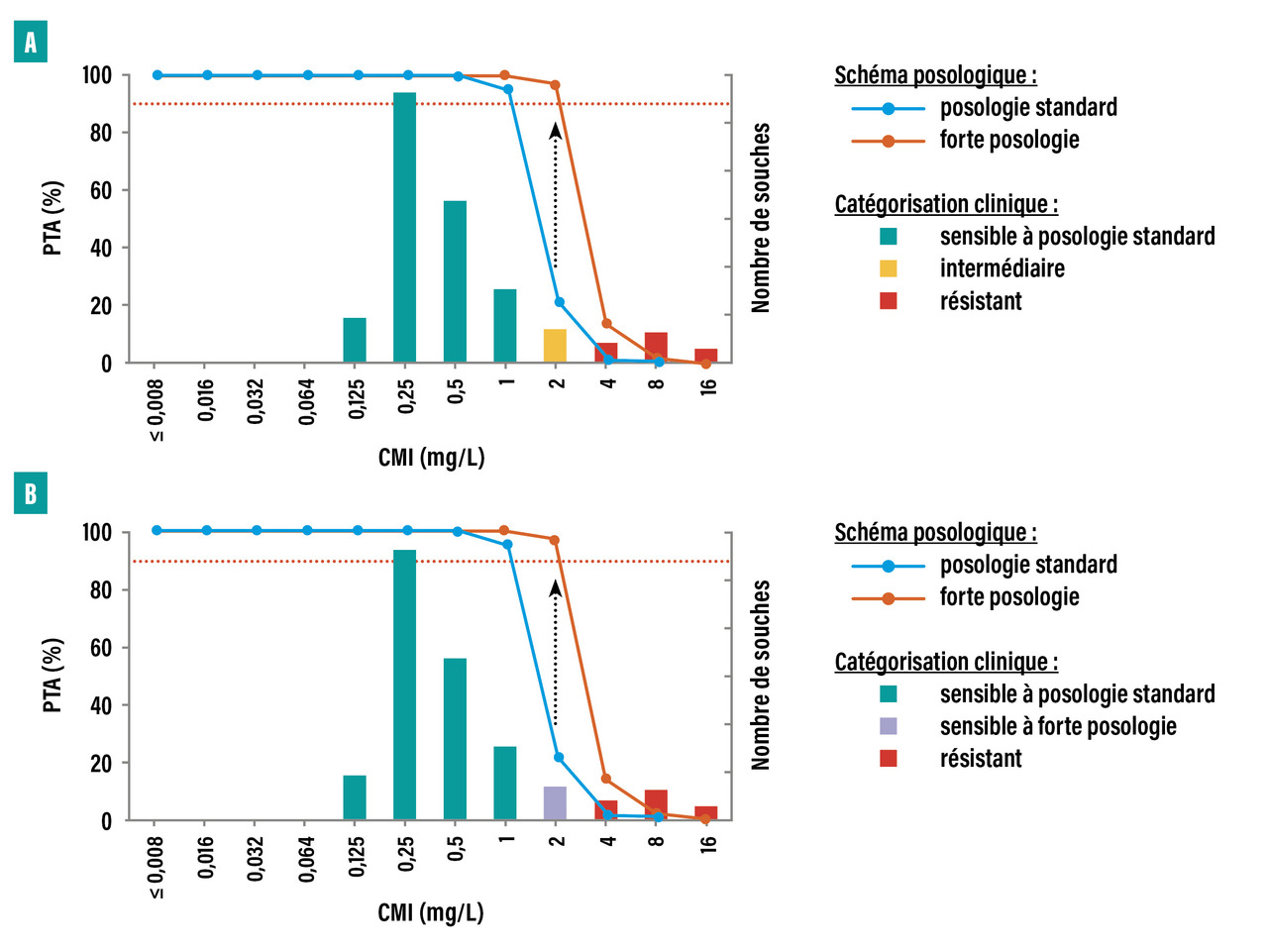
La cible PK/PD peut donc être atteinte pour des CMI plus élevées grâce à une augmentation de la posologie. Cela peut permettre d’atteindre la valeur critique définissant la catégorie SFP (fig. 3). La modulation des modalités d’administration – perfusions prolongées ou perfusions continues (en particulier pour les antibiotiques dont l’efficacité est dite temps-dépendante) – peut également contribuer à atteindre les cibles PK/PD sans augmenter la dose journalière.
L’EUCAST propose un tableau des posologies standard et des fortes posologies. Cependant, un certain nombre de discordances ont pu être observées entre les posologies présentées jusqu’à présent dans ce tableau et les schémas posologiques réellement utilisés en France. Par ailleurs, ce tableau ne proposait que très peu de modalités d’administration différentes.
Un travail conjoint du CA-SFM, de la Société de pathologie infectieuse de langue française (SPILF) et de la Société française de pharmacologie et de thérapeutique (SFPT) a abouti à la création d’un tableau des posologies adapté aux schémas posologiques utilisés en France et en parfaite adéquation avec les concentrations et diamètres critiques. Celui-ci est désormais disponible en annexe du communiqué annuel du CA-SFM2 et disponible sur le site internet de la SPILF.6 Les posologies proposées dans ce tableau s’appliquent aux patients adultes de poids normal (non obèses), hors contexte d’insuffisance rénale ou hépatique. Dans certaines situations (choc septique, neutropénie, endocardite infectieuse, infection du système nerveux central, infection ostéo-articulaire, infection sur matériel prothétique…), des posologies spécifiques peuvent s’appliquer, et les fortes posologies proposées dans le tableau mis à disposition par le CA-SFM constituent une base pour ajuster le schéma de traitement.
En effet, le prescripteur doit maintenant connaître les posologies associées aux catégories « sensible à posologie standard » et « sensible à forte posologie ».
Les posologies standard sont habituellement bien connues des prescripteurs et reposent essentiellement sur les données du dossier d’autorisation de mise sur le marché (AMM), les données cliniques d’efficacité et l’historique d’utilisation de la molécule.
En revanche, les posologies répondant à la définition des fortes posologies n’apparaissent pas dans le résumé des caractéristiques du produit (RCP) et sont mal connues des prescripteurs. Ces posologies correspondent aux posologies minimales requises pour que le résultat de catégorisation clinique « sensible à forte posologie » (SFP) obtenu soit valide. Ces posologies sont essentiellement définies sur des paramètres PK/PD.
Pour la plupart des couples antibiotique-bactérie, des études expérimentales in vitro et in vivo (modèles animaux) ainsi que des études cliniques chez l’homme permettent de déterminer les propriétés pharmacocinétiques des antibiotiques, ainsi que les paramètres pharmacodynamiques prédictifs de leur efficacité (temps pendant lequel les concentrations sériques sont supérieures à la CMI [% T > CMI], rapport entre aire sous la courbe des concentrations sériques ou concentration sérique maximale et la CMI [ASC/CMI ou Cmax/CMI]…). Ces données sont ensuite intégrées dans des modélisations mathématiques (simulation de Monte-Carlo) pour extrapoler – à des effectifs très importants –, les résultats obtenus lors des études initiales, inévitablement effectuées avec des populations de faibles effectifs. Ces simulations permettent de calculer, pour chaque CMI d’un antibiotique et pour une posologie donnée, la probabilité d’être en adéquation avec les prérequis PK/PD de cet antibiotique.
La cible PK/PD peut donc être atteinte pour des CMI plus élevées grâce à une augmentation de la posologie. Cela peut permettre d’atteindre la valeur critique définissant la catégorie SFP (fig. 3). La modulation des modalités d’administration – perfusions prolongées ou perfusions continues (en particulier pour les antibiotiques dont l’efficacité est dite temps-dépendante) – peut également contribuer à atteindre les cibles PK/PD sans augmenter la dose journalière.
L’EUCAST propose un tableau des posologies standard et des fortes posologies. Cependant, un certain nombre de discordances ont pu être observées entre les posologies présentées jusqu’à présent dans ce tableau et les schémas posologiques réellement utilisés en France. Par ailleurs, ce tableau ne proposait que très peu de modalités d’administration différentes.
Un travail conjoint du CA-SFM, de la Société de pathologie infectieuse de langue française (SPILF) et de la Société française de pharmacologie et de thérapeutique (SFPT) a abouti à la création d’un tableau des posologies adapté aux schémas posologiques utilisés en France et en parfaite adéquation avec les concentrations et diamètres critiques. Celui-ci est désormais disponible en annexe du communiqué annuel du CA-SFM2 et disponible sur le site internet de la SPILF.6 Les posologies proposées dans ce tableau s’appliquent aux patients adultes de poids normal (non obèses), hors contexte d’insuffisance rénale ou hépatique. Dans certaines situations (choc septique, neutropénie, endocardite infectieuse, infection du système nerveux central, infection ostéo-articulaire, infection sur matériel prothétique…), des posologies spécifiques peuvent s’appliquer, et les fortes posologies proposées dans le tableau mis à disposition par le CA-SFM constituent une base pour ajuster le schéma de traitement.
Particularités de Pseudomonas et risque de mauvaise compréhension des nouvelles catégories cliniques
Pour un certain nombre de couples antibiotique-bactérie, des posologies élevées sont obligatoirement requises : les valeurs critiques correspondantes sont fixées de manière à « forcer » une catégorisation minimale « sensible à forte posologie ». Pour Pseudomonas, c’est le cas avec la majorité des antibiotiques testés, à l’exception de quelques-uns, dont le méropénème ou les nouvelles associations bêtalactamines-inhibiteurs (ex : ceftolozane-tazobactam, ceftazidime-avibactam). Un rendu « sensible à forte posologie » pour l’ensemble des antibiotiques, à l’exception du méropénème, a pu contribuer à la mise en place de traitements inappropriés par méropénème d’infections à souche sauvage de Pseudomonas.7,8 Le masquage (recommandé par le CA-SFM)2 du méropénème sur les comptes-rendus d’antibiogramme pour les souches sensibles à des bêtalactamines de spectre plus étroit semble efficace pour limiter le risque de mésusage du méropénème.9
Cet exemple souligne l’importance du dialogue entre biologistes et cliniciens, qui doit notamment passer par une expression des résultats parfaitement compréhensible par les cliniciens.
Cet exemple souligne l’importance du dialogue entre biologistes et cliniciens, qui doit notamment passer par une expression des résultats parfaitement compréhensible par les cliniciens.
* Même si l’EUCAST utilise en réalité la terminologie « susceptible, increased exposure », le CA-SFM a fait le choix de ne pas en proposer une traduction littérale, car le concept de « forte exposition » n’est pas explicite pour les cliniciens français. Afin de souligner que « sensible à forte posologie » peut s’appliquer à la posologie standard pour des antibiotiques fortement concentrés au site infectieux en cas d’infection non sévère (cystite par exemple), un commentaire spécifique peut être ajouté sur les comptes rendus d’antibiogramme.
Références
1. European Committee on Antimicrobial Susceptibility Testing (EUCAST) Breakpoint tables, v14.0, 2024. https://www.eucast.org/fileadmin/src/media/PDFs/EUCAST_files/Breakpoint_tables/v_14.0_Breakpoint_Tables.pdf
2. CA-SFM/EUCAST, Société française de microbiologie. Recommandations 2024 du CA-SFM. https://urlz.fr/sdil
3. Mouton JW, Brown DF, Apfalter P, Canton R, Giske CG, Ivanova M, et al. The role of pharmacokinetics/pharmacodynamics in setting clinical MIC breakpoints: The EUCAST approach. Clin Microbiol Infect 2012;18(3):E37-45.
4. Schramm F, Menard C, Jehl F. Les nouvelles catégorisations cliniques et leurs conséquences. La Lettre du Pharmacologue 2021;35(3-4):50-60.
5. Turnidge J, Abbott IJ. EUCAST breakpoint categories and the revised «I»: A stewardship opportunity for «I»mproving outcomes. Clin Microbiol Infect 2022;28(4):475-6.
6. Posologie standard et forte posologie : propositions du groupe de travail SPILF, SFPT & CA-SFM, version 2024 du document https://www.infectiologie.com/UserFiles/File/spilf/recos/doses-spilf-sfpt-casfm-2024.pdf ; pour les futures mises à jour, document accessible sur le site de la Société de pathologie infectieuse de langue française (SPILF) : Recommandations, rubrique « Bon usage des anti-infectieux », Outils d’adaptation des posologies. https://vu.fr/RcqlN
7. Munting A, Regina J, Damas J, Lhopitallier L, Kritikos A, Guery B, et al. Impact of 2020 EUCAST criteria on meropenem prescription for the treatment of Pseudomonas aeruginosa infections: An observational study in a university hospital. Clin Microbiol Infect 2022;28(4):558-63.
8. Ourghanlian C, Fihman V, Morel A, Lafont C, Galy A, Calimouttoupoulle E, et al. Overly broad-spectrum antibiotic treatment of wild-type Pseudomonas aeruginosa infections in relation to the EUCAST new definition of susceptibility testing categories, a retrospective multicentre cohort study. JAC Antimicrob Resist 2022;4(5):dlac099.
9. Munting A, Damas J, Viala B, Prod’hom G, Guery B, Senn L. Impact of selective reporting of antibiotic susceptibility testing results on meropenem prescriptions for the treatment of Pseudomonas aeruginosa infections after 2020 EUCAST criteria update: An observational study in a university hospital. Antimicrob Resist Infect Control 2022;11(1):16
2. CA-SFM/EUCAST, Société française de microbiologie. Recommandations 2024 du CA-SFM. https://urlz.fr/sdil
3. Mouton JW, Brown DF, Apfalter P, Canton R, Giske CG, Ivanova M, et al. The role of pharmacokinetics/pharmacodynamics in setting clinical MIC breakpoints: The EUCAST approach. Clin Microbiol Infect 2012;18(3):E37-45.
4. Schramm F, Menard C, Jehl F. Les nouvelles catégorisations cliniques et leurs conséquences. La Lettre du Pharmacologue 2021;35(3-4):50-60.
5. Turnidge J, Abbott IJ. EUCAST breakpoint categories and the revised «I»: A stewardship opportunity for «I»mproving outcomes. Clin Microbiol Infect 2022;28(4):475-6.
6. Posologie standard et forte posologie : propositions du groupe de travail SPILF, SFPT & CA-SFM, version 2024 du document https://www.infectiologie.com/UserFiles/File/spilf/recos/doses-spilf-sfpt-casfm-2024.pdf ; pour les futures mises à jour, document accessible sur le site de la Société de pathologie infectieuse de langue française (SPILF) : Recommandations, rubrique « Bon usage des anti-infectieux », Outils d’adaptation des posologies. https://vu.fr/RcqlN
7. Munting A, Regina J, Damas J, Lhopitallier L, Kritikos A, Guery B, et al. Impact of 2020 EUCAST criteria on meropenem prescription for the treatment of Pseudomonas aeruginosa infections: An observational study in a university hospital. Clin Microbiol Infect 2022;28(4):558-63.
8. Ourghanlian C, Fihman V, Morel A, Lafont C, Galy A, Calimouttoupoulle E, et al. Overly broad-spectrum antibiotic treatment of wild-type Pseudomonas aeruginosa infections in relation to the EUCAST new definition of susceptibility testing categories, a retrospective multicentre cohort study. JAC Antimicrob Resist 2022;4(5):dlac099.
9. Munting A, Damas J, Viala B, Prod’hom G, Guery B, Senn L. Impact of selective reporting of antibiotic susceptibility testing results on meropenem prescriptions for the treatment of Pseudomonas aeruginosa infections after 2020 EUCAST criteria update: An observational study in a university hospital. Antimicrob Resist Infect Control 2022;11(1):16
Dans cet article
- Techniques d’antibiogramme
- Concentrations minimales inhibitrices et diamètres critiques
- Anciennes catégories cliniques
- Nouvelles catégories cliniques
- Terminologie dans le rendu des résultats
- Qu’est-ce qu’une « forte posologie » ?
- Particularités de Pseudomonas et risque de mauvaise compréhension des nouvelles catégories cliniques