La dysménorrhée, ou douleur lors des règles, est présente à des niveaux d’intensité variable, classés de 0 à 3 selon l’échelle d’Andersch et Milsom (tableau). Si le niveau 0 correspond à des règles non douloureuses sans modification de l’activité quotidienne, le niveau 3 – ou dysménorrhée dite sévère – correspond à une douleur très importante, avec un cortège de symptômes somatiques associés (nausées, vomissements, asthénie, céphalées, diarrhée), un faible effet des antalgiques et une importante altération de la qualité de vie, avec absentéisme scolaire, puis professionnel.
La fréquence de la dysménorrhée (prise globalement, tous niveaux confondus) est très élevée, autour de 80 à 90 % de la population féminine en activité génitale.1 La dysménorrhée sévère, telle que définie par le niveau 3 d’Andersch et Milsom, a une prévalence considérable, autour de 15 à 20 %.2
Liens entre dysménorrhée sévère et endométriose
La dysménorrhée sévère est le symptôme principal de l’endométriose. Lorsque celle-ci est mise en évidence, on parle classiquement de dysménorrhée secondaire.
Pourtant, dans notre pratique, la majorité des femmes atteintes d’endométriose ont commencé par souffrir de dysménorrhée sévère dès leurs premières règles.26,28
Cette dysménorrhée est d’emblée et brutalement sévère, alors que lors de l’apparition des premières règles, l’endométriose n’est pas encore présente.
Cette dysménorrhée sévère primaire de la toute jeune fille pourrait être l’une des clés de la problématique et de la survenue de l’endométriose. En effet, sa constitution et son caractère pathogène pouvant être à l’origine d’une douleur nociceptive nécessitent de nombreux mois, voire années, d’évolution. En effet, nous disposons, depuis une quinzaine d’années, d’un grand nombre de travaux et preuves scientifiques, qui permettent d’établir que les jeunes filles porteuses de dysménorrhées primaires de grade 3, sont en situation d’hypersensibilisation pelvienne.3,12
La dysménorrhée primaire sévère correspond donc à une douleur nociplastique, dans le cadre d’une sensibilisation centrale. En effet, les explorations sont à ce stade négatives, et il s’agit bien d’une douleur viscérale de l’utérus ne présentant aucune lésion.
Il est, par ailleurs, fréquent que s’associent à la dysménorrhée sévère une douleur pelvienne à connotation utérine, avec des sensations de douleurs de règles en dehors des règles, des crampes, voire de véritables crises de contractions utérines, une dyspareunie profonde et une gâchette utérine douloureuse à l’examen gynécologique.
L’absence de reconnaissance comme une véritable pathologie de la dysménorrhée primaire sévère de la jeune fille et l’absence de traitement adapté conduisent à la répétition de transmissions d’influx douloureux et donc à l’aggravation de l’hypersensibilisation pelvienne centrale.
En ce sens, la dysménorrhée primaire sévère constitue pour de nombreux auteurs un précurseur de l’endométriose et de la douleur pelvienne chronique.13
L’hypercontractilité du myomètre utérin est un autre aspect fondamental liant l’endométriose et la dysménorrhée sévère. En effet, de nombreuses publications des vingt dernières années ont démontré que la dysménorrhée sévère s’accompagne d’une hypercontractilité utérine, notamment grâce aux études en mode ciné-IRM.14 - 16 Cette hypercontractilité joue un rôle important dans les mécanismes de la douleur de la dysménorrhée sévère. Son association avec l’hyperpression dans la cavité utérine peut expliquer la diffusion de foyers d’endomètre dans le myomètre, la vascularisation, le péritoine et les espaces sous-péritonéaux.
Ainsi, par l’intermédiaire de l’hypercontractilité utérine et de l’hyperpression dans la cavité utérine, la dysménorrhée sévère pourrait conduire à l’endométriose.
Cependant, aujourd’hui, le facteur inducteur ou facilitant qui expliquerait l’implantation des foyers d’endomètre reste inconnu. En effet, toutes les patientes porteuses de dysménorrhée sévère ne développent pas d’endométriose. De nombreux travaux sont en cours, afin d’identifier ce facteur facilitant.17
Thérapeutiques des dysménorrhées sévères
Le contrôle de la dysménorrhée sévère constitue ainsi un axe majeur de la prise en charge de la douleur pelvienne et peut-être même de la prévention de l’endométriose.
Cela passe par un changement de paradigme et d’approche médicale vis-à-vis de la dysménorrhée de la jeune fille :
- toutes les dysménorrhées ne doivent plus être considérées comme « physiologiques », et le médecin doit être à même de différencier les dysménorrhées dites physiologiques de celles de grade 3 d’Andersch et Milsom (dysménorrhée sévère) ;
- le protocole thérapeutique ne doit pas être minimisé au prétexte du jeune âge de la patiente, bien au contraire.
Ainsi, il ne faut pas hésiter à mettre en place un protocole multimodal, tel que proposé plus loin. À ce titre, l’introduction d’une contraception orale œstroprogestative, instaurant éventuellement une aménorrhée, peut être envisagée. En effet, une pilule minidosée peut réduire le volume des règles et diminuer ainsi l’activité contractile du myomètre. L’induction d’une aménorrhée offre une possibilité de contrôler le niveau de l’hypersensibilisation centrale et donc de diminuer la douleur. Les seuils de la douleur ne sont pas homogènes et subissent une réduction physiologique durant la période des règles.18
Douleurs de l’endométriose : neuropathiques et nociplastiques
Douleurs nociceptives cycliques
Lorsque l’endométriose s’installe s’y ajoutent des phénomènes inflammatoires, compressifs, lésionnels et des mécanismes nociceptifs de la douleur.
On observe ainsi une augmentation de facteurs pro-inflammatoires et de cellules inflammatoires, telles que mastocytes et macrophages, dans le liquide péritonéal et dans les lésions ectopiques des patientes atteintes d’endométriose.19 Ces médiateurs inflammatoires activent les fibres nerveuses viscérales et péritonéales, créant ainsi des douleurs nociceptives, inflammatoires, qui répondent bien aux anti-inflammatoires non stéroïdiens.
Les fibres nerveuses elles-mêmes participent activement à ce mécanisme inflammatoire en sécrétant des neuromédiateurs pro-inflammatoires.
Ces lésions inflammatoires nociceptives ont pour effet de majorer la sensibilisation utérine, entraînant une aggravation des contractions utérines et la dysménorrhée. Celle-ci étant majorée par la production excessive de prostaglandines par les lésions d’endométriose, notamment dans l’adénomyose.
Douleurs chroniques : neuropathiques ou nociplastiques ?
La douleur neuropathique est, par définition, secondaire à une lésion ou à une maladie affectant le système nerveux somatosensoriel périphérique ou central et présente des caractéristiques spécifiques permettant de la dépister.
Il s’agit d’une douleur à type de fourmillements, picotements, piqûres d’aiguille, décharges électriques, engourdissement mais aussi de brûlures, avec des niveaux d’intensité douloureuse souvent sévères. La douleur neuropathique peut être dépistée par le score DN4.20
Ces caractéristiques peuvent ainsi être en lien avec une douleur strictement neuropathique, ou avec une douleur nociplastique, qui résulte d’une altération de la nociception malgré l’absence de preuves évidentes de lésions tissulaires réelles. Ce type de douleur, d’expression neuropathique, est rencontré de manière significative chez les patientes porteuses de dysménorrhée et d’endométriose.21,22
Origine lésionnelle
Si les lésions de l’endométriose sont le plus fréquemment observées au niveau de la sphère gynécologique ou des cloisons la séparant des organes de voisinage, certaines localisations à distance sont observées. Ainsi des lésions à proximité des racines sacrées, du tronc du nerf sciatique ou du plexus hypogastrique ont été décrites. Leur prévalence est faible, comparativement aux autres localisations. Comme pour toute lésion nerveuse, la symptomatologie présente des caractères de systématisation neurologique. La douleur est très rapidement associée à un déficit sensitif et moteur. Bien que peu fréquentes, les localisations les plus souvent rapportées sont les lésions radiculaires des racines sacrées et du nerf sciatique.23,24 Les atteintes du plexus hypogastrique sont plus rares encore, et celle du nerf pudendal du domaine de l’exceptionnel.
Dans cette situation, la douleur neuropathique s’intègre dans un mécanisme nociceptif lésionnel, et la sévérité du ressenti douloureux est souvent corrélée à l’importance de la lésion. Bien que relativement exceptionnel, ce type de lésion ne doit pas être méconnu et recherché attentivement en imagerie par résonance magnétique (IRM), surtout lorsqu’une symptomatologie douloureuse neuropathique présente un caractère de systématisation neurologique et, qui plus est, lorsqu’un déficit sensitif ou moteur est enregistré.
Dans une tentative de rapprocher toute la symptomatologie douloureuse neuropathique de la lésion d’endométriose, certains auteurs25 ont évoqué la possibilité de rattacher certaines douleurs neuropathiques à des microlésions des nerfs périphériques des lésions d’endométriose microscopiques. Mais cette hypothèse de la théorie lésionnelle et du parallélisme entre l’étendue des lésions et l’importance des douleurs est battue en brèche depuis longtemps, dès les travaux de Vercellini en 1996.26 Les publications récentes sont très nombreuses pour confirmer que la sévérité des phénomènes douloureux n’a aucun lien avec l’importance des lésions.27,28
Pour comprendre les douleurs chroniques dans l’endométriose, il faut donc faire appel à un autre mécanisme ; celui-ci pouvant par ailleurs être intriqué avec celui de la douleur nociceptive de type inflammatoire de l’endométriose.
Origine nociplastique par sensibilisation
Aujourd’hui, de nombreuses études robustes confirment que les patientes porteuses de dysménorrhées sévères avec endométriose, qu’elle soit minime ou plus importante, sont en situation d’hypersensibilisation pelvienne centrale, par abaissement des seuils de la douleur, diffusion de la douleur dans le temps et l’espace.3 - 12
Attention au risque d’amalgame entre la douleur neuropathique et la sensibilisation pelvienne ! En effet, parmi les caractéristiques cliniques de la douleur par sensibilisation, il existe une part de douleurs « d’expression » neuropathique (avec DN4 positif) associées à des douleurs viscérales, musculaires, ostéo-articulaires, cutanéo-muqueuses, vasculaires et à des dysfonctions d’organes. Dans le cas de la douleur neuropathique, il y a une lésion localisée sur le nerf qui génère une inflammation locale, une altération de la structure cellulaire et donc de son fonctionnement.
Dans la sensibilisation, le fonctionnement interne de la cellule nerveuse est modifié, sans qu’il y ait de lésion de la fibre, mais en réaction à une sursollicitation la plupart du temps ou à un contexte biopsychosocial favorisant.
Les patientes décrivent, en plus des douleurs de règles ou des douleurs utérines sévères, des douleurs d’expression neuropathiques pelviennes, parfois étendues et surajoutées. Elles rapportent également des douleurs neuropathiques des membres inférieurs ou des pieds, avec des irradiations ne correspondant pas à un territoire neurologique. Les douleurs sont alors souvent permanentes et étendues, persistant même en dehors des épisodes d’inflammation aiguë cyclique des menstruations.
La douleur d’allure neuropathique du vestibule vulvaire a une place à part : elle est reconnue sous le terme de vestibulodynie provoquée (VDP) [lire l’article « Vulvodynies » page 414] et est très fréquente chez les patientes porteuses de dysménorrhée sévère et d’endométriose.29
Lorsque la douleur est décrite avec des caractéristiques neuropathiques mais qu’il n’y a pas d’argument pour une lésion du système neurologique et qu’elle s’associe à d’autres symptômes disproportionnés par rapport aux éléments lésionnels, induits par la diminution des seuils de la sensibilisation pelvienne, le score de Convergences PP (société savante spécialiste des douleurs pelvi-périnéales chroniques) permet d’identifier et confirmer la sensibilisation pelvienne30 (douleurs influencées par le remplissage vésical ou rectal, douleurs post-mictionnelles, post-défécatoires, post-coïtales, allodynies cutanées, point gâchette musculaire pelvien ou périnéal) [se reporter à la figure Score Convergences PP de l’hypersensibilisation pelvienne centrale de l’article « Sensibilisation pelvienne » page 390].
De la même manière, l’association de comorbidités, issues de la sensibilisation périphérique ou centrale, comme le syndrome de l’intestin irritable, le syndrome douloureux vésical, les syndromes myofasciaux, est fréquente dans ce groupe de patientes (voir articles précédents).
Dans certains cas, l’évolution peut se faire vers l’apparition de douleurs plus généralisées des membres, du rachis dorsolombaire, cervical et des épaules, associée à une asthénie sévère, pouvant orienter vers le diagnostic de syndrome polyalgique idiopathique diffus (ou fibromyalgie). La prévalence de la fibromyalgie est plus élevée chez les patientes porteuses d’endométriose.31
Traitements des douleurs de l’endométriose
La prise d’anti-inflammatoires non stéroïdiens (AINS) est efficace sur les douleurs dues à l’endométriose.32 Cependant, la seule prescription d’AINS n’est pas suffisante. Le traitement doit en effet être multimodal afin de limiter l’évolution vers la douleur chronique.
Traitements hormonaux
Si la contraception œstroprogestative n’est pas un antalgique à proprement parler, son apport dans le contrôle de la douleur de l’endométriose est fondamental. Son rôle est tout d’abord de réduire les saignements, afin de diminuer l’activité utérine et contrôler la dysménorrhée, mais aussi de permettre le contrôle de la maladie endométriosique.
L’induction d’une aménorrhée est également un axe thérapeutique majeur. Elle assure en effet le contrôle, la stabilisation et la diminution des lésions endométriosiques, pourvoyeuses de douleurs inflammatoires. Cette aménorrhée peut être obtenue avec une pilule œstroprogestative prise en continu ou un microprogestatif. Le diénogest, progestatif de quatrième génération, est approuvé dans le traitement médical de l’endométriose, avec l’avantage de faibles effets androgéniques, glucocorticoïdes ou minéralocorticoïdes.33
L’induction d’une aménorrhée a également un intérêt dans le contrôle de la douleur chronique, en supprimant les influx nociceptifs mensuels vers les centres, ainsi que des dysménorrhées sévères, et en évitant l’aggravation des phénomènes de sensibilisation centrale de la période des règles.
Traitements de la douleur aiguë
Le traitement des dysménorrhées, indépendamment des traitements hormonaux, fait appel aux antalgiques de palier 1 (AINS et paracétamol) ou dans les formes sévères à ceux de palier 2 (néfopam ou tramadol). Les AINS n’ont en théorie pas d’intérêt dans les douleurs neuropathiques et encore moins dans les douleurs chroniques. Cependant, certains d’entre eux (kétoprofène) présentent un important effet anti-hyperalgésique qui, bien que de courte durée, a une efficacité pendant les crises, en association possible avec le néfopam, dont l’action centrale non opioïde en fait un traitement antalgique adapté.
Si les associations avec le tramadol ou la codéine peuvent être utilisées, les morphiniques de palier 3 ne doivent jamais être prescrits dans cette indication. Les morphiniques aggravent l’hypersensibilisation, alimentant la chronicisation. Dans l’étude de Chiuve, les femmes porteuses d’endométriose sont 2,7 fois plus exposées au risque de dépendance et 4 fois au risque d’overdose.34 ; ils sont donc contre-indiqués.
La littérature a bien montré la dangerosité des prescriptions d’opioïdes chez la femme porteuse d’endométriose.34 Ainsi, leur consommation doit être limitée afin d’éviter les mécanismes d’hypersensibilisation via les récepteurs NMDA. On préfère les molécules de courte durée d’action, afin d’éviter l’activation des récepteurs NMDA. Certaines molécules limitent cette hypersensibilisation (paracétamol ou néfopam). Le tramadol est un cas particulier : son action opioïde agoniste en fait un antalgique puissant, mais il présente un risque d’addiction plus faible que les autres opioïdes et son profil inhibiteur de la recapture de la sérotonine et de la norépinéphrine en font une molécule aux effets voisins des antidépresseurs et notamment de la venlafaxine.35 Il possède donc des effets centraux plutôt favorables sur les mécanismes de l’hypersensibilisation centrale de l’endométriose, utilisables dans la dysménorrhée sévère.
Ainsi, les traitements de la crise douloureuse sont peu nombreux ou contraignants. On retient le néfopam, le kétoprofène et le tramadol, qui peut être utilisé, en tenant compte d’un risque toujours possible d’addiction et en contrôlant les surdosages (risque de crises sérotoninergiques).
Traitements de la douleur chronique
Dans le cadre des douleurs chroniques ou présentes au moins la moitié du temps, un traitement de fond est proposé. Ces douleurs de type neuropathique et nociplastique peuvent être prises en charge par les antiépileptiques et/ou les antidépresseurs à action sur la sensibilisation centrale.36,37 Les antiépileptiques utilisés sont les gabapentinoïdes (prégabaline et gabapentine). Les antidépresseurs les plus utilisés sont l’amitriptyline en première ligne, puis la duloxétine ou la venlafaxine. Les premiers sont préférés dans le cadre de douleurs de type neuropathique. Les seconds dans les douleurs de fond permanentes, douleurs viscérales et en cas de critères d’hypersensibilisation pelvienne centrale.30 Ces traitements sont débutés à faible dosage et augmentés progressivement, chaque semaine en moyenne, à la recherche de la dose optimale. Il n’existe pas de dépendance ni d’accoutumance à ces traitements. Une fois la posologie optimale atteinte, le traitement est poursuivi pendant quatre à six mois, puis la dose est réduite jusqu’à l’arrêt.
Traitements de fond plurimodaux
Physiothérapie
Au-delà du mécanisme physiopathologique nociplastique, inflammatoire et neuropathique, l’ensemble des tissus (musculaires, tendineux et ligamentaires) perd de sa mobilité et alimente la douleur en retour. Cette perte de mobilité, par effet réflexe, est multifactorielle, musculaire par hypertonie, inflammatoire, cicatricielle et adhérentielle après les interventions. C’est à ce titre que les techniques plurimodales corporelles de physiothérapie sont utiles.
Parmi ces approches, certaines bénéficient de nombreuses publications, telles que la rééducation pelvi-périnéale, véritable traitement de fond, en particulier des contractures myofasciales périnéales et pelvi-trochantériennes, dans le contexte de l’hypersensibilisation pelvienne. La rééducation pelvi-périnéale fait donc partie de la prise en charge thérapeutique plurimodale de la douleur de l’endométriose. Il en est de même de l’ostéopathie, l’acupuncture, la pratique physique et sportive, notamment le yoga…38 - 40
Thérapies centrales
Dans la douleur chronique par hypersensibilisation centrale, le cerveau module l’information algique. Il se compose de zones de contrôle de la douleur en opposition aux zones amplifiant le message. L’objectif est donc de stimuler les zones de contrôle au regard de celles qui majorent la douleur. C’est dans cette perspective que la méditation, la sophrologie, l’hypnose, la psychothérapie ou encore les thérapies cognitivo-comportementales et la sexothérapie sont utilisées. Ces techniques inhibent l’intensité du message nociceptif. L’ensemble de ces actions a été visualisé par IRM fonctionnelle. Leur objectif doit être compris par les patientes afin qu’elles y adhérent.
Enfin, il est indispensable de dépister les situations traumatiques, de même que le syndrome de stress post-traumatique, fréquemment observé chez ces patientes (31 à 33 % des cas pour Meltzer-Brody).41 Il en va de même pour l’anxiété et la dépression. Les approches en thérapies cognitivo-comportementales et les thérapies brèves comme l’EMDR (eye movement desensitization and reprocessing, désensibilisation et retraitement par les mouvements oculaires) sont alors particulièrement préconisées.42
Place de la chirurgie
La chirurgie n’a pas d’action directe sur les mécanismes de la douleur chronique dans l’endométriose. Elle est même un facteur de risque d’aggravation en situation d’hypersensibilisation. Mais elle fait partie de l’arsenal des traitements, car elle permet le contrôle des lésions endométriosiques, inflammatoires, évolutives ou importantes, génératrices d’influx nociceptifs vers les centres, sources d’aggravation de la douleur chronique. La balance avantage-inconvénient est appréciée en réunion de concertation pluridisciplinaire (RCP) avant toute indication chirurgicale.
Neurostimulation transcutanée
La transcutaneous electrical nerve stimulation (TENS) s’impose comme l’un des axes principaux du traitement de la douleur de l’endométriose. Elle doit être prescrite dès le début de la prise en charge multimodale.
Elle fonctionne comme antalgique, avec des programmes de contre-stimulation (gate control) et endomorphinique. Son efficacité est validée par de nombreux travaux publiés dans la littérature.43 La TENS doit être prescrite tous les jours, matin et soir en traitement de fond mais également lors des crises. Le site de neurostimulation dépend de la symptomatologie douloureuse, au niveau de la zone ou du viscère douloureux (utérus, vessie, intestin), d’un axe nerveux (racines sacrées, nerf tibial postérieur) ou bien encore d’un syndrome myofascial.
Toxine botulinique
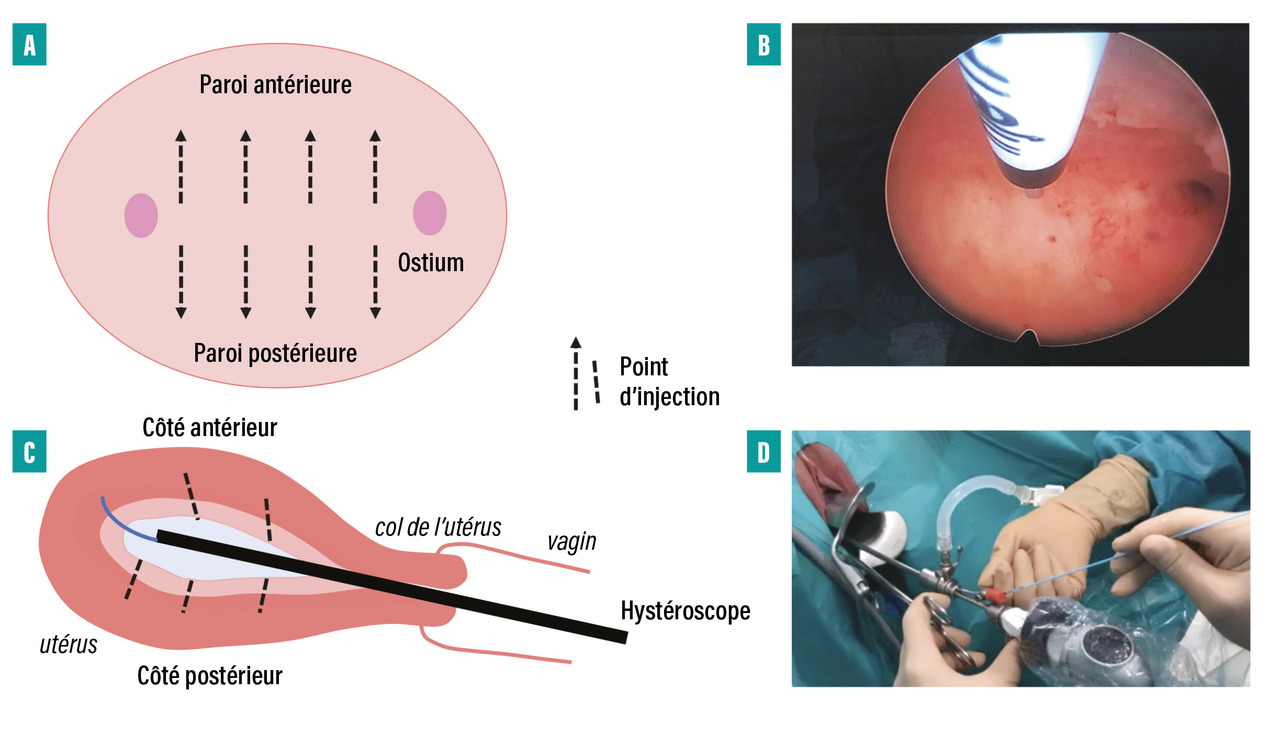
La toxine botulinique présente plusieurs mécanismes d’action : décontraction musculaire bien sûr, mais aussi diminution de l’inflammation neurogène réduisant l’hyperalgésie périphérique et réduction de l’hyperalgésie centrale. Les injections de toxine botulinique dans le myomètre sous hystéroscopie permettent le contrôle de l’hypertonie ou de l’hypercontractilité utérine et annihilent l’information nociceptive durablement. Même si elle n’est pas de première intention, cette technique a montré son intérêt et s’avère très prometteuse dans les dysménorrhées sévères, la douleur pelvienne utérine de l’endométriose, les douleurs myofasciales ou les dyspareunies (figure).44
Salbutamol inhalé
Le salbutamol est un β2 -mimétique qui bloque la contraction musculaire utérine. La présence des récepteurs dans le muscle bronchique explique son effet bien connu dans l’asthme. Son effet sur le myomètre utérin est moins connu, en dehors de la grossesse. À cet égard, le spray de salbutamol peut permettre de contrôler l’hypercontractilité du myomètre utérin lors des dysménorrhées et des crises de contractions utérines. Il est également efficace dans la douleur post-coïtale. Sa tolérance est bonne, avec peu d’effets indésirables. Il n’a pas, pour l’instant, d’autorisation de mise sur le marché dans cette indication, et les études pour cette indication sont en cours.
Cannabidiol
Le cannabidiol a une action sur les récepteurs CB2 (action immunomodulatrice), et le tétrahydrocannabinol a une action sur les récepteurs CB1 (action psychotrope). Le cannabidiol aurait plusieurs effets : antiépileptique (via les systèmes glutamatergiques), anxiolytique (via les récepteurs sérotoninergiques), anti-inflammatoire et myorelaxant.
Ses effets indésirables se rapprochent de ceux des antiépileptiques. Il bénéficie d’une réputation favorable mais sans véritable niveau de preuve, il n’y a pas d’études prouvant son efficacité dans cette indication.
2. Ju H, Jones M, Mishra G. The prevalence and risk factors of dysmenorrhea. Epidemiol Rev 2014;36(1):104-13.
3. Giamberardino MA, Berkley KJ, S Lezzi, et al. Pain threshold variations in somatic wall tissues as a function of menstrual cycle, segmental site and tissue depth in non-dysmenorrheic women, dysmenorrheic women and men. Pain 1997;71(2):187-97.
4. Giamberardino MA, Tana C, Costantini R. Pain thresholds in women with chronic pelvic pain. Curr Opin Obstet Gynecol 2014;26(4):253-9.
5. Iacovides S, Baker FC, Avidon I, et al. Women with dysmenorrhea are hypersensitive to experimental deep muscle pain across the menstrual cycle. J Pain 2013;14(10):1066-76.
6. Iacovides S, Avidon I, Baker FC. What we know about primary dysmenorrhea today: A critical review. Hum Reprod Update 2015;21(6):762-78.
7. Jarrell J, Arendt-Nielsen. Allodynia and dysmenorrhea. J Obstet Gynaecol Can (2016) Mar; 38(3):270-4.
8. Jarrell J, Arendt-Nielsen L. Evolutionary considerations in the development of chronic pelvic pain. Am J Obstet Gynecol 2016;215(2):201-4.
9. Aredo JV, Heyrana KJ, Stratton P. Relating chronic pelvic pain and endometriosis to signs of sensitization and myofascial pain and dysfunction. Semin Reprod Med 2017;35(1):88-97.
10. Payne L, Rapkin AJ, Seidman LJ, et al. Experimental and procedural pain responses in primary dysmenorrhea: A systematic review. J Pain Res 2017;12(10):2233-46.
11. Payne L, Seidman LC, Sim MS, et al. Experimental evaluation of central pain processes in young women with primary dysmenorrhea. Pain 2019;160(6):1421-30.
12. Grundström H, Gerdle G, Alehagen S, et al. Reduced pain thresholds and signs of sensitization in women with persistent pelvic pain and suspected endometriosis. Acta Obstet Gynecol Scand 2019;98(3):327-36.
13. Clemenza S, Vannuccini S, Capezzuoli T, et al. Is primary dysmenorrhea a precursor of future endometriosis development? Gynecol Endocrinol 2021;37(4):287-93.
14. Katoaka M, Togashi K, Kido A, et al. Dysmenorrhea : Evaluation with cine-mode-display MR imaging initial experience. Radiology 2005;235(1):124-31.
15. Guo SW, Mao X, Ma Q, et al. Dysmenorrhea and its severity are associated with increased uterine contractility and overexpression of oxytocin receptor (OTR) in women symptomatic adenomyosis. Fertil Steril 2013;99(1):231-40.
16. Liu S, Zhang Q, Yin C, et al. Optimized approach to cine MRI of uterine peristalsis. J Magn Reson Imaging 2016;44(6):1397-404.
17. Muraoka A, Suzuki M, Hamaguchi T, et al. Fusobacterium infection facilitates the development of endometriosis through the phenotypic transition of endometrial fibroblasts. Sci Transl Med 2023;15(700):eadd1531.
18. Coulombe M-A, Spooner M-F, Marchand S, et al. Estrogen receptors beta and alpha have specific pro- and anti-nociceptive effects. Neuroscience 2011;184:172-82.
19. Bulun SE, Yilmaz BD, Sison C, et al. Endometriosis. Endocr Rev 2019 ;40: 1048-79.
20. Bouhassira D, Attal N, Alchaar H, et al. Comparison of pain syndromes associated with nervous or somatic lesions and development of a new neuropathic pain diagnostic questionnaire (DN4). Pain 2005;114(1-2):29-36.
21. Margueritte F, Afraoucene A, Furdui R, et al. Assessment of neuropathic pain among women with suspected endometriosis based on two specific surveys. Gynecol Obstet Fertil Senol 2023;51(2):111-6.
22. Coxon L, Wiech K, Vincent K. Is there a neuropathic-like component to endometriosis-associated pain? Results from a large cohort questionnaire study. Front Pain Res 2021;2:743812.
23. Possover M, Baekelandt J, Flaskampo C, et al. Laparoscopic neurolysis of the sacral plexus and the sciatic nerve for extensive endometriosis of the pelvic wall. Minim Invasive Neurosurg 2007;50(1):33-6.
24. Roman H, Dehan L, Merlot B, et al. Postoperative outcome after surgery for deep endometriosis of sacral plexus and sciatica nerve: A 52-patients consecutive series. Minim Invasive Gynecol 2021;28(7):1375-83.
25. Fauconnier A, Chapron C. Endometriosis and pelvic pain: Epidemiological evidence of the relationship and implications. Hum Reprod Update 2005;11(6):595-606.
26. Vercellini P, Trespidi L, De Giorgi O, et al. Endometriosis and pelvic pain: Relation to disease stage and localization. Fertil Steril 1996;65(2):299-304.
27. Yosef A, Williams C, Ahmed AG, et al. Multifactorial contributors to the severity of chronic pelvic pain in women. Am J Obstet Gynecol 2016;215(6):760-74.
28. Facchin F, Barbara G, Saita E, et al. Impact of endometriosis on quality of life and mental health: Pelvic pain makes the difference. J Psychosom Obstet Gynaecol 2015;36(4):135-41.
29. Bautrant E, Porta O, Murina F, et al. Provoked vulvar vestibulodynia: Epidemiology in Europe, physio-pathology, consensus for first-line treatment and evaluation of second-line treatments. J Gynecol Obstet Hum Reprod 2019;48:685-8.
30. Levesque A, Riant T, Ploteau S, et al. Clinical criteria of central sensitization in chronic pelvic pain and perineal pain (Convergences PP criteria): Elaboration of a clinical evaluation tool based on formal expert consensus. Pain Medecine 2018;19: 2009-15.
31. Coloma JL, L Quintas, F Carmona, et al. Prevalence of fibromyalgia among women with deep infiltrating endometriosis. Int J Gynecol Obstet 2019;146(2):157-63.
32. Ohayon S. Prise en charge des douleurs liées à l’endométriose par le médecin généraliste : enquête de pratique auprès de médecins généralistes installés en Alsace et en Ile- de- France. Thèse en médecine. Soutenue le 11 mars 2022.
33. Muzii L, Di Tucci C, Galati G, et al. The efficacy od Dienogest in reducing disease and paun recurrence after endometriosis surgery: A systematic review and meta-analysis. Reprod Sci 2023;30:3135-43.
34. Chiuve SE, Kilpatrick RD, Hornstein MD, et al. Chronic opioid use and complication risks in women with endometriosis: A cohorte study in US administrative claims. Pharmacoepidemiol Drug Saf 2021;30(6):787-96.
35. Markowitz JS, Patrick KS. Venlafaxine-tramadol similarities. Med Hypotheses 1998;51(2):167-8.
36. Birkinshaw H, Friedrich CM, Cole P, et al. Antidepresssant for pain management in adults with chronic pain: A network meta-analysis. Cochrane Database Syst Rev 2023;5(5):CD014682.
37. Finnerup NB, Attal N, Haroutounian S, et al. Pharmacotherapy for neuropathic pain in adults: A systematic review and meta-analysis. Lancet Neurol 2015;14(2):162-73.
38. Abril-Coello R, Correyero-León M, Ceballos-Laita L, et al. Benefits of physical therapy in improving quality of life and pain associated with endometriosis: A systematic review and meta-analysis. Int J Gynaecol Obstet 2023;162(1):233-43.
39. Tennfjord MK, Gabrielsen R, Tellum T. Effect of physical activity and exercise on endometriosis-associated symptoms: A systematic review. BMC Womens Health 2021;21(1):355-7.
40. Mikocka-Walus A, Druitt M, O’Shea M, et al. Yoga, cognitive behavioural therapy versus education to improve quality of life and reduce health care costs in people with endometriosis: A randomized controlled trial. BMJ Open 2021;11(8):e046603.
41. Meltzer-Brody S, Leserman J, Zolnoun D, et al. Trauma and post-traumatic stress disorder in women with chronic pelvic pain. Obstet Gynecol 2007;109:902-8.
42. Donatti L, Malvezzi H, Azevedo BC, et al. Cognitive behavioral therapy in endometriosis, psychological based intervention: A systematic review. Rev Bras Gynecol Obstet 2022;44(3):295-303.
43. Guy M, Foucher C, Levesque A, et al. Transcutaneous electrical neurostimulation relieves primary dysmenorrhea: Randomized, double blind clinical study versus placebo. Prog Urol 2022;32(7):487-97.
44. Kouame JM, Levêque C, Siani C, et al. Injections de toxine botulique utérine dans les dysménorrhées sévères, les dyspareunies et les douleurs pelviennes chroniques : Résultats sur la qualité de vie, le niveau de douleur et la consommation médicale. Eur J Obstet Gynecol Reprod Biol 2023;285:164-9.