Les vascularites associées aux anticorps cytoplasmiques antineutrophiles (ANCA : antineutrophil cytoplasmic antibodies) [VAA] sont des vascularites systémiques qui affectent principalement les vaisseaux de petit et moyen calibres.1 Les VAA regroupent trois maladies avec des phénotypes différents : la granulomatose avec polyangéite (GPA), la polyangéite microscopique (PAM) et la granulomatose éosinophilique avec polyangéite (GEPA).
Appréhender l’épidémiologie des VAA est important, pour plusieurs raisons. L’identification de différences en matière d’incidence et de prévalence par zones géographiques permet de soutenir l’hypothèse de facteurs génétiques et environnementaux pouvant influencer la pathogenèse de ces maladies. Une bonne estimation de la prévalence et de l’incidence est également utile pour améliorer l’offre de soins pour ces maladies rares. Enfin, en comprendre les facteurs de risque et les facteurs protecteurs pourrait éventuellement permettre d’améliorer leur prévention ou d’identifier les individus à risque.
L’étude de l’épidémiologie des VAA présente néanmoins plusieurs défis. Tout d’abord, une définition claire et homogène des cas est nécessaire afin de rendre les études comparables. Étant donné leur rareté, déterminer leur incidence et leur prévalence nécessite de grandes populations et des méthodologies statistiques adaptées. Enfin, identifier de potentiels facteurs de risque ou protecteurs nécessite des études épidémiologiques de type cohorte ou cas-témoins mais également de prendre en compte leurs éventuels limites et biais. Au cours des dernières décennies, des progrès considérables ont été réalisés dans le diagnostic des VAA et dans leurs critères de classification, facilitant ainsi les études épidémiologiques. Les conférences de consensus de Chapel Hill de 1994 et de 2012 ont permis de définir chaque type de vascularite, définitions largement utilisées dans les études cliniques.1,2 Par la suite, l’European Medicines Agency (EMA) a développé en 2007 un algorithme simple pour classer les VAA dans les études épidémiologiques.3 Récemment, un effort international de l’American College of Rheumatology (ACR) et de l’European League Against Rheumatism (EULAR) a permis l’élaboration de critères internationaux de classification de chaque type de VAA,4 - 6 ce qui permettra une meilleure harmonisation dans les futures études épidémiologiques.
Incidence en augmentation
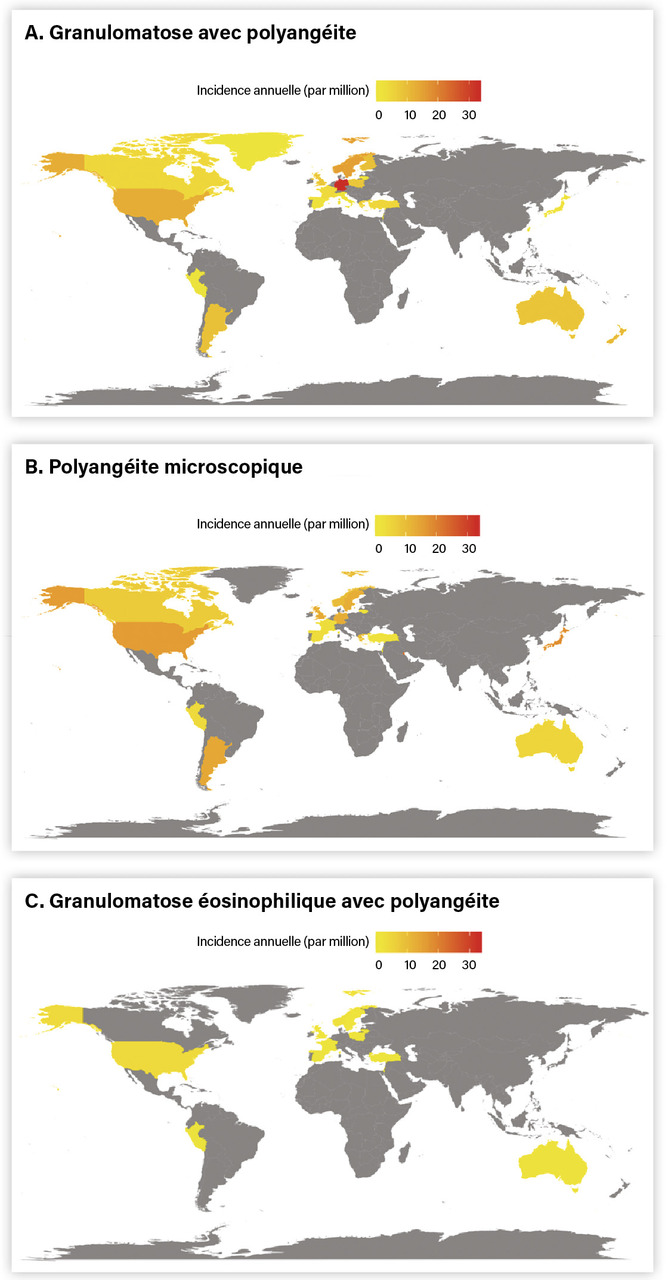
L’incidence mondiale des VAA a été récemment estimée à 17,2 nouveaux cas par million de personnes-années7 (intervalle de confiance [IC] à 95 % : 13,3 - 21,6) avec des grandes variabilités en fonction des études (de 6,2/million en Espagne à 33/million aux États-Unis) [figure et tableau 1]. Néanmoins, il existe très peu de données pour certaines régions du monde, notamment en Afrique ou en Asie (figure).
Parmi les différents sous-types, la GPA est la vascularite la plus fréquente, avec une incidence mondiale de 9 (7,8 - 10,3) par million de personnes-années, versus 5,9 (4,9 - 7) pour la PAM et 1,7 (1,2 - 2,4) pour la GEPA. À titre de comparaison, l’incidence des GPA est plus de quatre fois moindre que celle du lupus érythémateux systémique (estimée à 40 cas par million de personnes-années) ou que celle du syndrome de Gougerot-Sjögren (estimée à environ 50 cas par million de personnes-années).
L’incidence de la VAA semble avoir augmenté au cours des quarante dernières années, avec des incidences passant de 2,7 par million de personnes-années avant 2003 à 10,4 entre 2009 et 2013 pour la PAM en Suède, par exemple.8,9 Néanmoins, cette incidence semble stagner sur les dernières années.10,11 Cette augmentation peut s’expliquer par une amélioration des performances diagnostiques avec l’introduction généralisée du dosage des ANCA dans les années 1990, ainsi que par une meilleure identification des cas suspects de VAA par les cliniciens. De plus, l’application de critères de classification uniformes, bien qu’imparfaits, a permis de mieux classer les maladies. Ainsi, c’est uniquement à partir de la conférence de consensus de Chapel Hill de 1994 que la PAM a été reconnue comme une entité distincte de la périartérite noueuse.1
Outre l’augmentation de l’incidence des VAA, on observe également une augmentation de l’âge au moment du diagnostic. Avant les années 2000, le pic d’incidence des VAA se situait entre 65 et 74 ans au Royaume-Uni,12 alors qu’ensuite le pic d’incidence concernait les patients de plus de 80 ans.
Disparités géographiques et ethniques
Plusieurs études épidémiologiques ont suggéré l’existence d’un gradient d’incidence Nord-Sud de la GPA dans l’hémisphère Nord (et un gradient inverse dans l’hémisphère Sud). Dans l’hémisphère Nord, la GPA semble en effet plus fréquente dans le nord de la Norvège, en Finlande, dans le sud de la Suède, en Allemagne et au Royaume-Uni qu’en Espagne ou en Italie (tableau 1). Dans l’hémisphère Sud, une incidence plus élevée a été observée dans la partie sud que dans la partie nord de la Nouvelle-Zélande. Ceci suggère l’influence d’un facteur environnemental associé à la latitude, comme les ultraviolets ou le climat.
Par ailleurs, l’origine ethnique pourrait être associée à des risques et des phénotypes de VAA différents.14 Dans une étude danoise, Faurshou et al. ont retrouvé des incidences de GPA six fois plus élevées dans les îles Féroé (majoritairement d’ascendance caucasienne) par rapport au Groenland (population inuite).15 Par ailleurs, à la différence des populations européennes, l’incidence des PAM dans la population japonaise et asiatique semble être bien plus importante que celle de la GPA.16 L’incidence des ANCA anti-MPO et les atteintes rénales étaient ainsi plus fréquentes au Japon. Même s’il n’existe presque aucune donnée épidémiologique sur l’incidence des VAA en Afrique, une étude épidémiologique réalisée aux États-Unis a montré que les prévalences de la GPA et de la PAM sont moins élevées dans la population afro-américaine.17 Ces données n’ont cependant pas été confirmées dans la population anglaise.13 Néanmoins, plus récemment, dans la population française vivant dans l’Hérault et le Gard, la prévalence de la PAM semblait plus importante dans la population non caucasienne, en majorité provenant d’Afrique du Nord.18 Ces données d’une même région avec une méthodologie similaire soulignent ainsi l’importance probable des facteurs génétiques dans le risque de VAA.
La prévalence augmente en France
Par rapport aux études d’incidence, il y a relativement moins d’études sur la prévalence de la VAA (tableau 2). Estimer cette prévalence est également sujet à des défis méthodologiques, afin d’assurer l’exhaustivité des cas à un moment donné. Plusieurs études françaises sont fondées sur la méthode de « capture-recapture » utilisant plusieurs sources différentes (hospitalières, médecins de ville, laboratoires, bases administratives) pour évaluer le nombre de cas non détectés. Ceci a récemment permis d’estimer la prévalence en France à environ 100 VAA par million d’habitants (dont 48 GPA, 39 PAM et 16 GEPA) dans le Gard et l’Hérault.18 Des résultats similaires ont été retrouvés en Alsace.19 Cette prévalence est largement supérieure au chiffre de 30,7 par million d’habitants retrouvé en Seine-Saint-Denis dans les années 2000,20 utilisant une méthode similaire, allant dans le sens d’une augmentation de la prévalence des vascularites. Cette tendance peut s’expliquer à la fois par l’amélioration de la définition des cas et de leur identification, et par une amélioration de la prise en charge au cours des dernières décennies, associant des traitements plus efficaces, avec moins d’effets indésirables, permettant une augmentation de la survie.
Facteurs de risque imbriqués
Comme pour d’autres maladies auto-immunes, la cause exacte des VAA reste inconnue. Plusieurs données suggèrent une interaction complexe entre une susceptibilité génétique polygénique, des influences épigénétiques et des déclencheurs environnementaux (tableau 3).
Rôle du terrain génétique
Le rôle du terrain génétique est maintenant établi, grâce à des études d’association à l’échelle du génome (GWAS).21 En effet, dans une étude portant sur 1 233 patients atteints de GPA ou de PAM, et 5 884 contrôles, plusieurs gènes impliquant le complexe majeur d’histocompatibilité ou non étaient associés à la survenue de VAA.21 De surcroît, il y avait plus d’association avec le type d’ANCA (anti-MPO ou anti-PR3) qu’avec le phénotype de la VAA. Ainsi, l’HLA-DP était positivement lié à des vascularites associées aux ANCA anti-PR3, les gènes SERPINA1 (codant pour l’alpha- 1 -antitrypsine) et PRTN3 (codant pour la protéinase 3) étaient protecteurs. Par ailleurs, l’HLA-DQ était associé aux vascularites associées aux ANCA anti-MPO.
Une autre étude de type GWAS, menée sur 676 patients atteints de GEPA et 6 809 témoins sains de neuf pays européens, a identifié au moins quatre gènes associés significativement avec la GEPA, indépendamment du statut ANCA.6 L’association la plus forte était liée au complexe majeur d’histocompatibilité, ce qui confirme l’hypothèse selon laquelle la GEPA est une maladie polygénique. Cette étude a permis de différencier deux sous-catégories sur le plan génétique et clinique, en fonction de la positivité des ANCA, avec des génotypes distincts. Par rapport à la population générale, les GEPA associées à des ANCA de type anti-MPO étaient liées à HLA-DQ, tout comme l’étude concernant les PAM, alors que les GEPA à ANCA négatifs étaient associées à l’expression des gènes GPA33 et IRF1/IL5.30 Ces résultats confortent l’idée de physiopathologies différentes pour les GEPA associées aux ANCA anti-MPO et les GEPA avec ANCA négatifs, et suggèrent des cibles thérapeutiques différentes en fonction du phénotype, notamment les anticorps monoclonaux anti-IL- 5.
Rôle de l’environnement
Plusieurs études suggèrent un lien entre l’environnement et le risque de VAA, notamment en ce qui concerne l’exposition à des facteurs inhalés ou à la poussière.23
L’exposition à la silice est déjà associée à une augmentation de plusieurs maladies auto-immunes, dont la polyarthrite rhumatoïde ou la sclérodermie systémique. Plusieurs études ont montré qu’une exposition prolongée à la silice dans un environnement professionnel entraîne un risque significativement accru de positivité des ANCA.24 Une méta-analyse portant sur six études cas-témoins a montré que l’exposition à la silice était associée à 2,5 fois plus de risque d’avoir une VAA.
Le mécanisme par lequel la silice déclenche la VAA n’a pas encore été entièrement élucidé. Elle stimulerait une réaction inflammatoire en accélérant l’apoptose des neutrophiles et des macrophages alvéolaires de manière dose-dépendante.25 La MPO libérée par les neutrophiles serait absorbée par les macrophages alvéolaires activés et présentée aux lymphocytes T et B, entraînant le développement d’ANCA anti-MPO et une réponse immunitaire déréglée chez un individu génétiquement prédisposé.
Le sable, le sol et les roches sont riches en silice sous sa forme cristalline, et, par conséquent, les travailleurs exerçant des « métiers poussiéreux » peuvent être exposés lorsqu’ils manipulent des matières premières. Ainsi, dans une étude française, la profession la plus couramment associée à l’exposition à la silice dans un groupe français ANCA-positif était la maçonnerie.26 Parmi les autres professions à risque peuvent être cités l’agriculture, le travail dans les usines et le textile ainsi que les travaux de construction poussiéreux. Plus récemment, une étude géo-épidémiologique alsacienne a montré une corrélation entre les carrières et les nouveaux cas de VAA.19 Enfin, le rôle de la silice et autres poussières environnementales est étayé par une augmentation de l’incidence des VAA, notamment associée aux ANCA anti-MPO, dans les années qui ont suivi trois tremblements de terre en 2014 dans la province du Yunnan en Chine, en 2011 à l’est du Japon ou encore en 1995 en Corée. De manière intéressante, les cas de VAA diagnostiqués après le tremblement de terre de Kobe en 1995 comportaient plus d’atteintes respiratoires et un phénotype plus sévère, notamment rénal. De même, l’incidence des VAA anti-MPO a doublé après un tremblement de terre en 2011 dans l’est du Japon, avec un phénotype plus sévère, et des concentrations de silice plus élevées dans le lavage broncho-alvéolaire qu’avant le tremblement de terre.27
Plusieurs autres études, parfois contradictoires, ont mis en évidence des liens entre d’autres polluants et le risque de VAA. Dans une étude cas-témoins néo-zélandaise, Stamp et al. ont montré que l’exposition à la poussière, aux composés chimiques et aux fumées de pétrole était associée à plus de GPA, avec des odds ratio (OR) allant de 3,1 à 5,3.28 Des études sur l’exposition aux solvants organiques ont retrouvé des résultats contradictoires. En outre, en Chine, Li et al. ont observé qu’une exposition au monoxyde de carbone (CO) était associée à un sur-risque de VAA (alors que d’autres polluants, notamment les particules PM2,5 et PM10 ou d’autres particules n’y étaient pas associés).29
Par ailleurs, plusieurs études ont retrouvé un lien entre l’agriculture, le milieu rural et le risque de VAA, sous-entendant un lien avec les nombreux antigènes inhalés provenant du sol, de la poussière, des animaux et des pesticides, en particulier chez les GPA. Un surrisque de GPA associé au jardinage étaye également l’hypothèse selon laquelle les antigènes inhalés provenant du sol pourraient jouer un rôle.28 Il est possible que d’autres facteurs environnementaux, notamment agricoles, soient impliqués, mais ils n’ont pas été suffisamment étudiés.
Concernant la GEPA, de nombreux facteurs environnementaux impliqués dans la pathogenèse ont été décrits : inhalation d’antigènes (fumées de diesel foncé, poussière de grain ou de céréales…), désensibilisation ou vaccination ; mais ces facteurs semblent davantage associés à l’exacerbation des symptômes chez les patients dont la GEPA est déjà présente mais non diagnostiquée, plutôt qu’une cause de la maladie.
Rôle des infections
Certains arguments plaident pour le rôle d’un facteur environnemental, pouvant être infectieux, dans la survenue des VAA. Notamment, celle-ci a pu être associée à une forte saisonnalité,29 malgré une inconsistance de la saison associée à la maladie selon les études.
Une étude cas-témoins suédoise portant sur 270 patients atteints de VAA et 2 687 contrôles a montré que les patients atteints de vascularites associées aux anti-MPO avaient près de deux fois plus de risque d’avoir une infection pulmonaire avant le diagnostic de la maladie.30 Néanmoins, un biais de causalité inverse ne peut pas être exclu.
Plusieurs agents infectieux ont ainsi été évoqués comme facteurs de risque ou déclenchants. Le portage intranasal de Staphylococcus aureus est le plus fréquent d’entre eux. En effet, il a été identifié à plusieurs reprises comme facteur de risque indépendant de rechute de GPA. Popa et al.31 ont montré, grâce à une cohorte rétrospective longitudinale, que plus de 70 % des patients atteints de GPA et porteurs de Staphylococcus aureus l’étaient d’au moins une souche exprimant un superantigène, mécanisme potentiellement imputable pour le déclenchement de la réponse immune. L’efficacité supposée du cotrimoxazole en prévention des rechutes de GPA pourrait ainsi être expliquée par la réduction d’un tel portage, bien que l’absence de prélèvements nasaux pour l’évaluer lors de cette étude ne permette pas de l’affirmer. Le rôle de certaines bactéries à Gram négatif (Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis) a été soulevé par une équipe autrichienne, qui a mis en évidence une réaction immunitaire croisée entre une adhésine bactérienne (FimH) et un antigène membranaire des cellules endothéliales (hLAMP2, human lysosome-associated membrane protein- 2) et l’existence d’auto-anticorps dirigés contre LAMP2 entre 80 et 91 % des patients atteints de vascularite à ANCA.32,33
Certains virus sont également suspectés d’être associés à la survenue de vascularites à ANCA, avec cependant des données très limitées, ne permettant pas de conclure formellement à un tel lien. On peut citer le virus d’Epstein-Barr (EBV) dont plusieurs cas ont été rapportés, avec survenue d’une PAM post-primo-infection ou réactivation d’EBV et pour lequel Lidar et al.34 observaient une surexpression d’IgG « anti-viral capsid antigen » et « anti-EBV early antigen » chez des sujets atteints de vascularite associée aux ANCA, en comparaison à des contrôles sains. Plus récemment, un certain nombre de cas pédiatriques et une revue35 faisant état d’une vascularite associée aux ANCA dans les suites d’une infection par le SARS-CoV- 2 ont été publiés ; la majorité des diagnostics étaient concomitants à l’infection virale ; le délai variait pour les autres cas de vingt-cinq jours à six mois.
Rôle des médicaments
Les VAA induites par les médicaments constituent un petit sous-groupe n’ayant pas encore de définition précise mais qui représentent probablement une entité distincte. Les médicaments ayant été incriminés sont l’hydralazine, l’allopurinol, les antithyroïdiens de synthèse comme le propylthiouracile ou le méthimazole, la phénothiazine, la minocycline, la D-pénicillamine, le lorazépam, le lévamisole, l’isoniazide, l’erlotinib ou encore le tofacitinib.23 La cocaïne a également été mise en cause. La plupart de ces médicaments ont des effets épigénétiques puissants (par exemple, l’hypométhylation), ce qui entraîne une modification de l’expression des gènes ; il s’agit probablement du mécanisme par lequel ils induisent l’auto-immunité.
Bien que rares, les vascularites induites par les antithyroïdiens de synthèse (ATS) sont les mieux documentées. Dans une série internationale récente de 45 patients, Culerrier et al. ont montré que ces vascularites induites par les ATS étaient majoritairement associées à des ANCA de type anti-MPO, seuls (47 %) ou en association avec des ANCA anti-PR3 (33 %), et que le phénotype était essentiellement de type PAM.36 Elles étaient de bon pronostic, car toutes étaient en rémission après arrêt du traitement antithyroïdien ou traitement par corticoïdes avec ou sans immunosuppresseur. De plus, comparées à des PAM non induites par les médicaments, ces vascularites survenaient à un âge plus jeune (48 ans vs 65 ans) et avaient moins d’atteinte rénale (38 vs 73 %) et un moindre risque de rechute (hazard ratio : 0,07 ; IC 95 % : 0,01 - 0,65).
Concernant la GEPA, certains médicaments, principalement les antagonistes des récepteurs des leucotriènes tels que le montélukast, ou plus récemment les anticorps anti-IgE comme l’omalizumab, suscitent encore des inquiétudes. Cependant, ces médicaments étant indiqués dans le traitement de l’asthme à visée d’épargne cortisonique, il existe un fort risque de causalité inverse, et leur rôle dans la pathogénie de la GEPA reste incertain.37,38
Vers de nouveaux critères de classification
Les VAA sont des maladies rares, dont l’incidence et la prévalence semblent être en augmentation sur les dernières décennies, suggérant une meilleure connaissance de ces maladies, ainsi qu’une amélioration de leur prise en charge.
Plusieurs études ont identifié des facteurs de risque génétique mais également environnementaux, comme l’exposition à la silice, aux poussières, ou encore certaines infections et médicaments à risque dans le développement des VAA. Il faut néanmoins considérer les problématiques méthodologiques, telles que les classifications, les biais de causalité inverse ou de mémorisation, avant d’en affirmer la causalité. De nouveaux critères de classification permettront à l’avenir une meilleure comparabilité et reproductibilité des futures études.
2. Jennette JC, Falk RJ, Andrassy K, et al. Nomenclature of systemic vasculitides. Arthritis & Rheumatism 1994;37:187-92.
3. Watts R, Lane S, Hanslik T, et al. Development and validation of a consensus methodology for the classification of the ANCA-associated vasculitides and polyarteritis nodosa for epidemiological studies. Ann Rheum Dis 2007;66:222-7.
4. Robson JC, Grayson PC, Ponte C, et al. 2022 American College of Rheumatology/European Alliance of Associations for Rheumatology classification criteria for granulomatosis with polyangiitis. Ann Rheum Dis 2022;81:315-20.
5. Suppiah R, Robson JC, Grayson PC, et al. 2022 American College of Rheumatology/European Alliance of Associations for Rheumatology classification criteria for microscopic polyangiitis. Ann Rheum Dis 2022;81:321-6.
6. Grayson PC, Ponte C, Suppiah R, et al. 2022 American College of Rheumatology/European Alliance of Associations for Rheumatology classification criteria for eosinophilic granulomatosis with polyangiitis. Ann Rheum Dis 2022;81:309–14.
7. Redondo-Rodriguez R, Mena-Vázquez N, Cabezas-Lucena AM, et al. Systematic review and metaanalysis of worldwide incidence and prevalence of antineutrophil cytoplasmic antibody (ANCA) associated vasculitis. Journal of Clinical Medicine 2022;11:2573.
8. Nilsen AT, Karlsen C, Bakland G, et al. Increasing incidence and prevalence of ANCA-associated vasculitis in Northern Norway. Rheumatology 2020;59:2316-24.
9. Takala JH, Kautiainen H, Malmberg H, et al. Incidence of Wegener’s granulomatosis in Finland 1981-2000. Clin Exp Rheumatol 2008;26:S81-85.
10. Hellmich B, Lamprecht P, Spearpoint P, et al. New insights into the epidemiology of ANCA-associated vasculitides in Germany: results from a claims data study. Rheumatology 2021;60:4868-73.
11. Bataille PM, Durel C-A, Chauveau D, et al. Epidemiology of granulomatosis with polyangiitis and microscopic polyangiitis in adults in France. J Autoimmun 2022;133:102910.
12. Watts RA, Lane SE, Scott DG, et al. Epidemiology of vasculitis in Europe. Ann Rheum Dis 2001;60:1156-7.
13. Pearce FA, Lanyon PC, Grainge MJ, et al. Incidence of ANCA-associated vasculitis in a UK mixed ethnicity population. Rheumatology 2016;55:1656-63
14. Hellmich B. Epidemiology of ANCA-associated vasculitis: Does ancestry play a role? Rheumatology 2023:kead652.
15. Faurschou M, Helleberg M, Obel N, et al. Incidence of granulomatosis with polyangiitis (Wegener’s) in Greenland and the Faroe Islands: Epidemiology of an ANCA-associated vasculitic syndrome in two ethnically distinct populations in the North Atlantic area. Clin Exp Rheumatol 2013;31:S52-55.
16. Fujimoto S, Watts RA, Kobayashi S, et al. Comparison of the epidemiology of anti-neutrophil cytoplasmic antibody-associated vasculitis between Japan and the UK. Rheumatology (Oxford) 2011;50:1916-20.
17. Cao Y, Schmitz JL, Yang J, et al. DRB1*15 allele is a risk factor for PR3-ANCA disease in African Americans. J Am Soc Nephrol 2011;22:1161-7.
18. Rubenstein E, Henneton P, Rivière S, et al. Prevalence of anti-neutrophil cytoplasmic antibody-associated vasculitis in the south of France, using the capture-recapture method. Rheumatology (Oxford) 2023:kead557.
19. Giorgiutti S, Dieudonne Y, Hinschberger O, et al. Prevalence of antineutrophil cytoplasmic antibody–associated vasculitis and spatial association with quarries in a region of Northeastern France: A Capture-recapture and geospatial analysis. Arthritis & Rheumatology 2021;73:2078-85.
20. Mahr A, Guillevin L, Poissonnet M, et al. Prevalences of polyarteritis nodosa, microscopic polyangiitis, Wegener’s granulomatosis, and Churg-Strauss syndrome in a French urban multiethnic population in 2000: A capture-recapture estimate. Arthritis Rheum 2004;51:92-9.
21. Lyons PA, Rayner TF, Trivedi S, et al. Genetically distinct subsets within ANCA-associated vasculitis. N Engl J Med 2012;367:214-23.
22. Lyons PA, Peters JE, Alberici F, et al. Genome-wide association study of eosinophilic granulomatosis with polyangiitis reveals genomic loci stratified by ANCA status. Nat Commun 2019;10:5120.
23. Scott J, Hartnett J, Mockler D, et al. Environmental risk factors associated with ANCA associated vasculitis: A systematic mapping review. Autoimmunity Reviews 2020;19:102660.
24. Gómez-Puerta JA, Gedmintas L, Costenbader KH. The association between silica exposure and development of ANCA-associated vasculitis: Systematic review and meta-analysis. Autoimmunity Reviews 2013;12:1129-35.
25. Leigh J, Wang H, Bonin A, et al. Silica-induced apoptosis in alveolar and granulomatous cells in vivo. Environmental Health Perspectives 1997;105:1241-5.
26. Beaudreuil S, Lasfargues G, Laueriere L, et al. Occupational exposure in ANCA-positive patients: A case-control study. Kidney International 2005;67:1961-6.
27. Takeuchi Y, Saito A, Ojima Y, et al. The influence of the Great East Japan earthquake on microscopic polyangiitis: A retrospective observational study. PLOS ONE 2017;12:e0177482.
28. Stamp LK, Chapman PT, Francis J, et al. Association between environmental exposures and granulomatosis with polyangiitis in Canterbury, New Zealand. Arthritis Research & Therapy 2015;17:333.
29. Li J, Cui Z, Long J, et al. The frequency of ANCA-associated vasculitis in a national database of hospitalized patients in China. Arthritis Research & Therapy 2018;20:226.
30. Rathmann J, Stamatis P, Jönsson G, et al. Infection is associated with increased risk of MPO- but not PR3-ANCA-associated vasculitis. Rheumatology 2022;61:4817-26.
31. Popa ER, Stegeman CA, Abdulahad WH, et al. Staphylococcal toxic-shock-syndrome-toxin-1 as a risk factor for disease relapse in Wegener’s granulomatosis. Rheumatology (Oxford) 2007;46:1029-33.
32. Kain R, Exner M, Brandes R, et al. Molecular mimicry in pauci-immune focal necrotizing glomerulonephritis. Nat Med 2008;14:1088-96.
33. Kain R, Tadema H, McKinney EF, et al. High prevalence of autoantibodies to hLAMP-2 in anti-neutrophil cytoplasmic antibody-associated vasculitis. J Am Soc Nephrol 2012;23:556-66.
34. Lidar M, Lipschitz N, Langevitz P, et al. Infectious serologies and autoantibodies in Wegener’s granulomatosis and other vasculitides: Novel associations disclosed using the Rad BioPlex 2200. Ann N Y Acad Sci 2009;1173:649-57.
35. Ozcan S, Sonmez O, Karaca C, et al. ANCA-associated vasculitis flare might be provoked by Covid-19 infection: A case report and a review of the literature. Clin Kidney J 2022;15:1987-95.
36. Culerrier J, Nguyen Y, Karadag O, et al. Characteristics and outcome of ANCA-associated vasculitides induced by anti-thyroid drugs: A multicenter retrospective case-control study. Rheumatology (Oxford) 2023:kead319.
37. Hauser T, Mahr A, Metzler C, et al. The leucotriene receptor antagonist montelukast and the risk of Churg-Strauss syndrome: A case–crossover study. Thorax 2008;63:677-82.
38. Wechsler ME, Finn D, Gunawardena D, et al. Churg-Strauss syndrome in patients receiving montelukast as treatment for asthma. CHEST 2000;117:708-13.