Le traitement des patients atteints de vascularite associée aux anticorps anticytoplasme des polynucléaires neutrophiles (antineutrophil cytoplasm antibody-associated [ANCA]) repose sur un traitement d’induction, qui permet d’obtenir une rémission dans plus de 80 % des cas en trois à six mois, suivi d’un traitement d’entretien pour prévenir les rechutes, qui restent fréquentes.1 - 5
Au cours des deux dernières décennies, la prise en charge thérapeutique a progressivement évolué vers une meilleure adéquation entre la situation clinique du patient et la stratégie thérapeutique proposée.
Les traitements d’induction ont ainsi été différenciés selon la classification de la vascularite, sa sévérité appréciée sur des critères de gravité (encadré), l’existence de rechutes antérieures, le terrain, avec ses comorbidités, ainsi que la situation sanitaire.
Les traitements d’entretien se sont aussi adaptés à la probabilité de rechute pour améliorer leur rapport bénéfice/risque.
Ces avancées ont transformé le pronostic de ces vascularites. Elles ont permis de se concentrer sur les traitements associés pour prévenir les infections, diminuer les complications cardiovasculaires, l’ostéoporose cortico-induite et les autres complications tardives qui impactent la qualité de vie. Enfin, l’éducation thérapeutique est venue enrichir l’arsenal, en permettant aux patients de mieux participer à leur prise en charge.
Traitement selon la classification
Granulomatose avec polyangéite et polyangéite microscopique sévère
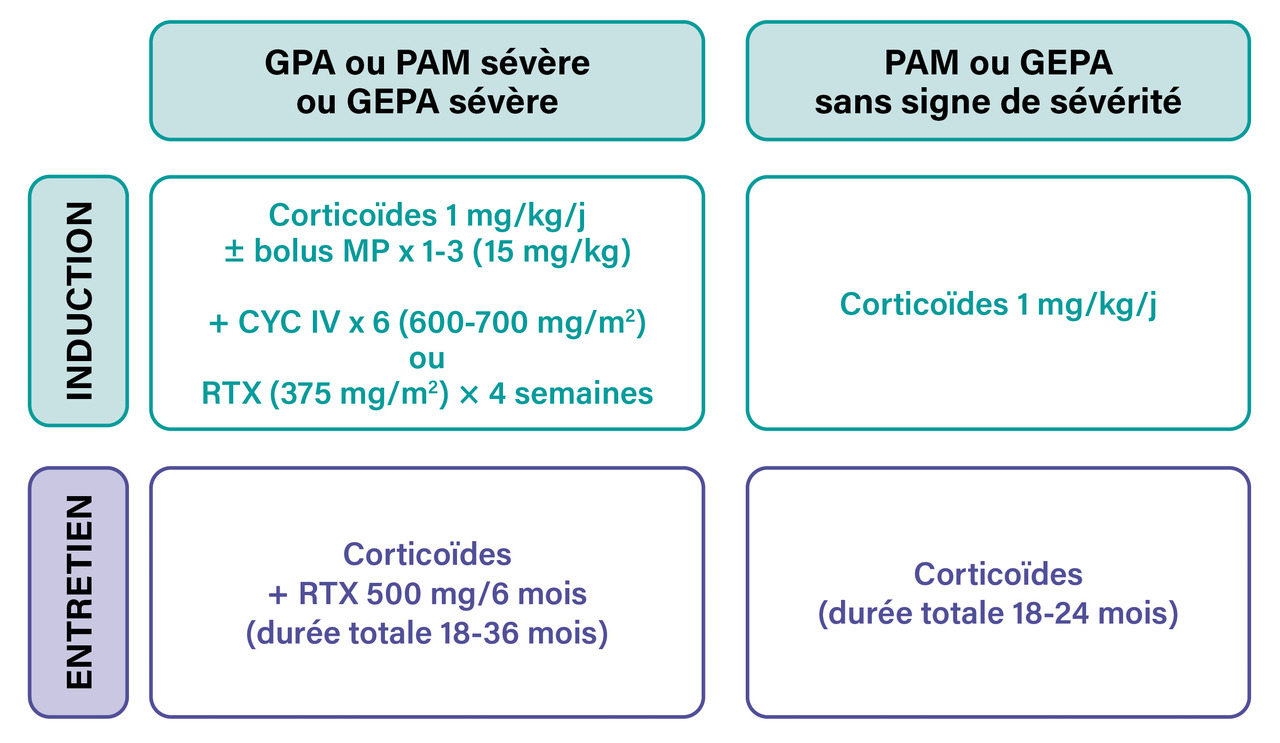
Au cours de la granulomatose avec polyangéite (GPA) et de la polyangéite microscopique (PAM) sévère, le traitement d’induction repose sur la corticothérapie (1 mg/kg/j) associée aux perfusions de cyclophosphamide (six perfusions en trois mois et demi) ou de rituximab (quatre perfusions hebdomadaires de 375 mg/m2) [fig. 1].2 Une étude pivot américaine a permis au rituximab d’obtenir une autorisation de mise sur le marché (AMM) dans ces vascularites.6 Le rituximab est préféré au cyclophosphamide chez les patients en rechute ainsi que chez ceux atteints de GPA où il s’est montré supérieur,6,7 mais aussi chez la femme en âge de procréer ou chez les patients ayant une contre-indication relative au cyclophosphamide.
Le traitement d’entretien repose ensuite sur des perfusions semestrielles de faibles doses de rituximab (500 mg), qui ont significativement montré une diminution la probabilité de rechute par rapport à l’immunosuppression conventionnelle, avec une tolérance satisfaisante.8 L’étude du Groupe français d’étude des vascularites (GFEV) a ainsi permis l’obtention d’une extension d’AMM pour ce traitement biologique en traitement d’entretien.
La durée du traitement d’entretien par le rituximab dépend de la probabilité de rechute et de la situation épidémique. Le traitement est recommandé pendant dix-huit mois pour tous les patients.2,8,9 Ceux qui ont une forte probabilité de rechute et une bonne tolérance du traitement d’entretien peuvent recevoir dix-huit mois supplémentaires de traitement par le rituximab.10 Comme le rituximab expose à une plus grande prévalence d’infections SARS-CoV- 2, et notamment de formes sévères, et diminue fortement l’efficacité vaccinale,11,12 ces schémas doivent être adaptés individuellement, et des recommandations de prise en charge ont été édictées.13
Granulomatose avec polyangéite non systémique
Parmi les patients atteints de GPA, 10 % ont une forme localisée (essentiellement ORL sans signes généraux ni atteinte rénale).14 En association avec la corticothérapie, un traitement par le méthotrexate (jusqu’à 0,3 mg/kg/semaine) peut être proposé et permettre l’obtention d’une rémission.2,4 Le suivi est important car deux tiers de ces patients présentent une progression de la vascularite en dix-huit mois, qui conduit habituellement à une intensification thérapeutique.14
Polyangéite microscopique non sévère
Puisque les trois quarts des patients avec PAM ont une atteinte rénale,15 le pourcentage de patients sans forme sévère est faible. Chez ces patients, une corticothérapie isolée en première intention peut permettre de contrôler la maladie sans impacter la survie16, mais une surveillance est alors de mise. En effet, plus de deux tiers des patients présentent au moins une rechute de la vascularite,16 et certaines équipes proposent donc l’adjonction du rituximab d’emblée, même si ce traitement biologique n’a pas été évalué spécifiquement dans cette population.
Granulomatose éosinophilique avec polyangéite
Pour la granulomatose éosinophilique avec polyangéite (GEPA) avec vascularite active sans critère de sévérité, il existe un consensus pour traiter les patients par une corticothérapie isolée en première intention.2 L’adjonction d’azathioprine17 ou de rituximab18 n’est pas bénéfique.
Pour le traitement d’induction des formes sévères de vascularite, un essai thérapeutique du GFEV a comparé le cyclophosphamide au rituximab sans mettre en évidence de différence.18
L’interleukine 5 (IL- 5) régule la prolifération, la maturation et la différenciation des éosinophiles, et est présente à des taux élevés chez les patients atteints de GEPA. Les traitements inhibant l’IL- 5 auraient peut-être ainsi une place en phase d’induction sur les manifestations de vascularite de la GEPA, en association avec la corticothérapie,4 mais elle n’est pas documentée actuellement. C’est la raison pour laquelle l’essai E-MERGE, mené par le GFEV, évalue actuellement le mépolizumab dans cette indication.19
Pour le traitement d’entretien, les résultats d’un essai thérapeutique du GFEV comparant le rituximab à l’azathioprine seront disponibles fin 2025.20
Une fois la vascularite en rémission, il convient de différencier les rechutes de la vascularite, qui surviennent surtout au cours des deux premières années d’évolution, des exacerbations d’asthme et de manifestations rhino-sinusiennes qui persistent dans le temps et sont souvent corticodépendantes.21,22 Un essai randomisé contrôlé a montré un effet d’épargne des corticoïdes du mépolizumab chez des patients atteints de GEPA, qui présentaient essentiellement des exacerbations d’asthme et de manifestations rhino-sinusiennes itératives nécessitant une corticothérapie au long cours.23 Ce traitement inhibant l’IL- 5 a ainsi obtenu une AMM dans cette vascularite. D’autres sont en cours d’évaluation, et le benralizumab, dirigé contre le récepteur de l’IL- 5, vient de démontrer sa non-infériorité par rapport au mépolizumab, avec un profil de tolérance comparable et satisfaisant.24
Diminution des doses de corticoïdes
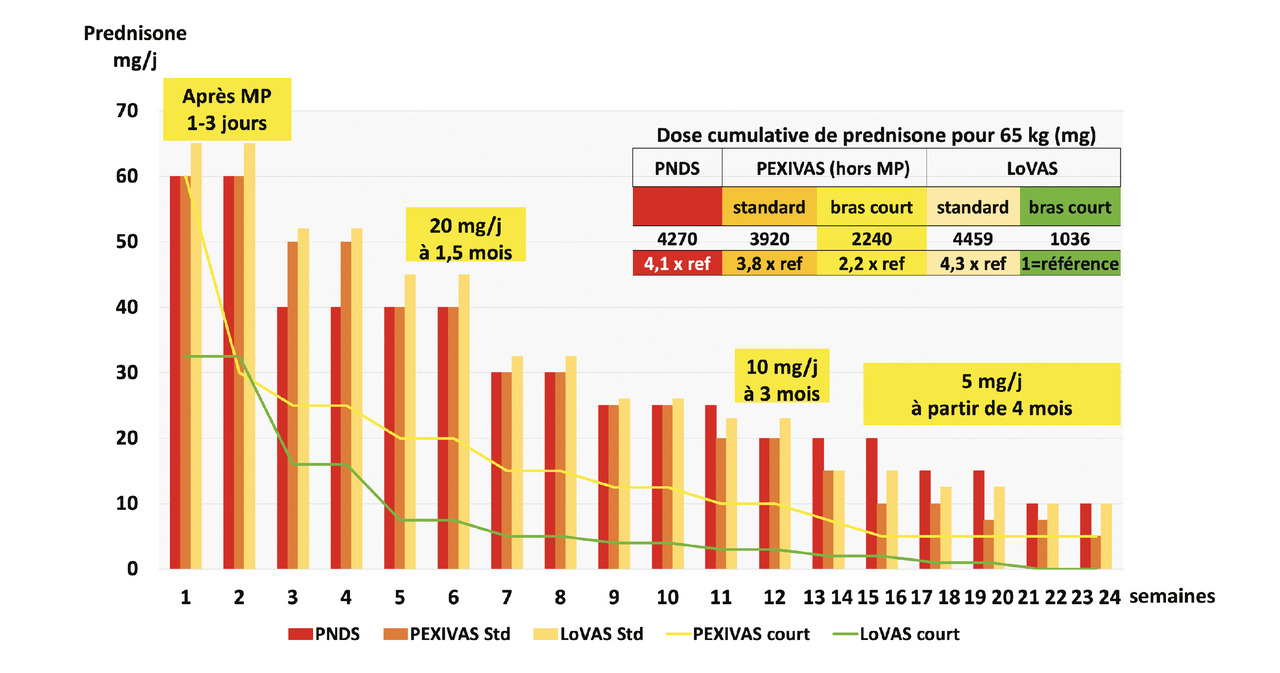
Les dernières années ont vu l’arrivée d’essais thérapeutiques démontrant la possibilité d’utiliser de moindres doses cumulatives de corticoïdes (fig. 2).
L’essai international PEXIVAS a démontré, chez des patients atteints de formes sévères de GPA ou MPA, qu’après des perfusions de méthylprednisolone, un schéma de décroissance rapide des corticoïdes ne s’accompagnait pas d’un moins bon contrôle de l’évolutivité de la vascularite, appréciée par un critère composite associant mortalité et passage en insuffisance rénale terminale.25 En revanche, les patients ayant reçu une corticothérapie à doses restreintes (1 mg/kg/j pendant une semaine, puis décroissance pour atteindre environ 20 mg/j à six semaines, 10 mg/j à trois mois, et 5 mg/j avant cinq mois) [fig. 2] présentaient un taux significativement inférieur d’infections sévères à un an. Cet essai est à la base des recommandations de décroissance de la corticothérapie dans ces vascularites aux États-Unis et en Europe.
L’essai LoVAS a également montré la diminution des complications infectieuses chez des patients randomisés pour recevoir moins de corticoïdes, mais seulement 40 % des patients ont pu effectivement suivre le protocole de décroissance des corticoïdes du bras court prévoyant un sevrage à six mois (fig. 2).26
Ces études ont permis un allégement des corticoïdes utilisés en pratique pour la prise en charge de ces patients, en association aux traitements immunosuppresseurs ou immunomodulateurs. La limitation des effets indésirables des corticoïdes est aussi primordiale chez les personnes âgées, qui présentent un taux d’infections sévères particulièrement important avec les schémas de corticoïdes non allégés.27
Place des échanges plasmatiques
La place des échanges plasmatiques a évolué au cours de la dernière décennie.
Depuis la réalisation d’un essai européen, ils étaient proposés aux patients atteints de vascularite associée aux ANCA, en cas d’insuffisance rénale progressive avec créatininémie supérieure à 500 µmol/L. En effet, cet essai avait montré un bénéfice à un an en matière de récupération de la fonction rénale chez de tels patients qui avaient été randomisés pour recevoir des échanges plutôt que des bolus de méthylprednisolone sans échange, en plus d’un traitement d’induction classique.28
L’essai PEXIVAS a ensuite randomisé plus de 700 patients atteints de formes sévères de GPA ou MPA, définis par une hémorragie alvéolaire diffuse ou une clairance de la créatinine inférieure à 50 mL/min, pour recevoir ou non des échanges plasmatiques.25 Le critère composite d’efficacité, associant mortalité et passage en insuffisance rénale terminale, n’était pas inférieur chez les patients n’ayant pas été échangés. Les résultats de cet essai ont considérablement réduit les indications des échanges plasmatiques.
Enfin, une méta-analyse récente de l’ensemble des essais publiés a montré une réduction de plus d’un tiers du risque d’insuffisance rénale terminale à un an avec les échanges plasmatiques par rapport à l’absence d’échanges plasmatiques, au prix d’une prévalence plus élevée d’effets infectieux sévères et sans modification de la mortalité.29 La réduction du risque d’insuffisance rénale terminale était plus importante chez les patients avec un risque modéré ou fort de développer une insuffisance rénale terminale, c’est-à-dire chez ceux dont la créatininémie était supérieure à 300 µmol/L.30 Il est ainsi maintenant recommandé de proposer des échanges plasmatiques, associés aux traitements classiques d’induction aux patients atteints de vascularite associée aux ANCA dont la créatininémie est supérieure à 300 µmol/L.30
Traitements associés
La vaccination contre la grippe, les infections à pneumocoques et à SARS-CoV- 2 doit être mise à jour, voire également celle contre le zona et le VRS. Une prophylaxie contre la pneumocystose est recommandée lors du traitement d’induction et tant que durent les perfusions de rituximab. La prise en charge des comorbidités s’impose, et notamment celle des facteurs de risque cardiovasculaire devant le risque d’augmentation des complications cardiovasculaires chez ces patients.31,32
Un essai du GFEV a montré la fréquence de découverte fortuite d’une indication de traitement par statines mais sans démontrer l’intérêt de l’adjonction systématique d’une statine chez les patients atteints de vascularite associée aux ANCA sur l’épaisseur intima-média carotidienne, marqueur intermédiaire du risque vasculaire clinique.33
L’ostéoporose cortico-induite doit être prévenue par les recommandations habituelles. L’éducation thérapeutique permet aux patients atteints de vascularite d’être acteurs dans leur prise en charge.
Amélioration du pronostic depuis vingt ans
Le pronostic des vascularites associées aux ANCA s’est transformé lors des deux dernières décennies. Cette amélioration est la conséquence des résultats d’essais thérapeutiques menés par des groupes collaboratifs nationaux ou internationaux et du développement de centres experts, qui ont mis en place des outils communs de diagnostic et de traitement fondés sur des éléments de preuve et des réseaux de soins pour ces patients atteints de maladies rares, y compris pour ceux réfractaires aux traitements ou ayant des complications sévères.
Critères de sévérité au cours des vascularites associées aux ANCA
Les manifestations sévères regroupent notamment (liste non restrictive à ces seules manifestations et à adapter à l’avis du clinicien) :2
- cardiomyopathie spécifique ;
- ischémie mésentérique ;
- hémorragie alvéolaire sévère avec détresse respiratoire ;
- insuffisance rénale rapidement progressive ;
- accident vasculaire cérébral spécifique ;
- atteinte de(s) paire(s) crânienne(s) ;
- mononeuropathie multiple avec atteinte motrice sévère.
D’autres manifestations sont aussi considérées comme sévères dans les études :23
- gangrène ;
- sclérite ;
- exsudats/hémorragie rétiniens ;
- surdité sensorielle ;
- hématurie avec cylindres ;
- méningite ;
- myélite ;
- neuropathie périphérique sensitive.
2. Protocole national de diagnostic et de soins (PNDS). Vascularites nécrosantes systémiques (périartérite noueuse et vascularites associées aux ANCA). 2019. https://urls.fr/22aXxQ
3. Kitching AR, Anders HJ, Basu N, et al. ANCA-associated vasculitis. Nat Rev Dis Primers 2020;6:71.
4. Chung SA, Langford CA, Maz M, et al. 2021 American College of Rheumatology/Vasculitis Foundation guideline for the management of antineutrophil cytoplasmic antibody-associated vasculitis. Arthritis Rheumatol 2021;73:1366-83.
5. Yates M, Watts RA, Bajema IM, et al. EULAR/ERA-EDTA recommendations for the management of ANCA-associated vasculitis. Ann Rheum Dis 2016;75:1583-94.
6. Stone JH, Merkel PA, Spiera R, et al. Rituximab versus cyclophosphamide for ANCA-associated vasculitis. N Engl J Med 2010; 363:221-32.
7. Puéchal X, Iudici M, Perrodeau E, et al. Rituximab vs cyclophosphamide induction therapy for patients with granulomatosis with polyangiitis. JAMA Netw Open 2022;5:e2243799.
8. Guillevin L, Pagnoux C, Karras A, et al. Rituximab versus azathioprine for maintenance in ANCA-associated vasculitis. N Engl J Med 2014;371:1771-80.
9. Delestre F, Charles P, Karras A, et al. Rituximab as maintenance therapy for ANCA-associated vasculitides: Pooled analysis and long-term outcome of 277 patients included in the MAINRITSAN trials. Ann Rheum Dis 202 Nov 2:sous presse. Ann Rheum Dis 2024;83(2):233-41.
10. Charles P, Perrodeau E, Samson M, et al. Long-term rituximab use to maintain remission of antineutrophil cytoplasmic antibody-associated vasculitis: A randomized trial. Ann Intern Med 2020;173:179-87.
11. Mrak D, Tobudic S, Koblischke M, et al. SARS-CoV-2 vaccination in rituximab-treated patients: B cells promote humoral immune responses in the presenceof T-cell-mediated immunity. Ann Rheum Dis 2021;80:1345-50.
12. Deepak P, Kim W, Paley MA, et al. Effect of immunosuppression on the immunogenicity of mRNA vaccines to SARS-CoV-2: A prospective cohort study. Ann Intern Med 2021;174:1572-85.
13. Puéchal X, Cottin V, Faguer S, et al. French Vasculitis Study Group recommendations for the management of COVID-19 vaccination and prophylaxis in patients with systemic vasculitis. Presse Med 2022;51:104107.
14. Iudici M, Pagnoux C, Courvoisier DS, et al. Localized versus systemic granulomatosis with polyangiitis: Data from the French Vasculitis Study Group Registry. Rheumatology (Oxford) 2022;61:2464-71.
15. Nguyen Y, Pagnoux C, Karras A, et al. Microscopic polyangiitis: Clinical characteristics and long-term outcomes of 378 patients from the French Vasculitis Study Group Registry. J Autoimmun 2020;112:102467.
16. Samson M, Puéchal X, Devilliers H, et al. Long-term follow-up of a randomized trial on 118 patients with polyarteritis nodosa or microscopic polyangiitis without poor-prognosis factors. Autoimmun Rev 2014;13:197-205.
17. Puéchal X, Pagnoux C, Baron G, et al. Adding azathioprine to remission-induction glucocorticoids for eosinophilic granulomatosis with polyangiitis (Churg-Strauss), microscopic polyangiitis, or polyarteritis nodosa without poor prognosis factors: A randomized, controlled trial. Arthritis Rheumatol 2017;69:2175-86.
18. Terrier B, Pugnet G, de Moreuil C, et al. Rituximab versus conventional therapeutic strategy for remission induction in eosinophilic granulomatosis with polyangiitis: A double-blind, randomized, controlled trial [abstract]. Arthritis Rheumatol 2021; 73 (suppl 10). https://urls.fr/xiqjdy
19. Site du Groupe français d’étude des vascularites (GFEV). Protocole de l’étude E-MERGE. https://gfev.netlify.app/actualites-des-protocoles/e-merge/
20. Site du Groupe français d’étude des vascularites (GFEV). Protocole de l’étude MAINRITSEG. https://gfev.netlify.app/actualites-des-protocoles/mainritseg
21. Groh M, Pagnoux C, Baldini C, et al. Eosinophilic granulomatosis with polyangiitis (Churg-Strauss) (EGPA) Consensus Task Force recommendations for evaluation and management. Eur J Intern Med 2015;26:545-53.
22. Puéchal X, Pagnoux C, Baron G, el al. Non-severe eosinophilic granulomatosis with polyangiitis: Long-term outcomes after remission-induction trial. Rheumatology (Oxford) 2019;58:2107-16.
23. Wechsler ME, Akuthota P, Jayne D, et al. Mepolizumab or placebo for eosinophilic granulomatosis with polyangiitis. N Engl J Med 2017;376:1921-32.
24. Wechsler M, Nair P, Terrier B, et al. Efficacy and safety of benralizumab compared with mepolizumab in the treatment of eosinophilic granulomatosis with polyangiitis in patients receiving standard of care therapy: Phase 3 MANDARA study [abstract]. Arthritis Rheumatol 2023;75 (suppl 9).
25. Walsh M, Merkel PA, Peh CA, et al. Plasma exchange and glucocorticoids in severe ANCA-associated vasculitis. N Engl J Med 2020;382:622-31.
26. Furuta S, Nakagomi D, Kobayashi Y, et al. Effect of reduced-dose vs high-dose glucocorticoids added to rituximab on remission induction in ANCA-associated vasculitis: A randomized clinical trial. JAMA 2021;325:2178-87.
27. Thietart S, Karras A, Augusto JF, et al. Evaluation of rituximab for induction and maintenance therapy in patients 75 years and older with antineutrophil cytoplasmic antibody-associated vasculitis. JAMA Netw Open 2022;5:e2220925.
28. Jayne DR, Gaskin G, Rasmussen N, et al. Randomized trial of plasma exchange or high-dosage methylprednisolone as adjunctive therapy for severe renal vasculitis. J Am Soc Nephrol 2007;18:2180-8.
29. Walsh M, Collister D, Zeng L, et al. The effects of plasma exchange in patients with ANCA-associated vasculitis: An updated systematic review and meta-analysis. BMJ 2022;376:e064604.
30. Zeng L, Walsh M, Guyatt GH, et al. Plasma exchange and glucocorticoid dosing for patients with ANCA-associated vasculitis: A clinical practice guideline. BMJ 2022;376:e064597.
31. Morgan MD, Turnbull J, Selamet U, et al. Increased incidence of cardio-vascular events in patients with antineutrophil cytoplasmic antibody-associated vasculitides. Arthritis Rheum 2009;60:3493-500.
32. Robson J, Doll H, Suppiah R, et al. Damage in the ANCA-associated vasculitides: Long-term data from the European vasculitis study group (EUVAS) therapeutic trials. Ann Rheum Dis 2015;74:177-84.
33. Terrier B, Pugnet G, Sirieix M, et al. Randomized, controlled, double-blind trial on the impact of rosuvastatin on sublinical markers of atherosclerosis in patients with ANCA-associated vasculitis [abstract]. Arthritis Rheumatol 2023;75 (suppl 9).

 Encadrés
Encadrés