Les sarcomes sont rares et représentent 1 à 2 % des tumeurs malignes de l’adulte mais jusqu’à 15 % des tumeurs malignes de l’enfant.1 Le risque pour une personne de développer un sarcome au cours de sa vie est très faible : entre 0,15 et 0,50 %. Un médecin généraliste ne verra ainsi qu’un ou deux sarcomes dans sa carrière. En raison de cette rareté, ces cancers posent différentes problématiques spécifiques en matière de prise en charge avec un sur-risque de diagnostic erroné conduisant à des traitements inadéquats.
Absence de contexte particulier
Aucun contexte particulier n’est suffisamment spécifique pour évoquer le diagnostic de sarcome, idiopathique dans la plupart des cas. Certains facteurs de risque ont néanmoins été identifiés :2,3 prédispositions génétiques héréditaires (par exemple, le syndrome de Li-Fraumeni, la polypose adénomateuse familiale et le syndrome de Gardner, le syndrome du rétinoblastome, la neurofibromatose de type 1 et de type 2, etc.), les rayonnements ionisants, des agents chimiques (arsenic, chlorure de vinyle, etc.), des déficits du système immunitaire héréditaires ou acquis et le lymphœdème (lire « Sarcomes : une entité plurielle », page 954).
Signes cliniques aspécifiques, mais quatre critères doivent alerter
Parmi les sarcomes, ceux des tissus mous (STM) sont les plus fréquents (80 % des cas) ; ce sont aussi les plus sujets à une errance diagnostique et à un retard de prise en charge car ils se présentent typiquement comme des masses indolores dont la croissance est variable, survenant n’importe où dans l’organisme.
La grande majorité des masses répondant à cette description sont bénignes (rapport malin/bénin d’environ 1/100), mais ce rapport augmente à 1/7 en cas de tumeur profonde (5 cm ou plus).4 En effet, bien que la plupart des signes cliniques soient aspécifiques et faussement rassurants, voire que le patient soit asymptomatique, des critères cliniques simples ont été validés pour discriminer un potentiel sarcome des nombreuses et fréquentes tumeurs bénignes :5,6 une masse profonde et inexpliquée des tissus mous (avec la limite bien identifiée du piège diagnostique d’une suspicion d’hématome dans un contexte de prise d’anticoagulant), une masse (même superficielle) de plus de 5 cm et de diagnostic inconnu, une masse augmentant progressivement de taille et une masse douloureuse, bien que dans une moindre mesure.
Environ 75 % des patients diagnostiqués pour un STM présentent au moins un de ces quatre signes cliniques devant alerter. Ainsi, si l’un de ces critères est présent, le premier médecin consulté par le patient doit impérativement l’adresser au centre expert le plus proche : une amélioration du pronostic a été largement démontrée, simplement par une prise en charge dans un de ces centres dès la phase diagnostique.7
Hormis pour les petites tumeurs superficielles, aucune exérèse d’emblée n’est acceptable tant qu’il n’y a pas eu d’explorations complémentaires.
Réunions de concertation pluridisciplinaire avec NetSarc+
La France, sensibilisée aux problématiques posées par la gestion des tumeurs rares, a cherché des solutions au travers du Plan cancer 2009 - 2013, avec notamment l’objectif affiché d’une labellisation des « centres de référence » pour les cancers rares. Dans le domaine des sarcomes, c’est sous cette impulsion qu’est né le réseau NetSarc, réseau de référence clinique des sarcomes (pour la liste des centre experts labellisés, voir la figure 4 de l’article « Sarcome : une entité plurielle », page 957). Labellisé par l’Institut national du cancer fin 2009, il rassemble les centres reconnus pour leurs compétences dans la prise en charge des sarcomes et des tumeurs des tissus conjonctifs et se construit autour d’un centre de référence multisite (centre Léon-Bérard à Lyon, institut Bergonié à Bordeaux et Gustave-Roussy à Villejuif), renforcé par un maillage régional de 22 centres experts. Le réseau NetSarc, devenu NetSarc+, se traduit concrètement par la tenue de réunions de concertation pluridisciplinaire (RCP) régionales « sarcomes ». L’accès aux centres experts est synonyme d’une prise en charge pluridisciplinaire permettant dans un premier temps l’établissement du « bon diagnostic » puis la réalisation de traitements innovants, séquentiels et coordonnés entre les différents spécialistes.
Premières explorations pour trier les lésions
Comme mentionné précédemment, les tumeurs osseuses et des tissus mous forment un groupe très vaste de lésions qui sont essentiellement représentées par des lésions bénignes. Ainsi, l’exploration d’une lésion osseuse ou des parties molles est un motif fréquent de consultation en radiologie. La radiographie et l’échographie sont des examens de débrouillage nécessaires qui permettent de trier les lésions dont le diagnostic de bénignité est certain (malformation vasculaire, exostose…). Le site https ://expertisesarcome.org/prise-en-charge/radiologie/ propose une prise en charge diagnostique radiologique adaptée aux situations de la pratique courante sous forme d’algorithme, facile d’utilisation.
Tumeurs des membres
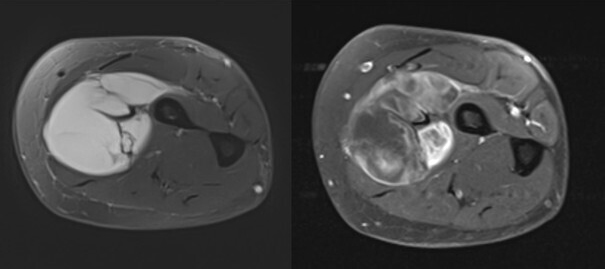
Concernant les tumeurs des membres, on distingue premièrement les lésions graisseuses, qui sont majoritairement représentées par les lipomes bénins. Ces lésions ne nécessitent pas d’examen complémentaire si elles ont une taille inférieure à 5 cm en situation profonde (intramusculaire) ou 10 cm en situation superficielle (dans la graisse sous-cutanée au-dessus des fascias musculaires). Au-dessus de cette limite de taille, il est recommandé de réaliser une imagerie par résonance magnétique (IRM), à la recherche de signes d’atypie. L’objectif est de reconnaître les potentiels liposarcomes et les tumeurs graisseuses atypiques (liposarcomes bien différenciés). Dans les autres cas de figure, c’est-à-dire pour les tumeurs non graisseuses, ou les pseudotumeurs, ou pour les tumeurs osseuses qui ne sont pas aisément caractérisables, le recours à l’IRM doit être systématique (figure). Certaines lésions restent d’orientation difficile, et il est de rigueur de prôner la prudence en envoyant le patient dans un centre expert et/ou en organisant une surveillance radioclinique. Pour inciter à la prudence, on évoque volontiers les cas souvent décrits des lésions sarcomateuses prises par erreur pour des hématomes et les radiographies normales des sarcomes osseux de l’enfant au stade précoce. Une évolution clinique péjorative doit être systématiquement accompagnée d’une investigation radiologique par IRM.
Lésions thoraco-abdomino-pelviennes
Les lésions du tronc, de l’abdomen et du pelvis sont volontairement explorées avec un scanner thoraco-abdomino-pelvien. La grande variété des lésions existantes ne permet pas de toutes les citer, mais il faut savoir adresser le patient en centre expert devant toute lésion viscérale inhabituelle. Un complément d’examen par IRM est parfois utile pour les localisations pelviennes, comme les sarcomes utérins.
Rôles du radiologue et du médecin traitant
Le radiologue se situe donc en seconde ligne, après le médecin traitant, dans le processus diagnostique des lésions sarcomateuses. Le rôle du radiologue non expert est d’orienter le diagnostic pour écarter les lésions bénignes qui représentent l’immense majorité des situations, tout en ne multipliant pas les examens d’imagerie (toutes les échographies ne doivent pas faire l’objet d’une IRM de contrôle).
Le médecin traitant doit, de son côté, garder un œil critique sur le compte-rendu radiologique en détectant les discordances radiocliniques et en sélectionnant les patients à adresser au centre expert.
Le radiologue expert est impliqué activement dans la prise en charge des malades. Il participe aux RCP et, de plus en plus souvent, à des staffs dédiés au processus diagnostique, pour ne pas surcharger les RCP de discussions thérapeutiques. La possibilité de réaliser des biopsies radioguidées a nettement accéléré l’accès au diagnostic anatomopathologique. La biopsie est systématiquement réalisée dans un centre expert car le radiologue doit scrupuleusement faire concorder ses trajets de biopsie aux abords chirurgicaux, et l’acheminement des prélèvements directement auprès des équipes de pathologistes expertes optimise grandement la rentabilité des échantillons biopsiques. Enfin, les radiologues sont impliqués pendant tout le suivi du patient pour l’évaluation des réponses au traitement et, dans certains cas, pour ajouter une option à l’arsenal thérapeutique en proposant des traitements de radiologie interventionnelle comme la destruction par radiofréquence des métastases pulmonaires.
Place de l’anatomopathologiste expert
Sur le plan histopathologique, les sarcomes forment un groupe hétérogène ; ils sont classés en une cinquantaine de sous-types, parfois très rares et dont le diagnostic se fonde sur la classification de l’Organisation mondiale de la santé (OMS) des tumeurs des tissus mous et des os.8 Outre une imagerie préopératoire adaptée, tout diagnostic de sarcome (et de tumeur rare en général) doit bénéficier d’une confirmation avec relecture systématique par un anatomopathologiste expert, au sein du réseau NetSarc+ et ce, même si le diagnostic initial a été fait en dehors d’un centre expert. Les diagnostics erronés ou imprécis sont diminués grâce à cette double lecture. Cette prise en charge par un pathologiste du réseau garantit un diagnostic fiable, reproductible et la mise en œuvre de toutes les techniques les plus adaptées au diagnostic. Les cas complexes sont rediscutés collégialement lors de réunions de relecture nationale.
Les très nombreux sous-types de sarcome ont motivé différentes approches de classification. Historiquement, les sarcomes étaient classés en fonction du tissu auquel ils ressemblent au microscope, c’est-à-dire une classification fondée sur la différenciation ; désormais, la classification est dite intégrative, associant présentation clinique, histopathologie, différenciation, grade de malignité et anomalie moléculaire. Ce diagnostic intégré repose sur l’étude d’une biopsie, examinée au microscope, souvent complétée par des techniques complémentaires d’immunohistochimie et/ou de pathologie moléculaire, nécessitant d’épargner au maximum le précieux matériel tissulaire disponible. Les tissus fixés en formol et inclus dans la paraffine (FFPE) permettent la réalisation de toutes les techniques pour le diagnostic, mais un prélèvement frais préservé après congélation peut aussi être utile pour des techniques plus poussées et l’inclusion dans des protocoles : sa réalisation est donc toujours recommandée.
Par ailleurs, informer et recueillir le consentement des patients pour l’utilisation à visée de recherche de leur prélèvement diagnostique devrait être réalisé le plus tôt possible. En matière de délais, certains diagnostics sont faciles et rapides alors que d’autres nécessitent la mise en œuvre de techniques spécifiques parfois restreintes à certains centres car utilisant des techniques de biologie moléculaire (lire le focus « Apports de la biologie moléculaire dans les sarcomes », page 963). Ces dossiers difficiles sont souvent liés à des délais supplémentaires incompressibles, conséquence de la transmission du matériel histologique entre pathologistes, de la réalisation des techniques plus sophistiquées qui analysent le profil génétique et épigénétique de la tumeur (FISH, séquençage sur panel, séquençage whole exome, RNA sequencing, profils de méthylation, etc.).
Certains cas sont si rares qu’ils nécessitent une discussion entre experts nationaux. Le diagnostic repose toujours in fine sur une intégration cohérente de l’ensemble de ces informations cliniques, radiologiques, histopathologiques et moléculaires au cours d’une RCP en centre expert pour statuer sur la prise en charge. Malgré les délais nécessaires au diagnostic et de façon pragmatique, les bases du projet thérapeutique peuvent être construites rapidement dès les constatations histologiques préliminaires du pathologiste expert, en se fondant notamment sur le grade de malignité, qui est un élément fondamental et qui ne nécessite pas, pour être établi, de technique sophistiquée. Les sarcomes de haut grade sont associés à un risque d’évolution plus rapide, à davantage de récidives locales et à la possibilité de métastases ; ils bénéficient donc d’une adaptation du traitement, alors que les sarcomes de bas grade ne présentent que peu ou pas de risque métastatique. Le potentiel métastatique augmente avec le grade, respectivement de 5 à 10 %, 25 à 30 % et 50 à 60 % pour les grades I à III de la Fédération nationale des centres de lutte contre le cancer (FNCLCC).
Enfin, le pathologiste joue un rôle déterminant après la chirurgie pour évaluer la qualité d’une exérèse chirurgicale et/ou la réponse à un éventuel traitement néoadjuvant, qui constituent deux éléments pronostiques.
Registre et formations pour garantir l’excellence diagnostique
L’amélioration de la connaissance de ces pathologies rares, des modalités de diagnostic, de traitement et du devenir de ces patients est essentielle pour adapter au mieux l’organisation spécifique et soutenir la recherche. Dans cet objectif, les équipes sarcomes enregistrent les données de ces cancers rares dans la base nationale NetSarc+ et organisent des diplômes et formations médicales continues nationales pour garantir l’excellence diagnostique au sein du réseau.
2. Hui JYC. Epidemiology and etiology of sarcomas. Surg Clin North Am 2016;96(5):901-14.
3. Thomas DM, Ballinger ML. Etiologic, environmental and inherited risk factors in sarcomas. J Surg Oncol 2015;111(5):490-5.
4. Myhre-Jensen O. A consecutive 7-year series of 1331 benign soft tissue tumours. Clinicopathologic data. Comparison with sarcomas. Acta Orthop Scand 1981;52(3):287-93.
5. Nandra R, Forsberg J, Grimer R. If your lump is bigger than a golf ball and growing, think sarcoma. Eur J Surg Oncol 2015;41(10):1400-5.
6. Dyrop HB, Vedsted P, Safwat A, et al. Alarm symptoms of soft-tissue and bone sarcoma in patients referred to a specialist center. Acta Orthop 2014;85(6):657-62.
7. Blay JY, Penel N, Valentin T, et al. Improved nationwide survival of sarcoma patients with a network of reference centers. Ann Oncol 2024;35(4):351-63.
8. WHO Classification of soft tissue and bone tumours, 5e éd., vol. 3 (Lyon: International Agency for Research on Cancer, 2020).
Dans cet article
- Absence de contexte particulier
- Signes cliniques aspécifiques, mais quatre critères doivent alerter
- Réunions de concertation pluridisciplinaire avec NetSarc+
- Premières explorations pour trier les lésions
- Rôles du radiologue et du médecin traitant
- Place de l’anatomopathologiste expert
- Registre et formations pour garantir l’excellence diagnostique