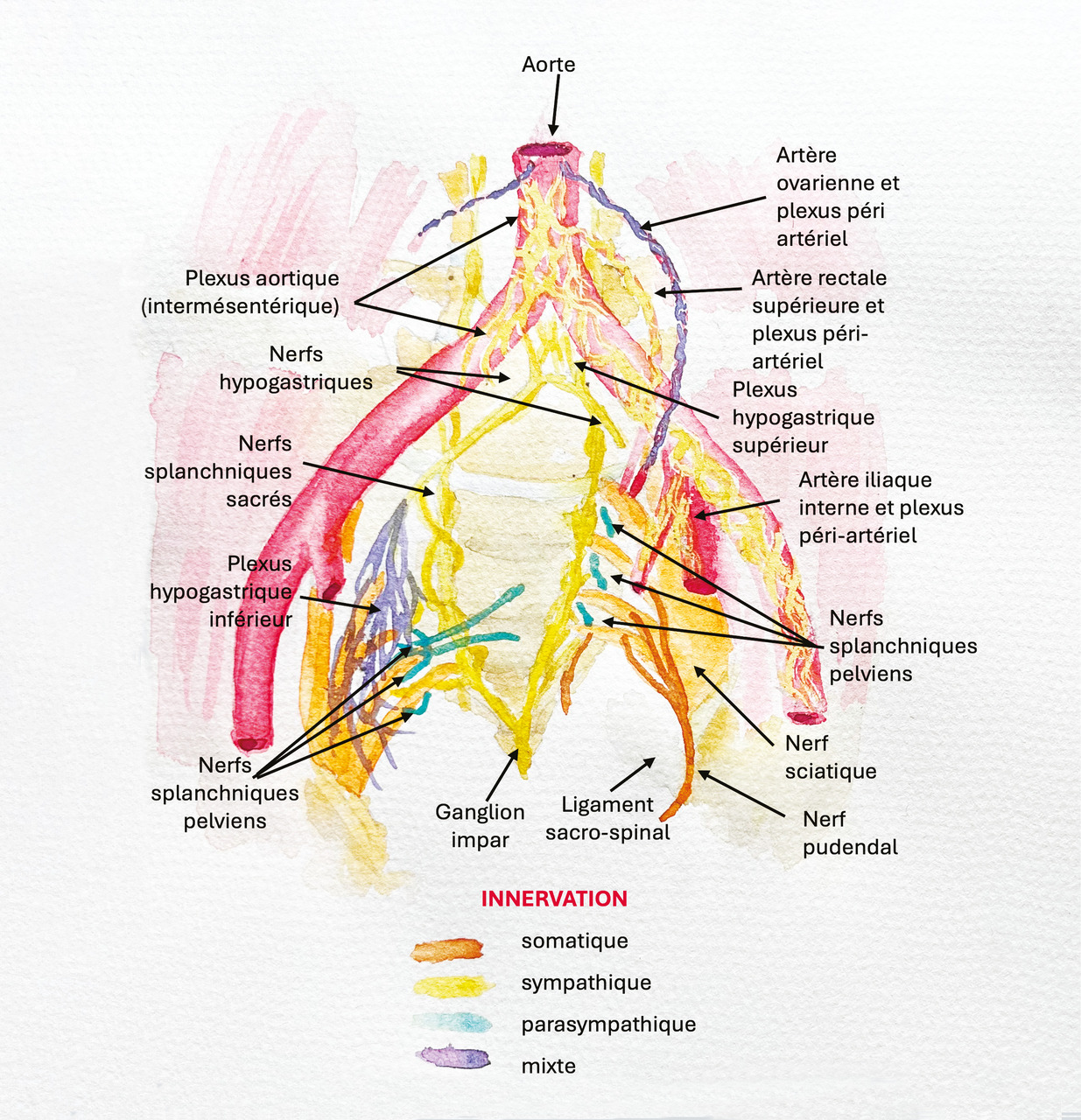
Afin de bien prendre en charge les douleurs pelvi-périnéales chroniques, il est nécessaire de bien connaître l’anatomie de cette région, et leur neurophysiologie.
Anatomie de la région pelvienne
La région pelvienne comprend à la fois des structures viscérales et somatiques, avec des innervations complexes et variées.1
Les structures viscérales comprennent la vessie, les uretères terminaux, l’urètre, les ovaires, les trompes de Fallope, l’utérus, le vagin, la prostate, le côlon sigmoïde, le rectum ainsi que la vascularisation et les lymphatiques associés. Le périnée représente la partie externe du pelvis avec en avant la vulve ou la verge et en arrière l’anus.
Les structures somatiques comprennent les os, les ligaments, les muscles, les fascias et les dermatomes cutanés de la paroi corporelle.
L’innervation motrice du bassin provient de fibres motrices efférentes depuis la moelle épinière aboutissant aux muscles squelettiques des parois pelviennes, du plancher pelvien et du périnée.
Les fibres afférentes sensorielles transmettent les sensations provenant des organes musculo-squelettiques, des viscères et du péritoine pariétal en plus des dermatomes et des myotomes correspondants.
Le plexus sacré, formé par le tronc lombo-sacré (L4 et L5 du plexus lombaire et branches antérieures de S1 -S4), assure l’innervation somatique du bassin.
L’innervation de la paroi abdominale antérieure et latérale provient des nerfs intercostaux (T7 -T11), du nerf sous-costal (T12) et des nerfs ilio-hypogastriques et ilio-inguinal (L1).
L’innervation viscérale du bassin se compose de branches autonomes efférentes et de branches afférentes. Le système autonome efférent est constitué de fibres sympathiques et parasympathiques qui alimentent l’urètre, la vessie, les uretères, le vagin, le col de l’utérus, l’utérus, les trompes de Fallope, les ovaires, le côlon sigmoïde, le rectum, le canal anal et le péritoine viscéral chez la femme. Le système afférent transmet les signaux de la paroi abdominale, des viscères pelviens et du péritoine viscéral.
Concernant les voies nociceptives, le plexus hypogastrique inférieur est un centre de relais majeur qui innerve l’appareil génital et reproducteur, la vessie, l’urètre, l’uretère distal, le sphincter anal interne et le rectum. Il contribue également à trois autres plexus : le plexus rectal, le plexus utérovaginal et le plexus vésical. Le plexus hypogastrique supérieur alimente les plexus urétéral, ovarien, iliaque commun (figure).
Neurophysiologie de la douleur pelvi-périnéale « normale »
La nociception désigne le traitement par le système nerveux des informations relatives à l’environnement interne ou externe, générées par l’activation des nocicepteurs. Ainsi, les stimuli nocifs activent les nocicepteurs présents dans les structures périphériques qui transmettent des informations à la corne dorsale de la moelle épinière. De là, l’information est transmise vers le tronc cérébral et le cerveau, où la perception de la douleur est générée. La douleur est le produit du traitement par le centre cérébral supérieur, alors que la nociception peut se produire en l’absence de douleur.2
La majorité des nocicepteurs est associée à des fibres nerveuses non myélinisées, également appelées fibres C, qui conduisent lentement et qui répondent à une stimulation thermique, mécanique ou chimique nocive. Les protéines de la membrane de ces nocicepteurs effectuent alors une transduction de l’énergie du stimulus thermique, mécanique ou chimique naturel en impulsions électriques qui se propagent ensuite le long de l’axone périphérique et central du nocicepteur jusqu’au système nerveux central. La branche centrale du nocicepteur se termine dans la corne dorsale de la moelle, où elle établit des connexions synaptiques avec un ensemble complexe de neurones qui jouent différents rôles dans le traitement nociceptif et la douleur :
- certains interneurones établissent des connexions avec des motoneurones qui génèrent des réflexes de retrait nociceptifs ;
- les neurones de sortie de la moelle épinière, quant à eux, se projettent dans la région rostrale et transmettent le message nociceptif à la formation réticulaire du tronc cérébral et au thalamus, ainsi qu’aux circuits limbiques émotionnels du cerveau ;
- des stimulations nociceptives activent un système descendant mettant en jeu des régions cérébrales et du tronc cérébral spécifiques qui va également moduler la douleur.
Le traitement cortical des informations liées à la douleur dépend enfin de l’activité de différentes régions du cortex qui peuvent, par ailleurs, être sollicitées par des stimulations non douloureuses.
Ce type de douleur « normale », provenant d’une activation des nocicepteurs, est dite « douleur nociceptive » et peut être générée par des atteintes viscérales (infections, tumeurs, inflammations, traumatismes), des atteintes osseuses, musculaires, cutanées, vasculaires… de la région pelvi-périnéale.
Quand la douleur chronique devient pathologique
Sensibilisations centrale et périphérique
Dans tous les autres systèmes de transduction sensorielle, des stimuli successifs génèrent un mécanisme d’adaptation et donc une activité réduite. En douleur, c’est l’inverse, les terminaisons de nocicepteurs répondent plus vigoureusement à des stimuli successifs (sensibilisation).
L’hyperalgésie est une caractéristique de la douleur inflammatoire et une conséquence de nombreux types d’agression tissulaire (allant d’une incision cutanée à une lésion nerveuse).
Il existe deux types d’hyperalgésie, primaire et secondaire, chacun associé à des mécanismes différents.
Hyperalgésies primaire et secondaire
L’hyperalgésie primaire se caractérise par une excitabilité accrue des nocicepteurs sur le site de l’agression (par exemple, le site d’une incision). Elle survient le plus souvent après une lésion cutanée mais peut également se développer à la suite d’une atteinte des articulations, des muscles ou des viscères. Autour du site de la lésion, et souvent à des endroits assez éloignés de la lésion (en particulier lorsque les articulations et surtout les viscères sont touchés), se trouve une zone de sensibilité accrue appelée zone d’hyperalgésie secondaire.
L’hyperalgésie primaire ou secondaire s’accompagne d’une augmentation de l’excitabilité et des réponses des neurones du système nerveux.
L’hyperalgésie primaire est largement attribuée à une augmentation de l’excitabilité des nocicepteurs (c’est-à-dire les terminaisons et fibres sensorielles afférentes périphériques), tandis que l’hyperalgésie secondaire est associée à des changements dans l’excitabilité des neurones du système nerveux central, y compris la moelle épinière et les sites supra-épineux du cerveau.
Par conséquent, l’hyperalgésie primaire est associée à une sensibilisation périphérique des nocicepteurs et l’hyperalgésie secondaire à une sensibilisation centrale.
Sensibilisation centrale
L’hypersensibilité centrale peut être causée par l’activation de fibres nociceptives, ectopiques ou même normales. Des modifications de la réponse de la moelle épinière à des stimuli nociceptifs mais aussi inoffensifs (miction, défécation, rapports sexuels…) ont été observées dans des états d’inflammation aigus et prolongés. Tous ces mécanismes peuvent évoluer pour leur propre compte, de manière indépendante de l’inflammation ou de la lésion qui a initialement généré le dysfonctionnement.3
Il est donc tout à fait possible qu’une douleur existe sans qu’aucun stimulus nociceptif ne soit transmis. Une lésion (à l’origine d’une douleur neuropathique) ou même un dysfonctionnement neurologique du système douloureux (à l’origine alors d’une douleur nociplastique), avec des mécanismes de sensibilisation centrale et/ou périphérique, peut rendre compte de l’expérience douloureuse réelle du patient.
Modulation émotionnelle de la douleur chronique
La douleur n’est pas simplement l’appréciation de la présence, de la localisation et de l’ampleur de l’influx nociceptif mais plutôt un événement complexe avec une composante émotionnelle/affective importante. En effet, des facteurs psychologiques peuvent influencer de manière significative l’expérience de la douleur.
La question de savoir si le stress peut provoquer une douleur chronique pelvi-périnéale est encore débattue. Un ensemble de preuves suggère que le stress peut être associé à une augmentation de la tension musculaire, en particulier au niveau des muscles du plancher pelvien. Cela peut directement provoquer une douleur au niveau de ces muscles, qui peut également entraîner un certain degré d’irritation nerveuse, produisant une réponse de sensibilisation. Ce mécanisme a été suggéré pour la douleur vulvaire et de la prostate.
Ces facteurs émotionnels jouent également un rôle important pour déterminer la façon dont un patient réagit à sa douleur. Les patients atteints de douleur pelvienne chronique obtiennent souvent des résultats élevés lorsqu’ils sont évalués pour la dépression et l’anxiété ; ces réactions émotionnelles aggravent souvent le handicap associé aux effets musculo-squelettiques. Un cercle vicieux entre l’humeur et le comportement peut se mettre en place.4
Syndromes myofasciaux
La douleur myofasciale résulte d’un dysfonctionnement du muscle et du fascia (tissu conjonctif qui l’entoure). L’une des caractéristiques de son diagnostic est la présence de zones gâchettes (trigger points) dans la région douloureuse, petits nodules palpables et hypersensibles situés sur des bandes tendues de muscles squelettiques et dans un état soutenu de contracture. Ces zones gâchettes peuvent être spontanément douloureuses (c’est-à-dire actives) ou douloureuses uniquement en cas de perturbation (c’est-à-dire latentes) ; elles sont souvent à l’origine de douleurs projetées suivant des schémas prévisibles.5 Les zones gâchettes peuvent être présentes dans tout le corps, y compris au niveau du plancher pelvien, et elles peuvent projeter la douleur vers l’urètre, le vagin, le rectum, la verge, le coccyx, le sacrum, les lombaires, le bas de l’abdomen et la partie postérieure des cuisses.6
Rôle du système nerveux autonome
Le système nerveux autonome, qui comprend les systèmes nerveux sympathique et parasympathique, est un système pivot du maintien de l’homéostasie de l’organisme. Il module non seulement l’activité contractile des muscles lisses vasculaires ou non vasculaires, les mouvements intestinaux, la sécrétion glandulaire et l’interaction des cellules immunitaires mais il transmet également au système nerveux central des informations sur l’environnement interne et les stimuli nocifs potentiels. Comme on peut le voir dans des maladies inflammatoires chroniques intestinales ou rhumatismales, les altérations de la structure et de la fonction des fibres nerveuses sympathiques sont associées à une inflammation chronique.7 Des anomalies de l’activité du système nerveux autonome (sympathique) ont été démontrées dans la douleur pelvienne chronique et ont été décrites à la fois au niveau clinique et expérimental.8
Mécanismes multiples et complexes
Les mécanismes mis en jeu dans la douleur pelvi-périnéale chronique sont donc multiples et complexes, interagissant les uns avec les autres pour contribuer à un fonctionnement pathologique indépendant de la lésion initiale. Ceci justifie une prise en charge plurimodale, suivant le modèle bio-psycho-social des maladies chroniques.
2. National Research Council (US) Committee on recognition and alleviation of pain in laboratory. Mechanisms of pain. In Recognition and alleviation of pain in laboratory animals. Washington (DC): National Academies Press (US) 2009;2, Mechanisms of pain.
3. Latremolière A, Woolf CJ. Central sensitization: A generator of pain hypersensitivity by central neural plasticity. The Journal of Pain 2009;10(9):895‑926.
4. Baranowski AP. Chronic pelvic pain. Best Practice & Research Clinical Gastroenterology 2009;23(4):593‑610.
5. Aredo J, Heyrana K, Karp B, et al. Relating chronic pelvic pain and endometriosis to signs of sensitization and myofascial pain and dysfunction. Seminars in Reproductive Medicine 2017;35(01):88‑97.
6. Howard FM. Pelvic pain: Diagnosis and management. Lippincott Williams & Wilkins 2000. 529 pages.
7. Song SY, Jung YW, Shin W, et al. Endometriosis-related chronic pelvic pain. Biomedicines 2023;11(10):2868.
8. Charrua A, Pinto R, Birder LA, et al. Sympathetic nervous system and chronic bladder pain: A new tune for an old song. Translational Andrology and Urology 2015;4(5):534‑42.