Le vieillissement démographique est associé à une perte d’autonomie, à une augmentation de l’incidence de pathologies (dont le cancer) ainsi qu’à une diminution des réserves fonctionnelles, qui définit le concept de fragilité. Celle-ci est un processus dynamique et potentiellement réversible altérant les mécanismes d’adaptation au stress qui entraîne un défaut d’homéostasie et un changement de l’état de santé disproportionné.1 Les patients âgés atteints de cancer présentent donc des spécificités diagnostiques, pronostiques et thérapeutiques dont il faut savoir tenir compte. À ce titre, l’acte chirurgical apparaît comme un stress pouvant faire décompenser un équilibre précaire et conduire à la dépendance, la grabatisation, voire le décès. L’optimisation de la prise en charge est ainsi indispensable et nécessite une évaluation soigneuse des comorbidités et du risque anesthésique, et impose une réhabilitation périopératoire organisée. Le gériatre se positionne comme chef d’orchestre de ce parcours de soins.
Spécificités du sujet âgé en cancérologie
Données épidémiologiques
Le rapport mondial sur le vieillissement et la santé publié en 2015 par l’Organisation mondiale de la santé (OMS) souligne un vieillissement démographique inéluctable avec une part de plus en plus importante des personnes âgées de plus de 65 ans dans la population générale.2 Selon le rapport publié par l’Institut national du cancer (INCa) en 2017, 62,4 % des nouveaux cancers sont diagnostiqués chez des individus de plus de 65 ans et 11,5 % d’entre eux sont diagnostiqués chez les plus de 80 ans.3 La mortalité spécifique par cancer est significativement plus élevée chez les sujets âgés que chez les malades considérés comme « jeunes ». En France, près de trois quarts des décès par cancer surviennent au-delà de 65 ans et près de 25 % après 80 ans.3 Quel que soit le cancer, il existe une diminution significative de la survie spécifique avec l’avancée en âge sans diminution de la survie globale.4 Cette discordance s’explique notamment par la méconnaissance des spécificités oncologiques des patients âgés, un défaut d’évaluation globale du patient et d’information sur les possibilités thérapeutiques, une inadaptation du système de santé, l’âgisme, mais surtout par un retard diagnostique particulièrement élevé dans cette population. À l’échelle de la société, il en résulte une augmentation des dépenses liées aux soins.
Aspects biologiques
Le vieillissement est la conséquence de pertes de fonctions et de résistances des cellules tandis que l’oncogenèse résulte de gains de fonctions et de résistances cellulaires. Bien qu’opposés, ces deux processus sont à l’origine d’une altération du patrimoine génétique.5 La prolifération cellulaire nécessaire au renouvellement de l’organisme expose le génome à des mutations susceptibles d’initier un processus d’oncogenèse. En réponse, les organismes complexes ont acquis des mécanismes de protection, soit par réparation de l’ADN, soit par régulation du cycle cellulaire. Le vieillissement entraîne des perturbations des mécanismes de défense, expliquant l’intrication biologique entre vieillissement et cancer.
Évaluation préopératoire du sujet âgé atteint d’un cancer
L’évaluation gériatrique préopératoire a pour objectif d’identifier des altérations de l’état de santé du patient qui n’auraient pas été mises en évidence par la procédure diagnostique standard, et qui pourraient faire l’objet d’actions correctrices. Elle apprécie l’état de santé de l’individu dans sa globalité et identifie ses vulnérabilités. Elle évalue les principaux domaines cliniques (état fonctionnel, comorbidités, nutrition, cognition…) et est fondée sur des questionnaires standardisés. Elle nécessite une étroite collaboration entre infirmiers dédiés, oncogériatres et travailleurs sociaux, mais peut impliquer d’autres professionnels comme les pharmaciens cliniciens, les kinésithérapeutes, les ergothérapeutes ou encore les nutritionnistes et les diététiciens.
Tous les patients âgés atteints de cancer ne sont pas éligibles à une évaluation gériatrique préopératoire. Il est difficile de définir des critères devant faire orienter le patient vers une consultation d’évaluation gériatrique. Celle-ci s’inscrit dans une démarche de soins ; l’âge seul n’est ni nécessaire ni suffisant pour inscrire un patient dans un circuit gériatrique. Il s’agit avant tout d’une question de bon sens clinique. Des questionnaires de « dépistage » des fragilités, assez sensibles mais peu spécifiques, (questionnaire G8 recommandé par l’Institut national du cancer pour les malades de plus de 70 ans : tableau 1 de l’article « Influence de l’âge sur la prise en charge oncologique », page 40) peuvent aider le chirurgien à déterminer quel malade serait éligible à une évaluation gériatrique. Mais la perspective d’un traitement particulièrement morbide, comme une chimiothérapie ou une chirurgie telle que la cystectomie, rend légitime et souhaitable le recours à un gériatre.
Que recherche l’évaluation gériatrique ?
Une telle évaluation comprend cinq items : état fonctionnel, comorbidités, état nutritionnel, état psychique et cognitif, et traitements en cours.
État fonctionnel
L’état fonctionnel du patient âgé est corrélé à la survie globale et au risque de complications des traitements (médicamenteux ou chirurgicaux) oncologiques.6 Les échelles classiquement utilisées en cancérologie (indice de Karnofsky ou performance status) évaluent l’état général du malade mais ne sont pas adaptées au sujet âgé.
Deux autoquestionnaires permettent de décrire les capacités fonctionnelles des personnes âgées :
- l’indice des activités de la vie quotidienne (ADL) de Katz évalue les capacités d’indépendance au domicile (continence, aller aux toilettes, se laver, se nourrir, s’habiller, sortir du lit et du fauteuil) ;
- l’indice des activités instrumentales de la vie quotidiennes (IADL) de Lawton évalue l’autonomie sociale (utiliser le téléphone, faire ses courses, préparer à manger, faire le ménage, faire la lessive, prendre ses médicaments, gérer ses finances, prendre les moyens de transport).
En parallèle, l’évaluation gériatrique permet d’apprécier la force musculaire (mesure de la force de préhension, tests de marche), l’équilibre (cliniquement et par l’évaluation du nombre de chutes) et la vitesse de marche (standardisée sur quatre mètres) du patient. Ce dernier critère est le meilleur reflet de l’état fonctionnel d’un individu.7
Comorbidités
Les comorbidités sont plus fréquentes chez le sujet âgé que dans la population générale et peuvent interférer avec les traitements anticancéreux. L’exemple le plus connu d’échelle d’évaluation des comorbidités est l’indice de comorbidité de Charlson.*8 Il permet d’évaluer un ensemble de 19 morbidités pondérées par leur importance et leur signification. Il donne une estimation du risque de décès à un et dix ans.
Nutrition
Le cancer peut être à l’origine d’un déséquilibre de la balance énergétique : élévation du métabolisme de base, douleur chronique, fatigue, anorexie, dysphagie…
La dénutrition est un facteur de risque indépendant de mortalité et de complications et, en contexte chirurgical, de complications postopératoires.9
Elle se dépiste principalement par la mesure de paramètres anthropométriques (comme le poids et surtout sa variation), et sa sévérité est établie par des dosages sériques (albumine, préalbumine) et par des scores validés en population gériatrique (MNA : mini nutritional assessment).**
Toute dénutrition doit être corrigée en préopératoire en prenant garde au syndrome de renutrition inapproprié par lequel la population âgée est particulièrement concernée.
Cognition et état psychique
Le dépistage des troubles cognitifs et psychiques est fondamental avant toute intervention.
Le déficit cognitif et le syndrome confusionnel sont plus fréquents chez le sujet âgé et impactent le pronostic. Ils sont à l’origine d’un retard diagnostique, d’un défaut de compréhension du plan de soin et d’un retard de prise en charge des complications postopératoires. Par ailleurs, ils peuvent soulever un problème éthique chez des malades ayant des capacités décisionnelles limitées ou difficiles à évaluer.
De leur côté, les altérations psychiques passent souvent inaperçues chez le sujet âgé. La dépression est un facteur indépendant de mortalité et de complications postopératoires, ainsi qu’un facteur d’isolement social et de perte d’autonomie.10
Prescriptions médicamenteuses
L’ordonnance du patient – reflet de ses comorbidités – doit être analysée avec soin. Cette étape est réalisée de concert avec l’anesthésiste-réanimateur, qui optimise les traitements en fonction de la chirurgie et du mode d’anesthésie choisi.
Décision finale
Cette liste n’est pas exhaustive (étude des déficits sensoriels, recherche de troubles de la continence, évaluation sociale…) mais reflète l’importance de l’évaluation gériatrique préopératoire.
L’évaluation gériatrique a trois intérêts principaux : établir un rapport bénéfice-risque des différentes options thérapeutiques, optimiser l’état de santé du patient, et limiter la perte d’autonomie et la décompensation de morbidités.
La décision finale d’opérer (« OK chirurgie ») repose sur une concertation entre chirurgien, gériatre et anesthésiste et place les préférences du patient au centre de la discussion.
Optimisation de la prise en charge chirurgicale : l’exemple du cancer de la vessie infiltrant le muscle
En France, 70 % des tumeurs de vessie sont diagnostiquées au stade de tumeur n’infiltrant pas le muscle (TVNIM), 20 % au stade infiltrant le muscle (TVIM) sans extension métastatique et 5 à 10 % au stade d’emblée métastatique.11 Cette distribution de stades mais aussi de pronostic varie en fonction de l’âge, avec une fréquence plus élevée de tumeurs infiltrantes chez les sujets âgés et donc à pronostic défavorable.12
Le traitement chirurgical de référence de la TVIM est la cystectomie (cystoprostatectomie chez l’homme, pelvectomie antérieure chez la femme) avec curage ganglionnaire pelvien et dérivation urinaire à l’aide d’un greffon intestinal (dérivation de Bricker ou entérocystoplastie).13 C’est un acte chirurgical long et complexe : lourd pour le patient âgé et non dénué de risques, compliqué d’une morbidité et d’une mortalité plus élevées que dans la population jeune.14 Il ne faut cependant pas priver les sujets âgés (souffrant déjà d’un retard diagnostique et thérapeutique) de l’accès à une chirurgie curatrice. La TVIM est une urgence oncologique !
Récupération améliorée après chirurgie
La prise en charge de patients âgés atteints de TVIM passe par des évaluations gériatrique et anesthésique systématisées. Les patients sont inclus dans des protocoles de récupération améliorée après chirurgie (RAAC), véritables processus d’optimisation périopératoire qui se déroulent en trois étapes.
Étape préopératoire
Il s’agit d’évaluer les fragilités du patient et d’équilibrer ses morbidités compétitives. L’objectif est d’anticiper le devenir du patient en prévoyant les suites postopératoires. Dans une étude non restreinte au cancer de vessie, l’évaluation gériatrique modifiait la prise en charge initialement proposée par la réunion de concertation pluridisciplinaire (RCP) oncologique dans 20 % des cas.15 La mise en place des mesures correctives en lien avec les domaines gériatriques altérés réduirait la morbimortalité périopératoire. Le protocole de RAAC est spécifique à la chirurgie et insiste sur des domaines particuliers : information du patient (bénéfices et risques de la chirurgie), lutte contre la sarcopénie, immunonutrition, optimisation du jeûne et charge glucidique préopératoire, thromboprophylaxie… (tableau).
Étape peropératoire
Cette étape concerne à la fois la chirurgie en elle-même et l’anesthésie.
Chaque fois que faire se peut, la voie mini-invasive doit être favorisée par rapport à la voie ouverte. De même, le drainage pelvien doit être limité dans ses indications et sa durée.
Concernant l’anesthésie, toutes les mesures sont détaillées dans le tableau : lutte contre l’hypothermie, optimisation de la volémie, emploi d’une ventilation artificielle protectrice, anesthésie locorégionale, prévention des nausées et des vomissements…
Étape postopératoire
Cette phase est marquée par le lever et la réalimentation précoces, la lutte contre l’iléus paralytique (mastication de chewing-gum), la prescription d’une analgésie multimodale évitant les morphiniques, une thromboprophylaxie, le dépistage et la prévention d’une confusion post-opératoire...
Alternative à la cystectomie : organ-sparing strategy
Si le patient est récusé pour la chirurgie, il est possible de lui proposer une alternative thérapeutique qui consiste en une radio-chimiothérapie concomitante. Les résultats de ce traitement trimodal (radiothérapie, chimiothérapie et résection endoscopique de vessie) semblent comparables à ceux du traitement chirurgical chez les sujets âgés.16 Toutefois, les études ont été menées chez des patients sélectionnés, éligibles à la chimiothérapie et présentant des tumeurs peu agressives. Sur une cohorte de plus de 1 300 patients âgés de plus de 80 ans traités par radiothérapie seule ou radio-chimiothérapie concomitante, Korpics et al. ont montré l’infériorité de la radiothérapie isolée, avec une survie globale de 42 % vs 56 % à deux ans.17 Le traitement trimodal doit donc être réservé aux patients pouvant recevoir une chimiothérapie, tandis que la radiothérapie isolée s’inscrit dans une démarche palliative ou à visée symptomatique.
Adaptation des protocoles
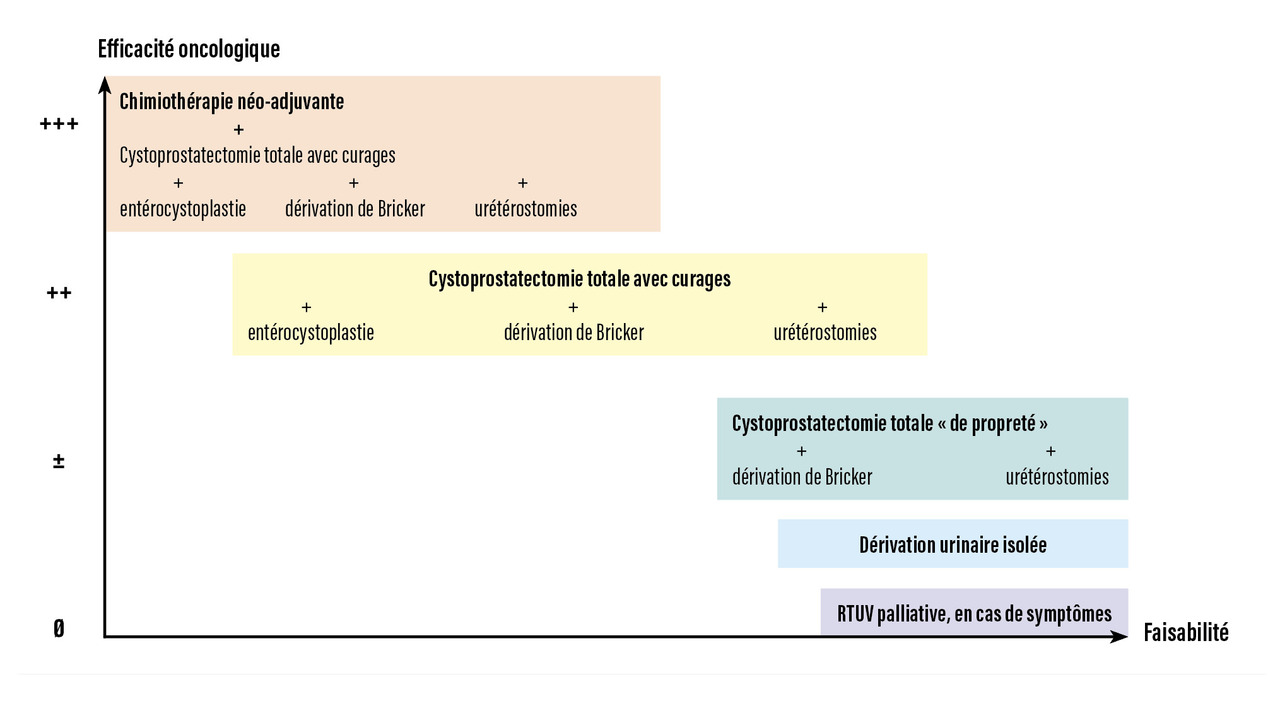
Chez le sujet âgé, le traitement de référence de la TVIM localisée – cystectomie précédée d’une chimiothérapie – peut nécessiter une adaptation aux capacités physiologiques de l’individu (figure).
Place de la chimiothérapie néoadjuvante
La chimiothérapie néoadjuvante dans les TVIM est une combinaison de molécules à base de sels de platine. L’éligibilité à cette chimiothérapie est dictée par les contre-indications au cisplatine, essentiellement l’insuffisance rénale (débit de filtration glomérulaire inférieur à 50 - 60 mL/min) et l’insuffisance cardiaque ne permettant pas l’hyper-hydratation.
Si le patient est fragile et jugé « unfit » à un protocole de chimiothérapie néoadjuvante optimal, les recommandations préconisent de réaliser une cystectomie seule.13 Il n’existe pas de données fiables quant à l’efficacité et la tolérance des chimiothérapies à base de sels de platine chez le sujet de plus de 70 ans, mais il est licite de penser que les patients âgés sont « plus à risque » en raison de leurs comorbidités. Par ailleurs, il a été montré que le pronostic des patients recevant une chimiothérapie néoadjuvante sans cisplatine est équivalent à celui des patients ne recevant pas de chimiothérapie, grevé de la morbidité induite par la chimiothérapie.18 La chimiothérapie périopératoire peut donc être omise chez les patients fragiles atteints de TVIM.
La question du curage ganglionnaire
Dans la population âgée, un patient inéligible à la chimiothérapie perdrait l’avantage pronostique conféré par le curage étant donné qu’il ne peut pas recevoir de chimiothérapie s’il présente des métastases ganglionnaires. En revanche, la valeur thérapeutique du curage ganglionnaire a été démontrée19 et justifie sa réalisation d’autant plus qu’aucune chimiothérapie ne sera proposée. L’impact de la lymphadénectomie chez le sujet âgé a été peu étudié mais ne semble pas augmenter la morbidité postopératoire. Il faut donc la réaliser quel que soit l’âge du patient.
Éviter un geste digestif ?
La dérivation des urines après cystectomie est rendue nécessaire par la suppression du réservoir vésical. Elle peut être réalisée soit par abouchement des uretères directement à la peau (urétérostomies cutanées), soit par interposition d’un segment iléal (urétérostomies transiléales de type Bricker), soit par remplacement vésical orthotopique à base d’intestin grêle ou de côlon (entérocystoplastie).13
Il n’existe aucun essai randomisé concluant à la supériorité d’une technique par rapport à une autre en ce qui concerne la sécurité carcinologique, les complications postopératoires ou la qualité de vie.14 L’interposition d’un segment d’intestin augmente toutefois la complexité et la durée de l’acte opératoire, et impose une remise en continuité du système digestif susceptible de fistuliser, notamment chez un patient âgé, comorbide et dénutri. Il convient donc de choisir le mode de dérivation urinaire avec précaution, en informant le patient des bénéfices attendus et des risques.
Savoir remettre en cause l’indication de cystectomie
Chez un patient très fragile présentant une tumeur à l’origine d’une obstruction urétérale, une dérivation urinaire exclusive sans extraction de la pièce tumorale est discutable. Cette option peut être envisagée chez des patients inéligibles à la cystectomie (du fait d’un risque anesthésique ou chirurgical trop important) avec une tumeur localisée et cliniquement asymptomatique, chez qui le drainage du haut appareil par voie endo-urinaire (sondes JJ) ou percutanée (sondes de néphrostomie) semble inenvisageable.
Chirurgie mini-invasive
Contrairement aux idées reçues, l’abord mini-invasif (laparoscopie plus ou moins assistée par robot) n’a pas pour unique but de diminuer la taille des incisions cutanées. Il s’agit d’une véritable volonté de réduction des dommages induits à l’organisme et du stress physique qui en découle. Plusieurs études de fort niveau de preuve ont montré l’avantage des techniques mini-invasives sur la réduction du saignement peropératoire, de la douleur postopératoire, des durées de séjour, et surtout des complications postopératoires et de la mortalité à trente jours.20 Chez les patients âgés, réduire le stress induit par une chirurgie morbide pourrait éviter de décompenser un état fragile et de franchir le seuil « d’insuffisance » à l’origine de la cascade gériatrique parfois létale.
Adapter la prise en charge périopératoire
L’âge seul ne doit pas faire remettre en cause les principes carcinologiques de la chirurgie oncologique chez le sujet âgé. Ces patients doivent plutôt bénéficier d’une chirurgie adaptée à leur réserve fonctionnelle et réalisée dans des conditions adéquates, c’est-à-dire avec une prise en charge périopératoire optimisée. Ce parcours de soins fait appel à de nombreux intervenants, dont le gériatre, qui tient un rôle primordial, tout au long du parcours de soin.
2. Organisation mondiale de la santé. Rapport mondial sur le vieillissement et la santé. 29 septembre 2015. https://urls.fr/GygR8S
3. Institut national du cancer (INCa). Plateforme de données en cancérologie. Rapport publié par l’INCa en 2017. http://lesdonnees.e-cancer.fr/.
4. De Angelis R, Sant M, Coleman MP, et al. Cancer survival in Europe 1999–2007 by country and age: Results of EUROCARE-5—a population-based study. Lancet Oncol 2014;15(1):23-34.
5. Campisi J. Cancer and ageing: Rival demons? Nat Rev Cancer 2003;3(5):339-49.
6. Soto-Perez-de-Celis E, Li D, Yuan Y, et al. Functional versus chronological age: Geriatric assessments to guide decision making in older patients with cancer. Lancet Oncol 2018;19(6):e305-16.
7. Pamoukdjian F, Paillaud E, Zelek L, et al. Measurement of gait speed in older adults to identify complications associated with frailty: A systematic review. J Geriatr Oncol 2015;6(6):484-96.
8. Charlson ME, Pompei P, Ales KL, MacKenzie CR. A new method of classifying prognostic comorbidity in longitudinal studies: Development and validation. J Chronic Dis 1987;40(5):373-83.
9. Caillet P, Liuu E, Raynaud Simon A, et al. Association between cachexia, chemotherapy and outcomes in older cancer patients: A systematic review. Clin Nutr 2017;36(6):1473-82.
10. Weiss Wiesel TR, Nelson CJ, Tew WP, et al. The relationship between age, anxiety, and depression in older adults with cancer: Age, anxiety, and depression in geriatric oncology. Psychooncology 2015;24(6):712-7.
11. Belot A, Grosclaude P, Bossard N, et al. Cancer incidence and mortality in France over the period 1980–2005. Rev Epidémiol Sante Publique 2008;56(3):159-75.
12. Fonteyne V, Ost P, Bellmunt J, et al. Curative treatment for muscle Invasive bladder cancer in elderly patients: A systematic review. Eur Urol 2018;73(1):40-50.
13. Neuzillet Y, Audenet F, Loriot Y, et al. French AFU cancer committee guidelines – Update 2022–2024: Muscle-invasive bladder cancer (MIBC). Prog Urol 2022;32(15):1141-63.
14. Neuzillet Y, Geiss R, Paillaud E, et al. Optimisation de la prise en charge du cancer de la vessie chez les patients âgés. Prog Urol 2019;29(14):849-64.
15. Caillet P, Canoui-Poitrine F, Vouriot J, et al. Comprehensive geriatric assessment in the decision-making process in elderly patients with cancer: ELCAPA study. J Clin Oncol 2011;29(27):3636-42.
16. Arcangeli G, Strigari L, Arcangeli S. Radical cystectomy versus organ-sparing trimodality treatment in muscle-invasive bladder cancer: A systematic review of clinical trials. Crit Rev Oncol Hematol 2015;95(3):387-96.
17. Korpics MC, Block AM, Martin B, et al. Concurrent chemotherapy is associated with improved survival in elderly patients with bladder cancer undergoing radiotherapy. Cancer 2017;123(18):3524-31.
18. Hinata N, Hussein AA, George S, et al. Impact of suboptimal neoadjuvant chemotherapy on peri-operative outcomes and survival after robot-assisted radical cystectomy: A multicentre multinational study. BJU Int 2017;119(4):605-11.
19. Grabbert M, Grimm T, Buchner A, et al. Risks and benefits of pelvic lymphadenectomy in octogenarians undergoing radical cystectomy due to urothelial carcinoma of the bladder. Int Urol Nephrol 2017;49(12):2137-42.
20. Johnston ME, Sussman JJ, Patel SH. Surgical oncology and geriatric patients. Clin Geriatr Med 2019;35(1):53-63.