Le cancer est une maladie liée à l’âge. Environ 50 % des nouveaux cas de cancer sont diagnostiqués au-delà de 65 ans, avec une incidence qui peut varier selon le type de cancer, comme dans le cas des cancers urothéliaux dont la médiane d’âge au diagnostic est de 73 ans ou les cancers bronchiques, à 71 ans.1 Cette incidence devrait encore augmenter dans les prochaines décennies, avec une estimation de + 87 % en 2050 au-delà de 80 ans en Europe, représentant 1 327 800 nouveaux cas de cancer.2
La gestion des traitements antitumoraux peut être complexe après l’âge de 70 ans, et elle dépend des fragilités, des comorbidités, de l’autonomie et de l’espérance de vie des patients. Définir le bon traitement et le bon schéma pour chaque patient est le but de l’évaluation oncogériatrique, qui permet d’établir une prise en charge personnalisée et optimisée en diagnostiquant les fragilités. L’âge chronologique per se ne doit pas être une barrière aux traitements. Un patient ayant un vieillissement harmonieux sans comorbidité ou fragilité est éligible aux traitements recommandés.
L’un des plus importants obstacles à la construction de recommandations solides dans la prise en charge des personnes âgées atteintes de cancer repose sur le faible nombre de patients inclus dans les essais cliniques et l’hétérogénéité de cette population. Les patients âgés ont ainsi une moins bonne survie relative liée au cancer que les autres groupes d’âge et ne bénéficient pas autant des avancées réalisées dans la recherche ces dernières années.3
La prise en charge de cette population requiert des spécificités concernant les trois grands traitements antitumoraux que ce sont la chimiothérapie, les traitements ciblés et l’immunothérapie.
Spécificités de la prise en charge d’un patient âgé atteint de cancer
Score de dépistage G8
Le questionnaire G8 est un outil de dépistage gériatrique qui permet d’identifier, parmi les patients âgés atteints de cancer, ceux qui devraient bénéficier d’une évaluation gériatrique (tableau 1 de l’article « Influence de l’âge sur la prise en charge en oncologie », p. 40). Un score inférieur ou égal à 14 révèle une vulnérabilité ou une fragilité gériatrique devant conduire à une consultation adaptée. Cet outil a été validé dans le cadre de l’essai ONCODAGE promu par l’Institut national du cancer (INCa). L’étude retenue a comparé en aveugle l’évaluation gériatrique, considérée comme le gold standard mais très consommatrice de temps et de moyens, à un nouvel outil de dépistage gériatrique simple composé de huit items, l’outil ONCODAGE. L’étude multicentrique a inclus 1 674 patients dont 1 597 éligibles (âge moyen : 78,2 ans). La sensibilité du G8 était de 76,5 % et sa spécificité de 64,4 %.4 Le score G8 est rapide à réaliser (temps moyen inférieur à dix minutes). La généralisation de son utilisation est inscrite dans l’action 23.4 du Plan cancer 2009 - 2013.
Évaluation gériatrique
L’évaluation gériatrique est un processus multidimensionnel et pluridisciplinaire qui permet d’identifier l’ensemble des problèmes médicaux fonctionnels, psychosociaux et les fragilités gériatriques des patients âgés lors de la prise en charge oncologique. Elle a ainsi pour but de :
- dépister et traiter les syndromes gériatriques (dénutrition protéino-énergétique, déshydratation, chutes répétées, confusion mentale, troubles cognitifs chroniques [démences], dépression, perte d’indépendance fonctionnelle, escarres de pression) ;
- intégrer les paramètres gériatriques en lien avec le projet oncologique afin d’établir un projet de soins personnalisé adapté à la prise en charge globale ;
- réaliser le traitement le plus approprié, en tenant compte du rapport bénéfice/risque et de la qualité de vie ;
- intégrer le patient âgé dans la filière de soins oncologiques et gériatriques ;
- assurer un suivi des mesures proposées (médecin gériatre, infirmier en pratique avancée [IPA], infirmier diplômé d’État [IDE] de coordination).
Plusieurs échelles sont utilisées pour évaluer ces différents paramètres et peuvent varier en fonction des évaluateurs :
1. Évaluation de l’état général :
- Performance Status (ECOG-PS) ;
- évaluation des comorbidités : Cumulative Illness Rating Scale – Geriatrics (CIRS-G) [échelle de référence] ;
- score de Charlson (intérêt rétrospectif) ;
2. État fonctionnel ADL-IADL (plus facile rétrospectivement mais peu pertinent par manque d’évaluation des comorbidités les plus fréquentes) :
- échelle des activités de la vie quotidienne (Activities of Daily Living : ADL) et indice de Katz ;
- évaluation de l’autonomie aux activités instrumentales de la vie quotidienne (Instrumental ADL : IADL) et échelle de Lawton.
3. Évaluation de la prise médicamenteuse et des interactions potentielles avec le projet oncologique.
4. Évaluation sociale.
5. Évaluation cognitive :
- Mini Mental State Examination (MMSE) ;
- test de l’horloge ;
- épreuve des cinq mots de Dubois ;
- Mini-Cog.
6. Repérage des troubles de l’humeur :
- Mini Geriatric Depression Scale (GDS) ;
- échelle de dépression gériatrique (GDS).
7. Évaluation des troubles de la marche :
- appui monopodal ;
- Timed Get Up and Go ;
- épreuve de Tinetti statique et dynamique ;
- vitesse de marche.
8. Évaluation nutritionnelle :
- critères anthropométriques : poids, taille, indice de masse corporelle (IMC)... ;
- Mini-Nutritional Assessment (MNA) ;
- critères biologiques : albumine, préalbumine, protéine C réactive (CRP)... ;
- enquête diététique ;
- évaluation de l’état bucco-dentaire.
Les résultats de cette évaluation sont nécessaires en théorie pour la présentation du dossier en réunion de concertation pluridisciplinaire (RCP) afin d’affiner la proposition thérapeutique.
Chimiothérapie
Principe d’action et nouveaux médicaments
La chimiothérapie agit sur les mécanismes de division des cellules. Les différentes molécules agissent soit directement sur l’ADN (sels de platine, alkylants), soit sur la synthèse de l’ADN (les antimétabolites tels que 5 -FU/capécitabine, pémétrexed et les inhibiteurs de la topo-isomérase comme l’irinotécan), sur la duplication de l’ADN (agents intercalants comme les anthracyclines) ou sur la mitose (poisons du fuseau tels que les taxanes, la vinorelbine).
Chez les patients âgés, la diminution de la fonction rénale et hépatique mais aussi la dénutrition/sarcopénie, l’anémie et la polymédication peuvent modifier l’exposition aux cytotoxiques et augmenter leur toxicité.
Certaines molécules ont des profils de tolérance plus mauvais chez les patients âgés (anthracyclines, docétaxel) et doivent être évitées lorsqu’il existe des alternatives. Les protocoles associant bi- voire tri-chimiothérapie avec éventuellement une thérapie ciblée sont plus toxiques, et des adaptations de doses sont nécessaires comme expliqué ci-dessous.
Les conjugués anticorps-médicaments, ou en raccourci anticorps conjugués (antibody-drug conjugates), font partie des nouveaux traitements anticancéreux, avec plusieurs autorisations de mise sur le marché (AMM). Il s’agit d’un anticorps (traitement « ciblé » contre une caractéristique spécifique tumorale) sur lequel est attaché par un linker (agent de liaison) un agent de chimiothérapie. Cela permet de mieux libérer ce dernier au niveau de la tumeur et de limiter sa toxicité sur les cellules saines n’exprimant pas ou peu la caractéristique spécifique tumorale ciblée par l’anticorps. En pratique clinique, le profil de tolérance reste pourtant celui d’une chimiothérapie avec une toxicité digestive et hématologique non nulle (par exemple 50 % de toxicité de grade ≥ 3 pour le sacituzumab govitécan) ainsi que des toxicités plus spécifiques, par exemple des pneumopathies interstitielles survenant sous trastuzumab déruxtécan, parfois d’évolution fatale.
Treize molécules ont une AMM octroyée par la Food and Drug Administration (FDA) ou l’European Medicine Agency (EMA) dans différents cancers solides et hématologiques.
Il n’existe à ce jour pas de données spécifiques sur la tolérance chez les sujets âgés.5
Score de prédiction de toxicité
Le risque de toxicité sévère (grade ≥ 3) de la chimiothérapie augmente de façon significative en cas d’altération d’un ou plusieurs domaines gériatriques repérés lors de l’évaluation oncogériatrique.
Il existe des scores incluant des variables carcinologiques, pharmacologiques mais également gériatriques pour prédire le risque de toxicité sévère et d’hospitalisation. Le CRASH score (Chemotherapy risk assessment scale for high-age patients) et le CARG score (Cancer and aging research group) permettent de prédire de façon plus fine que le performance status le risque de toxicité des chimiothérapies.6
Bien que ces scores soient peu utilisés dans la pratique clinique, ils sensibilisent les oncologues aux risques de toxicité élevés et peuvent amener à proposer une réduction de dose de chimiothérapie d’emblée. En effet, les toxicités sévères sont associées chez les patients âgés à une diminution de la qualité de vie, une perte d’autonomie, un risque augmenté d’hospitalisation, d’arrêt des traitements oncologiques et de décès précoce.7
Spécificités chez le sujet âgé
La neutropénie fébrile (NF) est une complication redoutée car potentiellement fatale. Le risque de mortalité de la NF augmente de façon très significative avec le nombre de comorbidités et peut atteindre plus de 20 % en cas comorbidités élevées. Il existe des recommandations de la Société européenne d’oncologie médicale (ESMO) de prophylaxie primaire par facteurs de croissance des globules blancs (G-CSF) en cas de risque de NF supérieur à 20 % et de risque de NF entre 10 et 20 % en cas de comorbidités ou d’âge supérieur à 65 ans.8 L’utilisation d’une prophylaxie primaire permet de diminuer très significativement le risque de NF et d’hospitalisation chez les patients âgés recevant une chimiothérapie à risque élevé ou intermédiaire de NF. Cependant, le risque de NF est bien souvent sous-estimé dans la population âgée, avec des combinaisons associant des anthracyclines ou du carboplatine et même pour certaines monothérapies, par exemple en cas d’utilisation du docétaxel. Compte tenu des risques de décès liés à cette complication évitable, la prescription de G-CSF doit être facilitée dans cette population fragile.
De grandes études de phase III comparant traitement oncologique standard versus traitement oncologique guidé par l’évaluation gériatrique ont été publiées et apportent un niveau de preuve élevé à l’utilité de l’approche oncogériatrique pour améliorer la tolérance, la qualité de vie, la satisfaction des patients âgés, leur communication avec les soignants lors d’une chimiothérapie, généralement au travers d’interventions gériatriques précises (soutien nutritionnel, kinésithérapie, pré-habilitation, etc.) et d’une réduction de dose d’emblée de la chimiothérapie (parfois suivie d’une escalade prudente pour tenter d’atteindre la dose d’AMM), sans réduire son efficacité.9,11
Par exemple, l’étude GAP 70 + a mesuré l’apport d’une évaluation gériatrique à un soin courant et a démontré une diminution de 20 % des toxicités sévères sans baisse de la survie globale chez les patients âgés avec un cancer solide ou hématologique avancé dans le bras interventionnel.9
L’étude GO2 a comparé, quant à elle, dans les cancers digestifs hauts chez des patients âgés et fragiles, une dose standard à une diminution de dose d’une bichimiothérapie (oxaliplatine et capécitabine) de - 20 % et - 40 %. Aucune diminution du contrôle tumoral n’a été observée (non-infériorité démontrée en survie sans progression et également en survie globale), mais cette réduction de dose était associée à une diminution significative de la toxicité.12
Il convient donc, chez les patients âgés présentant une ou des fragilités gériatriques, de prévoir des soins de support (G-CSF) et un ajustement des doses, notamment en cas de polychimiothérapie, afin d’améliorer la tolérance sans compromettre l’efficacité des cytotoxiques.
Lorsque le risque de toxicité ou de mauvaise tolérance est trop important chez des patients très fragiles et en particulier avec des tumeurs au pronostic sombre, la question se pose du bénéfice attendu de la chimiothérapie pour le médecin mais surtout pour le patient (qualité de vie, autonomie, survie…). Il est important que ces décisions complexes soient discutées de manière multidisciplinaire et avec le patient.
Chimiothérapie adjuvante chez le sujet âgé
L’objectif de la chimiothérapie adjuvante est de diminuer le risque de récidive de la maladie après un traitement locorégional. Le bénéfice attendu de cette chimiothérapie est variable selon le cancer primitif, son stade et les facteurs pronostiques. Il est important de noter que le bénéfice absolu de la chimiothérapie adjuvante diminue souvent avec l’âge.13 La toxicité de la chimiothérapie dépend, quant à elle, des schémas réalisés et il faut garder à l’esprit qu’il peut exister un impact prolongé des traitements adjuvants, avec notamment un déclin fonctionnel et un retentissement sur les activités de la vie quotidienne.14Il existe peu d’études spécifiques chez les patients âgés et fragiles. Les résultats de l’étude PRODIGE 34 évaluant différents schémas de chimiothérapies adjuvantes dans le cancer du côlon, selon que les patients âgés sont fragiles ou non, sont attendus prochainement. Les premières données sur la tolérance de la moitié des patients montrent un surcroît de toxicité cumulative de haut grade chez les patients fragiles traités par 5 -FU seul comparé aux patients non fragiles recevant le même traitement. Ces patients fragiles étaient aussi plus à risque d’un arrêt précoce de la chimiothérapie adjuvante.15
Une évaluation oncogériatrique permet d’estimer plus finement l’espérance de vie attendue hors cancer, le risque de toxicité, notamment d’hospitalisation non programmée, et de déclin fonctionnel, et de mieux évaluer la balance bénéfice/risque des traitements proposés.
Traitements ciblés
Les traitements ciblés, au premier rang desquels figurent l’hormonothérapie pour le cancer du sein et de la prostate, ou l’anticorps monoclonal trastuzumab pour le cancer du sein avec surexpression de HER2, posent généralement moins de problèmes de maniement que la chimiothérapie d’action moins spécifique. Ciblant une anomalie surreprésentée (actionnable) dans le tissu tumoral, les traitements ciblés ont en théorie moins d’effets collatéraux sur les tissus sains. Néanmoins, ils ont aussi leurs effets indésirables ou peuvent être parfois utilisés couplés à la chimiothérapie, requérant des ajustements fréquents de dose : par exemple les inhibiteurs de cyclines CDK4/6 couplés à l’hormonothérapie du cancer du sein au stade précoce ou métastatique, pour qui près d’une patiente âgée sur quatre ou cinq débute son traitement à dose plus faible ou l’arrête plus vite en raison de problèmes de tolérance.16,17 Les ADC discutés plus haut en font partie partiellement, alliant anticorps (traitement ciblé) et chimiothérapie.
Immunothérapie
Mécanisme d’action
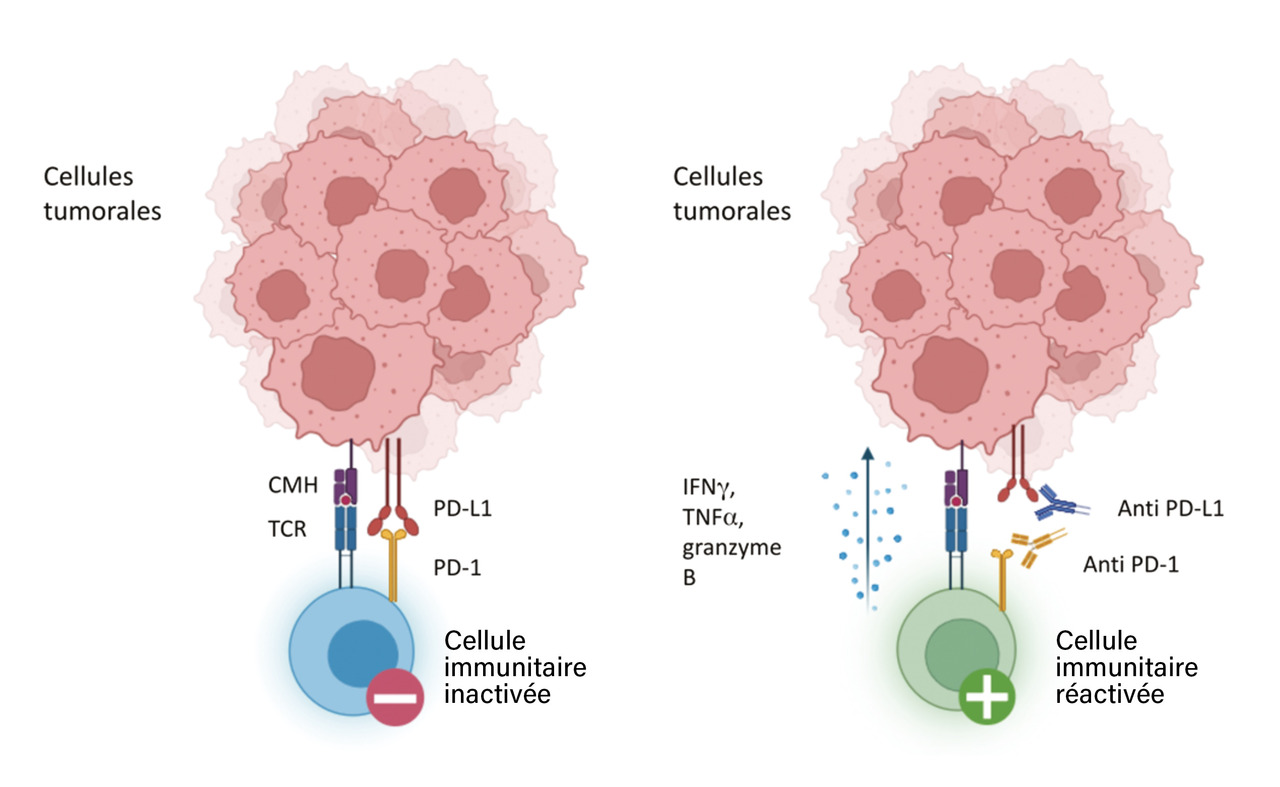
Un des multiples mécanismes d’échappement tumoral au système immunitaire repose sur la modulation des points de contrôle immunitaire. En effet, en situation d’immunosurveillance, le lymphocyte T CD8 cytotoxique joue un rôle clé. Il reconnaît de manière spécifique la cellule tumorale par le biais du complexe majeur d’histocompatibilité (CMH) qui présente l’antigène tumoral. L’interaction du récepteur du lymphocyte T (TCR) et de l’antigène tumoral présenté par le CMH entraîne l’activation du lymphocyte T CD8, la libération de cytokines, (interféron γ [IFNγ], TNF [facteur de nécrose tumorale] α, granzyme B), puis la lyse tumorale. L’interaction du récepteur programmed death 1 (PD- 1) avec son ligand, programmed death-ligand 1 (PD-L1), inhibe l’action du lymphocyte T CD8 et favorise alors l’échappement tumoral et sa prolifération (fig. 1). Les anti-PD1 ou anti-PD
L1 ont été développés pour lever ce rétrocontrôle inhibiteur et ainsi restaurer l’immunité antitumorale. L’objectif de ces traitements n’est plus de cibler directement la cellule tumorale mais la cellule immunitaire qu’est le lymphocyte pour restaurer ses capacités à détruire les cellules tumorales ; autrement dit, utiliser le système immunitaire du patient à visée antitumorale. D’autres points de contrôle du système immunitaire existent et sont également ciblés par des anticorps monoclonaux comme les anti-cytotoxic T-lymphocyte-associated protein 4 (CTLA4) ou les anti-lymphocyte-activation gene 3 (LAG3). Les inhibiteurs des points de contrôle immunitaire utilisés en oncologie sont détaillés dans le tableau 1. Leur prescription est souvent conditionnée par un test quantifiant la présence de la cible dans la tumeur : score positif combiné (CPS) ou tumor proportion score (TPS).
Efficacité
Les premiers résultats des études cliniques évaluant les inhibiteurs des points de contrôle immunitaire ont été présentés dans les années 2010, avec les réponses des phases I dans différents types de cancer.
Aujourd’hui, les inhibiteurs des points de contrôle immunitaire ont une AMM pour différents types tumoraux (tableau 2).
D’un point de vue clinique, l’âge chronologique n’a pas démontré d’impact sur l’efficacité des inhibiteurs des points de contrôle immunitaire. Un bénéfice similaire a été observé dans la plupart des essais cliniques à l’exception de CheckMate- 017 dans les cancers bronchiques non à petites cellules, CheckMate- 025 dans le cancer rénal, Keynote- 045 et 052 dans le carcinome urothélial en monothérapie.18 - 21 Dans ces études, les patients âgés présentaient de moins bonnes survie sans progression et survie globale.
Si l’âge chronologique n’affecte pas l’efficacité des inhibiteurs des points de contrôle immunitaire, l’impact de l’âge du système immunitaire apparaît comme plus prépondérant. En effet, une moins bonne réponse et une survie sans progression plus courte ont été observées chez des patients atteints de cancer bronchique non à petites cellules traités par inhibiteurs des points de contrôle immunitaire chez qui la proportion de lymphocytes T CD8 sénescents était supérieure de 39,5 % en comparaison aux patients traités par chimiothérapie.22 Chez des patients atteints de mélanome et traités par l’association pembrolizumab et ipilimumab ou par pembrolizumab seul, un taux élevé de lymphocytes T CD27 -CD28 -Tim- 3 CD57+ était associé à une survie globale plus courte.23
Tolérance
Le mécanisme d’action des inhibiteurs des points de contrôle immunitaire a révélé un nouveau profil d’effets indésirables liés à l’immunité, appelés effets indésirables immunomédiés (ESIM). Leur incidence varie selon le type de molécule et l’indication. Leur sévérité est évaluée par l’échelle NCI CTCAE (National Cancer Institute, common terminology criteria for adverse events) comme les autres événements indésirables (EI). Le CTCAE est divisé en cinq grades, chacun ayant une description médicale unique, et ce pour chaque terme, fondée sur les grandes lignes suivantes :
- grade 1 : léger ; asymptomatique ou symptômes légers ; diagnostic à l’examen clinique uniquement ; ne nécessitant pas de traitement ;
- grade 2 : modéré ; nécessitant un traitement minimal, local ou non invasif ; interférant avec les activités instrumentales de la vie quotidienne ;
- grade 3 : sévère ou médicalement significatif mais sans mise en jeu immédiate du pronostic vital ; indication à l’hospitalisation ou à la prolongation d’hospitalisation ; invalidant ; interférant avec les activités élémentaires de la vie quotidienne ;
- grade 4 : mise en jeu du pronostic vital ; nécessitant une prise en charge en urgence ;
- grade 5 : décès lié à l’EI.
Les inhibiteurs des points de contrôle immunitaire sont mieux tolérés d’un point de vue général que les chimiothérapies cytotoxiques, avec 10 % d’effets de grade 3 - 4 dans l’étude princeps du nivolumab dans le cancer bronchique non à petites cellules contre 54 % dans le bras taxotère.24 L’association du nivolumab et de l’ipilimumab reste plus toxique que la monothérapie, avec des incidences d’effets indésirables de haut grade autour de 50 à 60 % selon les études.25, 26
La particularité des ESIM repose sur leur diversité car ils peuvent toucher tous les organes et rarement être fatals. Les effets indésirables les plus fréquents sont la fatigue (20 %), le rash (15 %), les diarrhées (10 à 15 %), l’hypothyroïdie (5 à 10 %), les élévations de transaminases (5 %), les pneumopathies interstitielles ( 5 %). Les ESIM potentiellement fatals à détecter rapidement et survenant dans moins de 1 % des cas sont les suivants : la myocardite, les toxicités neurologiques (syndrome de Guillain-Barré, encéphalite, myélite), endocriniennes (insuffisance surrénale, diabète avec décompensation acidocétosique), hématologiques (anémie, thrombopénie, neutropénie), cutanées (drug reaction with eosinophilia and systemic symptoms [DRESS], syndrome de Stevens-Johnson), rénales (néphrite).
Le poids des comorbidités n’a pas été démontré comme étant associé à un surcroît de toxicité immunomédiée, à l’exception des maladies auto-immunes.27 Il n’existe pas de contre-indication à débuter un traitement par inhibiteur des points de contrôle immunitaire en cas de maladie contrôlée sous réserve d’une surveillance rapprochée avec le spécialiste d’organe.28
Les ESIM apparaissent le plus fréquemment autour de la dixième semaine, définie comme la période « chaude ». Les effets cutanés surviennent en général plus précocement durant le premier mois, puis les colites entre quatre et dix semaines, les dysthyroïdies à partir de la sixième semaine, les toxicités hépatiques de la sixième à la quinzième semaine, plus tardivement les pneumopathies interstitielles apparaissent à partir de la dixième semaine et enfin les néphrites après vingt semaines.29
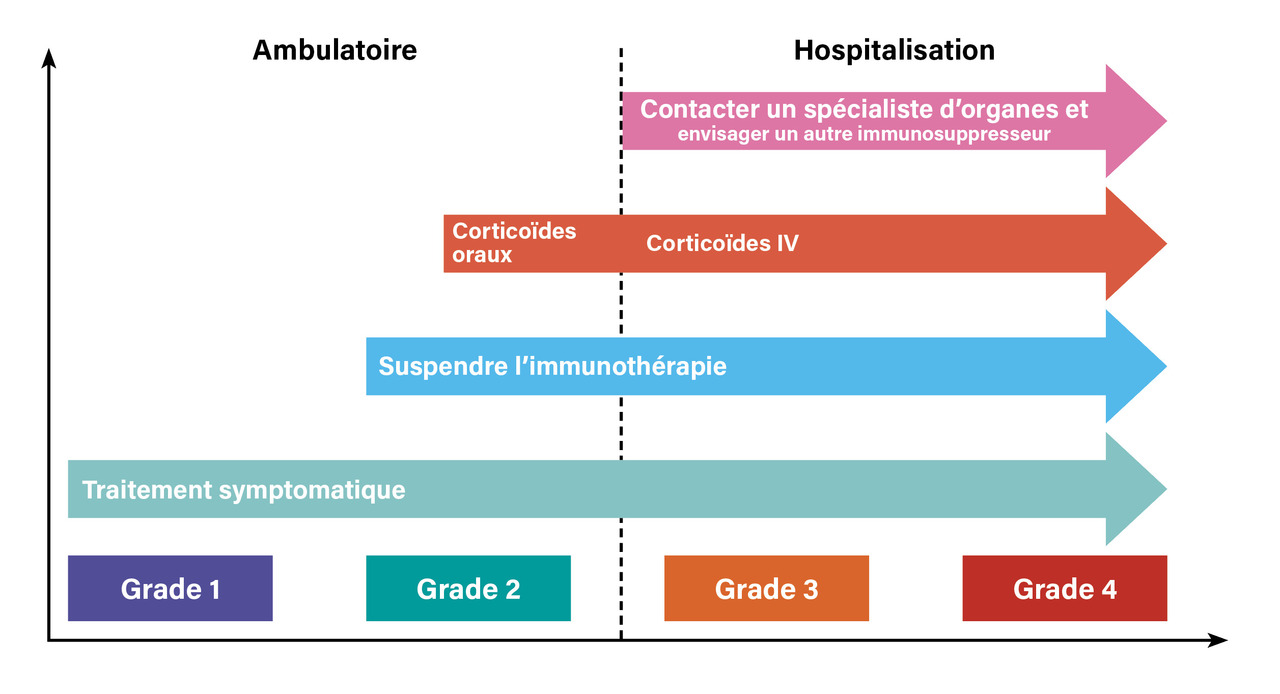
Les grands principes de prise en charge reposent sur le grade CTCAE, c’est-à-dire l’intensité de l’effet indésirable (fig. 2). Certaines prises en charge sont spécifiques de la toxicité comme pour les endocrinopathies et notamment les hypothyroïdies pour lesquelles l’introduction de la lévothyroxine se fait à partir d’une thyréostimuline (TSH) à 10 mUI/L. Les toxicités potentiellement fatales (cardiologiques, neurologiques ou hématologiques) nécessitent une prise en charge en urgence par des spécialistes d’organes entraînés et par bolus de corticoïdes intraveineux.30 Connaître un réseau de spécialistes expérimentés et disponibles est essentiel. Plusieurs RCP immunotox sont également organisées sur l’ensemble du territoire et recensées sur le site de la Société française d’immunothérapie du cancer (FITC). Elles permettent de discuter des prises en charge avant ou pendant le traitement, d’orienter les patients ou de discuter du retraitement.
En cas de toxicité, un retraitement est possible après discussion collégiale en RCP. Des études ont démontré qu’entre 30 et 50 % des patients « retraités » était à risque de faire un nouvel ESIM de grade identique ou inférieur sans impact sur leur survie.31 Les retraitements après un ESIM de grade 4, un événement neurologique ou cardiaque ne sont pas recommandés.
L’influence de l’âge sur la survenue d’ESIM a été évaluée sur des séries prospectives et rétrospectives, avec des résultats contradictoires. Tandis que certaines trouvent un surcroît d’ESIM avec l’âge, notamment au-delà de 80 ans, d’autres observent des taux d’incidence similaires en monothérapie quel que soit l’âge.32,33 Quelques études ont intégré les paramètres gériatriques en prospectif ou en rétrospectif.34 Seules deux études ont retrouvé un impact potentiel de la fragilité. Dans la première étude, le score de fragilité construit sur l’association de l’âge, de l’indice de Charlson et de l’ECOG performance status était associé à un plus grand risque d’ESIM quel que soit le grade et à des événements multiples.35 Dans une autre étude, les facteurs de risque associés aux ESIM étaient l’aire de mobilité, prenant en compte les interactions de la personne avec son environnement ainsi que la dépression.36 Aucune donnée ne rapporte de façon significative des différences de type d’ESIM en fonction de l’âge.
Recommandations de prise en charge
Les patients âgés nécessitent une surveillance rapprochée quel que soit le traitement instauré, notamment au niveau cardiovasculaire.37 En effet, la survenue d’une myocardite immunomédiée était associée de façon significative à un âge supérieur ou égal à 75 ans dans une analyse sur plus de 13 000 cas aux États-Unis.38
Le bilan minimal à l’instauration et en cours de traitement est résumé dans le tableau 3.
Les inhibiteurs des points de contrôle immunitaire ont démontré leur efficacité et sont la pierre angulaire du traitement dans de nombreux types de cancer en monothérapie ou en combinaison. Il n’existe pas de contre-indication à leur utilisation en fonction de l’âge, avec cependant la nécessité d’un suivi rapproché.
Adapter les traitements médicaux selon toutes les facettes du patient
L’implémentation des traitements systémiques dans la population âgée nécessite une prise en charge adaptée non seulement au cancer mais également au patient dans toutes ses dimensions. L’apport de l’évaluation gériatrique a démontré son efficacité pour améliorer la tolérance et la qualité de vie des patients sous chimiothérapie. Par extension, elle est recommandée avant l’instauration de tout traitement systémique, notamment en cas de G8 anormal. Elle montre bien que l’intensité du traitement du cancer, en particulier le traitement médicamenteux systémique, ne peut pas être la même que celle utilisée chez l’adulte plus jeune, chez qui le traitement a été développé et extrapolé sans guide chez le plus âgé, mais plutôt adaptée au niveau de fragilité que repère l’évaluation gériatrique.
2. Pilleron S, Soto-Perez-de-Celis E, Vignat J, et al. Estimated global cancer incidence in the oldest adults in 2018 and projections to 2050. Int J Cancer2021;148(3):601‑8.
3. Arnold M, Rutherford MJ, Bardot A, et al. Progress in cancer survival, mortality, and incidence in seven high-income countries 1995-2014 (ICBP SURVMARK-2): A population-based study. Lancet Oncol 2019;20(11):1493‑505.
4. Soubeyran P, Bellera C, Goyard J, et al. Screening for vulnerability in older cancer patients: The ONCODAGE prospective multicenter cohort study. PloS One 2014;9(12):e115060.
5. Rached L, Geraud A, Frelaut M, et al. Antibody drug conjugates in older patients: State of the art. Crit Rev Oncol Hematol 2024;193:104212.
6. Extermann M, Boler I, Reich RR, et al. Predicting the risk of chemotherapy toxicity in older patients: The chemotherapy risk assessment scale for high-age patients (CRASH) score. Cancer 2012;118(13):3377‑86.
7. Scotte F, Bossi P, Carola E, et al. Addressing the quality of life needs of older patients with cancer: A SIOG consensus paper and practical guide. Ann Oncol 2018;29(8):1718‑26.
8. Klastersky J, de Naurois J, Rolston K, et al. Management of febrile neutropaenia: ESMO clinical practice guidelines. Ann Oncol 2016;27(suppl 5):v111‑8.
9. Mohile SG, Mohamed MR, Xu H, et al. Evaluation of geriatric assessment and management on the toxic effects of cancer treatment (GAP70+): A cluster-randomised study. Lancet Lond Engl 2021;398(10314):1894‑904.
10. Li D, Sun CL, Kim H, et al. Geriatric Assessment-Driven Intervention (GAIN) on chemotherapy-related toxic effects in older adults with Cancer: A randomized clinical trial. JAMA Oncol 2021;7(11):e214158.
11. Soo WK, King MT, Pope A, et al. Integrated Geriatric Assessment and Treatment Effectiveness (INTEGERATE) in older people with cancer starting systemic anticancer treatment in Australia: A multicentre, open-label, randomised controlled trial. Lancet Healthy Longev 2022;3(9):e617-e627.
12. Hall PS, Swinson D, Cairns DA, et al. Efficacy of reduced-intensity chemotherapy with oxaliplatin and capecitabine on quality of life and cancer control among older and frail patients with advanced gastroesophageal cancer: The GO2 phase 3 randomized clinical Trial. JAMA Oncol 2021;7(6):869‑77.
13. Gbolahan OB, Zhi X, Liu Y, et al. Adjuvant chemotherapy and outcomes in older adult patients with biliary tract cancer. JAMA Netw Open 2024;7(1):e2351502.
14. Adesoye T, Liao KP, Peterson S, et al. Patient-reported outcomes in older breast cancer survivors with and without prior chemotherapy treatment. Cancer Med 2023;12(17):17740‑52.
15. Aparicio T, Bouche O, Etienne PL, et al. Preliminary tolerance analysis of adjuvant chemotherapy in older patients after resection of stage III colon cancer from the PRODIGE 34-FFCD randomized trial. Dig Liver Dis 2023;55(4):541-8.
16. Carola E, Pulido M, Falandry C, et al. First-line systemic treatment with palbociclib in women aged ≥70 years presenting with hormone receptor-positive advanced breast cancer: Results from the PALOMAGE program. J Clin Oncol 2023;41:1018.
17. Hamilton E, Hyun Kim J, Eigeliene N, et al. Efficacy and safety results by age in monarchE: Adjuvant abemaciclib combined with endocrine therapy (ET) in patients with HR+, HER2-, node-positive, high-risk early breast cancer (EBC). J Clin Oncol 2023;41:501.
18. Balar AV, Castellano D, O’Donnell PH, et al. First-line pembrolizumab in cisplatin-ineligible patients with locally advanced and unresectable or metastatic urothelial cancer (KEYNOTE-052): A multicentre, single-arm, phase 2 study. Lancet Oncol 2017;18(11):1483‑92.
19. Brahmer J, Reckamp KL, Baas P, et al. Nivolumab versus docetaxel in advanced squamous-cell non-small-cell lung cancer. N Engl J Med 2015;373(2):123‑35.
20. Motzer RJ, Escudier B, McDermott DF, et al. Nivolumab versus everolimus in advanced renal-cell carcinoma. N Engl J Med 2015;373(19):1803‑13.
21. Bellmunt J, de Wit R, Vaughn DJ, et al. Pembrolizumab as second-line therapy for advanced urothelial carcinoma. N Engl J Med 2017;376(11):1015‑26.
22. Ferrara R, Naigeon M, Auclin E, et al. Circulating T-cell immunosenescence in patients with advanced non-small cell lung cancer treated with single-agent PD-1/PD-L1 inhibitors or platinum-based chemotherapy. Clin Cancer Res 2021;27(2):492‑503.
23. Moreira A, Gross S, Kirchberger MC, et al. Senescence markers: Predictive for response to checkpoint inhibitors. Int J Cancer 2019;144(5):1147‑50.
24. Borghaei H, Paz-Ares L, Horn L, et al. Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer. N Engl J Med 2015;373(17):1627‑39.
25. Callahan MK, Kluger H, Postow MA, et al. Nivolumab plus ipilimumab in patients with advanced melanoma: Updated survival, response, and safety data in a phase I dose-escalation study. J Clin Oncol 2018;36(4):391‑8.
26. Wolchok JD, Chiarion-Sileni V, Gonzalez R, et al. Overall survival with combined nivolumab and ipilimumab in advanced melanoma. N Engl J Med 2017;377(14):1345‑56.
27. Johns AC, Yang M, Wei L, et al. Association of medical comorbidities and cardiovascular disease with toxicity and survival among patients receiving checkpoint inhibitor immunotherapy. Cancer Immunol Immunother 2023;72(7):2005‑13.
28. Danlos FX, Voisin AL, Dyevre V, et al. Safety and efficacy of anti-programmed death 1 antibodies in patients with cancer and pre-existing autoimmune or inflammatory disease. Eur J Cancer 2018;91:21‑9.
29. Martins F, Sofiya L, Sykiotis GP, et al. Adverse effects of immune-checkpoint inhibitors: Epidemiology, management and surveillance. Nat Rev Clin Oncol 2019;16(9):563‑80.
30. Haanen J, Obeid M, Spain L, et al. Management of toxicities from immunotherapy: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol 2022;33(12):1217‑38.
31. Simonaggio A, Michot JM, Voisin AL, et al. Evaluation of readministration of immune checkpoint inhibitors after immune-related adverse events in patients with cancer. JAMA Oncol 2019;5(9):1310‑7.
32. Baldini C, Martin Romano P, Voisin AL, et al. Impact of aging on immune-related adverse events generated by anti-programmed death (ligand)PD-(L)1 therapies. Eur J Cancer 2020;129:71‑9.
33. Mebarki S, Pamoukdjian F, Pierro M, et al. Safety and efficacy of immunotherapy according to the age threshold of 80 years. Bull Cancer (Paris) 2023;110(5):570‑80.
34. Gomes F, Lorigan P, Woolley S, et al. A prospective cohort study on the safety of checkpoint inhibitors in older cancer patients - the ELDERS study. ESMO Open 2021;6(1):100042.
35. Olsson Ladjevardi C, Koliadi A, Rydén V, et al. Predicting immune-related adverse events using a simplified frailty score in cancer patients treated with checkpoint inhibitors: A retrospective cohort study. Cancer Med 2023;12(12):13217‑24.
36. Johns AC, Yang M, Wei L, et al. Risk factors for immune checkpoint inhibitor immunotherapy toxicity among older adults with cancer. Oncologist 2023;28(8):e625‑32.
37. Lyon AR, López-Fernández T, Couch LS, et al. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS). Eur Heart J 2022;43(41):4229‑361.
38. Zamami Y, Niimura T, Okada N, et al. Factors associated with immune checkpoint inhibitor-related myocarditis. JAMA Oncol 2019;5(11):1635‑7.