L’incidence annuelle des tumeurs cérébrales malignes primitives est d’environ 6 pour 100 000 personnes et augmente avec l’âge.1 Les glioblastomes sont les tumeurs cérébrales primitives malignes les plus fréquentes. En France, en 2018, on recensait environ 3 500 nouveaux cas de glioblastome, avec un âge médian au diagnostic de 65 ans. Les glioblastomes ne métastasent pas mais ont une forte propension à la récidive.
Inauguration par des céphalées inhabituelles
Les symptômes inauguraux des glioblastomes ou de toute autre tumeur cérébrale maligne sont non spécifiques. Le plus fréquent est l’apparition de céphalées inhabituelles, d’évolution progressive, révélatrices d’une hypertension intracrânienne. La majorité des tumeurs sont supratentorielles, se manifestant souvent par des crises d’épilepsie (20 à 50 % des cas) et des déficits neurologiques focaux.2
En cas de crise d’épilepsie, il est recommandé d’utiliser des antiépileptiques non inducteurs enzymatiques, comme le lévétiracétam ou le lacosamide. En l’absence de crise initiale, un traitement antiépileptique prophylactique n’est pas indiqué.
Pour les symptômes neurologiques liés à un œdème périlésionnel, l’introduction d’une corticothérapie à visée symptomatique est recommandée, en l’absence de contre-indication. L’utilisation d’agents osmotiques (mannitol) est réservée aux situations d’urgence.
L’état général du patient est souvent évalué à l’aide de l’indice de Karnofsky (KPS), qui varie de 0 % (décès) à 100 % (état normal). Par exemple, un score de 70 % correspond à un patient autonome à domicile mais incapable d’exercer une activité normale
Diagnostic : de l’IRM au NGS
L’imagerie par résonance magnétique (IRM), avec ou sans injection de produit de contraste, est l’examen de référence pour diagnostiquer et surveiller les tumeurs cérébrales. Toutefois, un diagnostic définitif repose sur l’analyse anatomopathologique d’un échantillon prélevé par biopsie ou lors d’une chirurgie.
Depuis 2021, la classification de l’Organisation mondiale de la santé met l’accent sur les caractéristiques génétiques et moléculaires des tumeurs.
Les glioblastomes sont des tumeurs gliales définies par l’absence de mutation du gène IDH. Sur le plan moléculaire, ils présentent d’autres anomalies, comme des mutations du promoteur du gène TERT et/ou une amplification du gène EGFR.
Le séquençage de nouvelle génération (NGS) est une technique d’analyse génétique à haut débit permettant d’identifier de nombreuses altérations génétiques spécifiques, comme des mutations ponctuelles, des fusions ou des amplifications de gènes. Cet examen est particulièrement proposé aux jeunes patients atteints de tumeurs gliales de haut grade, afin de rechercher des anomalies pouvant orienter vers des traitements ciblés.
Traitements de première ligne
Le choix du traitement dépend de plusieurs facteurs : l’état général du patient (score KPS), ses fonctions neurocognitives, son âge et les caractéristiques de la tumeur (histologie et profil moléculaire).
Toute décision thérapeutique initiale doit être validée en réunion de concertation pluridisciplinaire de neuro-oncologie.
Les différents traitements mis en place (chirurgie, radiothérapie, chimiothérapie) ont pour but de retarder la récidive.
Chirurgie en première intention
Le traitement de première intention repose sur une chirurgie lorsque cela est possible, avec pour objectif une exérèse tumorale maximale tout en préservant les fonctions neurologiques du patient. Cette intervention permet de réduire la pression intracrânienne, d’atténuer les symptômes liés à la tumeur et de limiter l’utilisation de corticoïdes.
Une résection optimale améliore la survie, bien que l’infiltration diffuse des glioblastomes rende une exérèse complète impossible, en particulier lorsque la tumeur s’étend vers des zones fonctionnelles essentielles ou traverse la ligne médiane via le corps calleux.
Malgré ces limites, l’ampleur de la résection chirurgicale reste un facteur pronostique majeur.
Lorsqu’une exérèse n’est pas envisageable, une biopsie est réalisée, pour confirmer le diagnostic.
Protocole Stupp
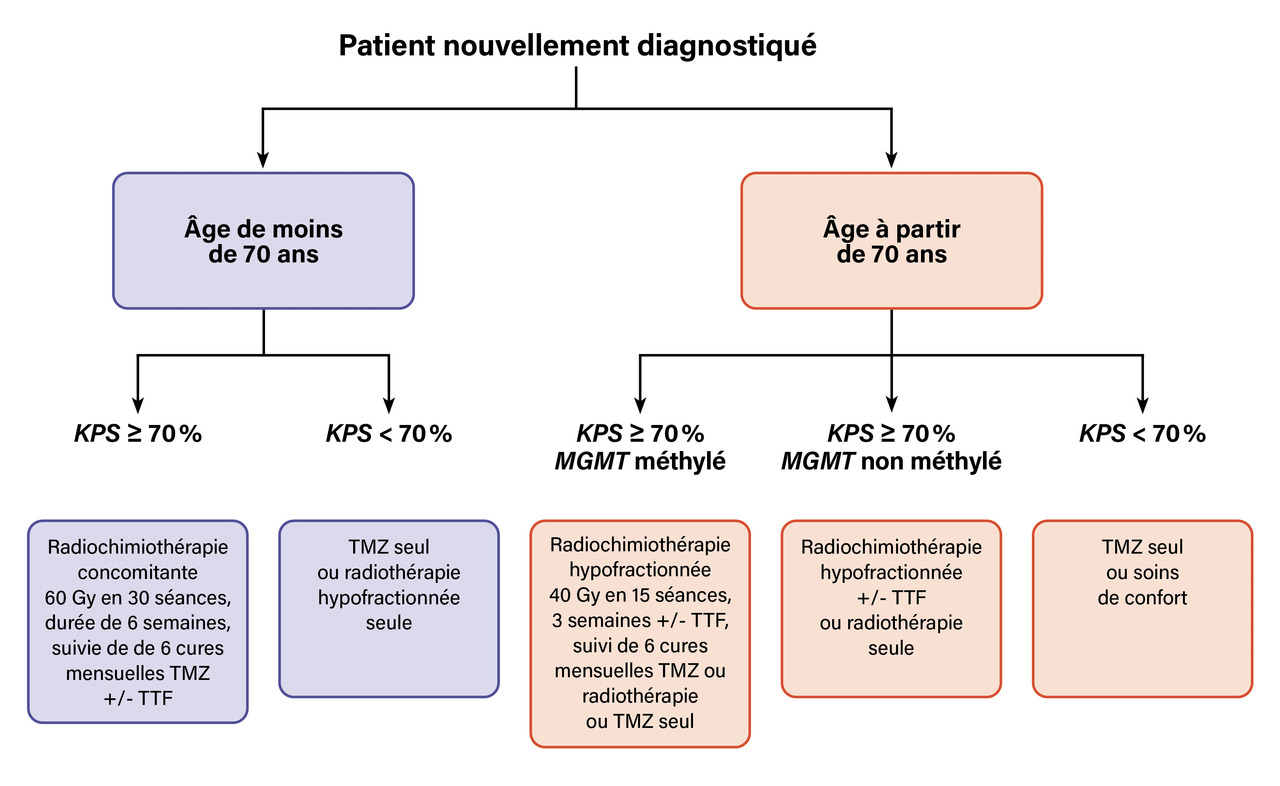
Pour les patients de moins de 70 ans en bon état général, le protocole Stupp est le traitement de référence (figure). Il associe une radiothérapie à une chimiothérapie concomitante par témozolomide, suivie d’une phase d’entretien avec ce même agent. Ce protocole a démontré une amélioration de la survie, avec un taux de survie à deux ans de 27 %, contre 10 % pour la radiothérapie seule.3,4
Pour les patients de 70 ans et plus, une radiochimiothérapie hypofractionnée est généralement privilégiée.5 Dans ce contexte, le statut du promoteur MGMT est déterminant : un promoteur méthylé est associé à une meilleure réponse au témozolomide et à une survie prolongée.
Radiothérapie
La radiothérapie débute généralement quatre à six semaines après la chirurgie afin de ne pas compromettre la cicatrisation. Un mois après la fin de la radiochimiothérapie, une IRM de référence est réalisée, puis la chimiothérapie adjuvante par témozolomide est instaurée en cure mensuelle de cinq jours consécutifs, avec un suivi par IRM tous les deux cycles, pour un total de six cycles.
Tumour-treating fields
Depuis 2023 en France, l’ajout de tumour-treating fields (TTF) en phase d’entretien avec le témozolomide est autorisé, après validation de son bénéfice en matière de survie par une étude de phase III.6
Ce traitement repose sur l’application de champs électriques de faible intensité, qui perturbent la division des cellules tumorales, délivrés par des électrodes disposées sous forme de patchs sur le cuir chevelu rasé, selon une cartographie déterminée par la localisation tumorale. L’essai a montré une amélioration de la survie globale médiane à 20,9 mois contre 16 mois sans TTF et un taux plus élevé de patients survivants à cinq ans. Pour une efficacité optimale, l’appareil doit être porté au moins dix-huit heures par jour. Ce traitement nécessite un suivi infirmier à domicile et peut entraîner des irritations du cuir chevelu voire une alopécie.6,7
Ce traitement est contre-indiqué en cas d’épilepsie non contrôlée, de grossesse ou de dispositif implanté incompatible.
Traitement des récidives
En cas de récidive après le traitement standard, il n’y a pas de prise en charge codifiée, et l’arsenal thérapeutique est pauvre en raison de la barrière hémato-encéphalique empêchant la pénétration de la plupart des molécules anticancéreuses.
À ce jour, aucun consensus ni traitement standard n’a été établi pour la récidive ou la progression du glioblastome.8 La stratégie thérapeutique en cas de récidive doit être abordée de manière multidisciplinaire lors des réunions de concertation pluridisciplinaire (RCP).
Chirurgie
En cas de récidive du glioblastome, la possibilité d’une réintervention neurochirurgicale doit être discutée en RCP. Une seconde chirurgie peut être bénéfique chez des patients soigneusement sélectionnés.9 Une étude rétrospective multicentrique menée par le RANO (Response Assessment in Neuro-Oncology) resect group, utilisant des scores de propension, a montré qu’un volume tumoral résiduel inférieur ou égal à 1 cm3 (prise de contraste à l’IRM) est significativement associé à une amélioration de la survie, comparé à un traitement de deuxième ligne sans nouvelle résection.10
Radiothérapie
Le bénéfice d’une réirradiation en conditions stéréotaxiques des glioblastomes récidivants est en cours d’évaluation dans l’essai de phase III EORTC LEGATO (en association au CCNU : chloroéthyl cyclohexyl nitroso-urée) et doit être discuté en RCP.
Chimiothérapie
En l’absence de traitements ayant démontré une efficacité clairement prouvée (survie médiane environ neuf mois en cas de progression après radiochimiothérapie), l’inclusion dans un essai clinique constitue l’option thérapeutique privilégiée en cas de rechute chez un patient en bon état général, à valider lors d’une RCP.
En l’absence d’essai clinique, une reprise de témozolomide en schéma classique peut être proposée en cas de récidive à distance de la fin du traitement par témozolomide adjuvant (neuf mois environ).
Il est licite de proposer au patient une deuxième ligne par nitroso-urée type BCNU (bis-chloroéthyl-nitroso-urée) ou CCNU en cas de récidive précoce, en association ou non avec le bévacizumab.11
Parmi les autres traitements utilisés, le carboplatine est souvent proposé en cas de progression sous nitroso-urées.
Le bévacizumab est un agent antiangiogénique (anti-VEGF) agissant notamment sur l’œdème périlésionnel mais pas sur la croissance des cellules tumorales : cette thérapeutique peut améliorer la symptomatologie neurologique en lien avec l’œdème (avec épargne en corticoïdes) et allonger la survie sans progression.12 Toutefois, il n’améliore pas la survie globale des patients atteints de glioblastome et n’a pas reçu d’autorisation de mise sur le marché dans le cadre du glioblastome en France, à la différence des États-Unis.
Perspectives
Plusieurs stratégies sont explorées afin de trouver une nouvelle thérapeutique pour les glioblastomes : les thérapies ciblées contre certaines altérations génétiques spécifiques, l’amélioration de la pénétration des molécules cytotoxiques au niveau du parenchyme cérébral, l’immunothérapie, les CAR-T cells ainsi que les vaccins antitumoraux.
Thérapies ciblées
Lorsqu’une mutation génétique rare – comme BRAF V600E ou une fusion NTRK – est identifiée, un traitement ciblé peut être envisagé. L’étude de phase II ROAR a montré qu’environ 33 % des patients atteints de gliomes de haut grade avec la mutation BRAF V600E présentaient une réponse à l’association dabrafénib-tramétinib.13
Le larotrectinib peut induire des réponses thérapeutiques prolongées chez les patients avec des gliomes présentant la fusion TRK.14
En revanche, les essais de phase III, notamment l’étude AGILE, n’ont pas démontré d’amélioration de la survie globale avec le régorafénib, un inhibiteur de multiples tyrosine kinases.15
Les avancées dans l’analyse génétique des tumeurs, notamment chez les patients jeunes, ouvrent de nouvelles perspectives en identifiant des mutations pouvant servir de nouvelles cibles thérapeutiques.
Barrière hémato-encéphalique
Contrairement à d’autres cancers, la barrière hémato-encéphalique (BHE) limite l’efficacité de nombreuses chimiothérapies en empêchant leur passage vers le tissu cérébral.
Plusieurs stratégies sont actuellement à l’étude pour contourner la BHE et améliorer l’administration des traitements au niveau des tumeurs cérébrales. Parmi elles, les ultrasons focalisés (focused ultrasound, FUS) ont récemment montré leur capacité à ouvrir la BHE de manière réversible et sans effets indésirables majeurs. Un exemple prometteur est le dispositif SonoCloud, dont l’étude de phase II Sonobird, publiée en 2024, a confirmé le concept,16 avec une étude de phase III en cours.
Immunothérapie
L’immunothérapie type inhibiteurs de checkpoints, utilisée dans certains cancers solides comme le mélanome, n’apporte pas de bénéfice en survie globale chez les patients avec un glioblastome, que cela soit en début de maladie ou en cas de récidive.17
CAR-T cells
Les CAR-T cells ont révolutionné le traitement de certaines hémopathies, mais leur utilisation dans les tumeurs solides reste limitée par plusieurs obstacles, notamment l’absence d’antigène de surface pertinent.
Une étude de phase I portant sur trois patients traités par injection intraventriculaire de CAR-T anti-EGFR a montré une bonne tolérance et une réponse partielle chez tous les patients, mais avec une récidive précoce.18
Vaccins
Les vaccins anticancéreux sont conçus pour cibler des antigènes tumoraux et induire une réponse immunitaire des lymphocytes T contre les cellules cancéreuses. Cependant, dans le cas des glioblastomes, les antigènes tumoraux spécifiques sont rares.
L’UCPVax est un vaccin peptidique dirigé contre la télomérase (TERT), une enzyme impliquée dans la prolifération incontrôlée des cellules tumorales. L’essai clinique de phase IIa (UCPVax-Glio), mené sur 31 patients atteints de glioblastome, a montré une bonne tolérance, une réponse immunitaire chez 97 % des patients et une survie médiane de dix-huit mois (ASCO, 2023).
Un autre essai, Navig (phase I-IIa), évalue un vaccin anti-TERT à base de mélanine chez des patients en bon état général, sans corticothérapie au moment de l’inclusion.
Pour les gliomes IDH-mutés, le vaccin peptidique anti-IDH est bien toléré, avec un taux de survie sans progression de 82 % à deux ans chez les patients ayant développé une réponse immunitaire.19
Enfin, pour les gliomes de la ligne médiane, le vaccin anti-H3K27M a montré une survie globale médiane de 12,8 mois.20
Pronostic sombre en raison d’un arsenal thérapeutique limité
Les glioblastomes comptent parmi les tumeurs avec le taux de mortalité le plus élevé, en raison d’un arsenal thérapeutique limité. Le choix du traitement dépend de la localisation de la tumeur, de l’état général et neurologique du patient ainsi que de ses préférences.
Même si le pronostic est sombre, une fraction significative de patients (jusqu’à 10 %) vit plus de cinq ans.
Le traitement standard repose sur une chirurgie optimale, suivie d’une radiochimiothérapie concomitante.
En cas de récidive, il n’existe pas de consensus thérapeutique, et toute décision doit bénéficier d’une discussion en RCP de neuro-oncologie réunissant neuro-oncologues, radiothérapeutes, neuroradiologues et neurochirurgiens.
Si le patient est en bon état général et présente une progression sous témozolomide, une inclusion dans un essai clinique peut être envisagée dans un centre expert en tumeurs gliales.
Enfin, une prise en charge multidisciplinaire précoce est essentielle et doit inclure des soins de support adaptés : suivi par un médecin référent, infirmière de coordination, kinésithérapie/activité physique adaptée (APA), rééducation orthophonique et accompagnement nutritionnel.21
2. Schaff LR, Mellinghoff IK. Glioblastoma and other primary brain malignancies in adults: A review. JAMA 2023;329(7):574-87.
3. Stupp R, Mason WP, van den Bent MJ, et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med 2005;352(10):987-96.
4. Stupp R, Hegi ME, Mason WP, et al. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase III study: 5-year analysis of the EORTC-NCIC trial. Lancet Oncol 2009;10(5):459-66.
5. Malmström A, Gronberg BH, Marosi C, et al. Temozolomide versus standard 6-week radiotherapy versus hypofractionated radiotherapy in patients older than 60 years with glioblastoma: The Nordic randomised, phase 3 trial. Lancet Oncol 2012:13(9):916-26.
6. Stupp R, Taillibert S, Kanner A, et al Effect of Tumor-Treating Fields plus maintenance temozolomide vs maintenance temozolomide alone on survival in patients with glioblastoma: A randomized clinical trial. JAMA 2017;318(23):2306‑16.
7. Ballo MT, Conlon P, Lavy-Shahaf G, et al. Association of Tumor Treating Fields (TTFields) therapy with survival in newly diagnosed glioblastoma: A systematic review and meta-analysis. J Neurooncol 2023;164(1):1‑9.
8. Hundsberger T, Hottonger AF, Roelcke U, et al. Patterns of care in recurrent glioblastoma in Switzerland: A multicentre national approach based on diagnostic nodes. J Neurooncol 2016;126(1):175-83.
9. Franceschi E, Bartolotti M, Tosoni A, et al. The effect of re-operation on survival in patients with recurrent glioblastoma. Anticancer Res 2015;35(3):1743-8.
10. Karschnia P, Young JS, Dono A, et al. Prognostic validation of a new classification system for extent of resection in glioblastoma: A report of the RANO resect group. Neuro-Oncology 2023;25(5): 940‑54.
11. Wick W, Gorlia T, Bendszus M, et al. Lomustine and bevacizumab in progressive glioblastoma. N Engl J Med 2017;377(20):1954‑63.
12. Minjie F, Zhou Z, Huang X, et al. Use of bevacizumab in recurrent glioblastoma: A scoping review and evidence map. BMC cancer 2023;23(1):544.
13. Wen PY, Stein A, van den Bent M, et al. Dabrafenib plus trametinib in patients with BRAFV600E-mutant low-grade and high-grade glioma (ROAR): A multicentre, open-label, single-arm, phase 2, basket trial. Lancet Oncology 2022;23(1):53‑64.
14. Doz F, van Tiburg CM, Georger B, et al. Efficacy and safety of larotrectinib in TRK fusion-positive primary central nervous system tumors. Neuro Oncol 2022;24(6):997-1007.
15. Lassman A, Alexander B, Berry D, et al. OS09.7.A GBM agile platform trial for newly diagnosed and recurrent GBM: Results of first experimental ARM, regorafenib. Neuro-Oncology 2024;26(Supp 5):v26‑v27.
16. Carpentier A, Stupp R, Sonabend AM, et al.Repeated blood–brain barrier opening with a nine-emitter implantable ultrasound device in combination with carboplatin in recurrent glioblastoma: A phase I/II clinical trial. Nat Commun 2024;15(1):1650.
17. Badani A, Ozair A, Khasraw M, et al. Immune checkpoint inhibitors for glioblastoma: Emerging science, clinical advances, and future directions. J Neurooncol 2025;171(3):531-47.
18. Choi BD, Gerstner E, Frigault MJ, et al. Intraventricular CARv3-TEAM-E T cells in recurrent glioblastoma. N Engl J Med 2024;390(14):1290-8.
19. Platten M, Bunse L, Wick W, et al. Emerging targets for anticancer vaccination: IDH. ESMO Open 2021;6(4):100214.
20. Grassl N, Poschke I, Lindner K, et al. A H3K27M-targeted vaccine in adults with diffuse midline glioma. Nat Med 2023;29(10):2586-92.
21. Recommandations pour la prise en charge du glioblastome (grade IV OMS) adulte. Association des neuro-oncologues d'expression française (ANOCEF). 2025.