Aux États-Unis comme dans l’ensemble du monde anglo-saxon, écrire le mot « race » ne pose aucun problème de conscience à la communauté scientifique.1 Une revue est même intégralement consacrée à ce thème : Journal of racial and ethnic health disparities ; son but est de « rendre compte des avancées scientifiques des travaux visant à comprendre, traiter et, à terme, éliminer les disparités de santé fondées sur la race et l’origine ethnique. (…) Les articles de recherche originaux ainsi que les revues évolutionnistes présentant l’état de la réflexion sur les problèmes liés aux disparités de santé seront pris en considération pour publication ».2
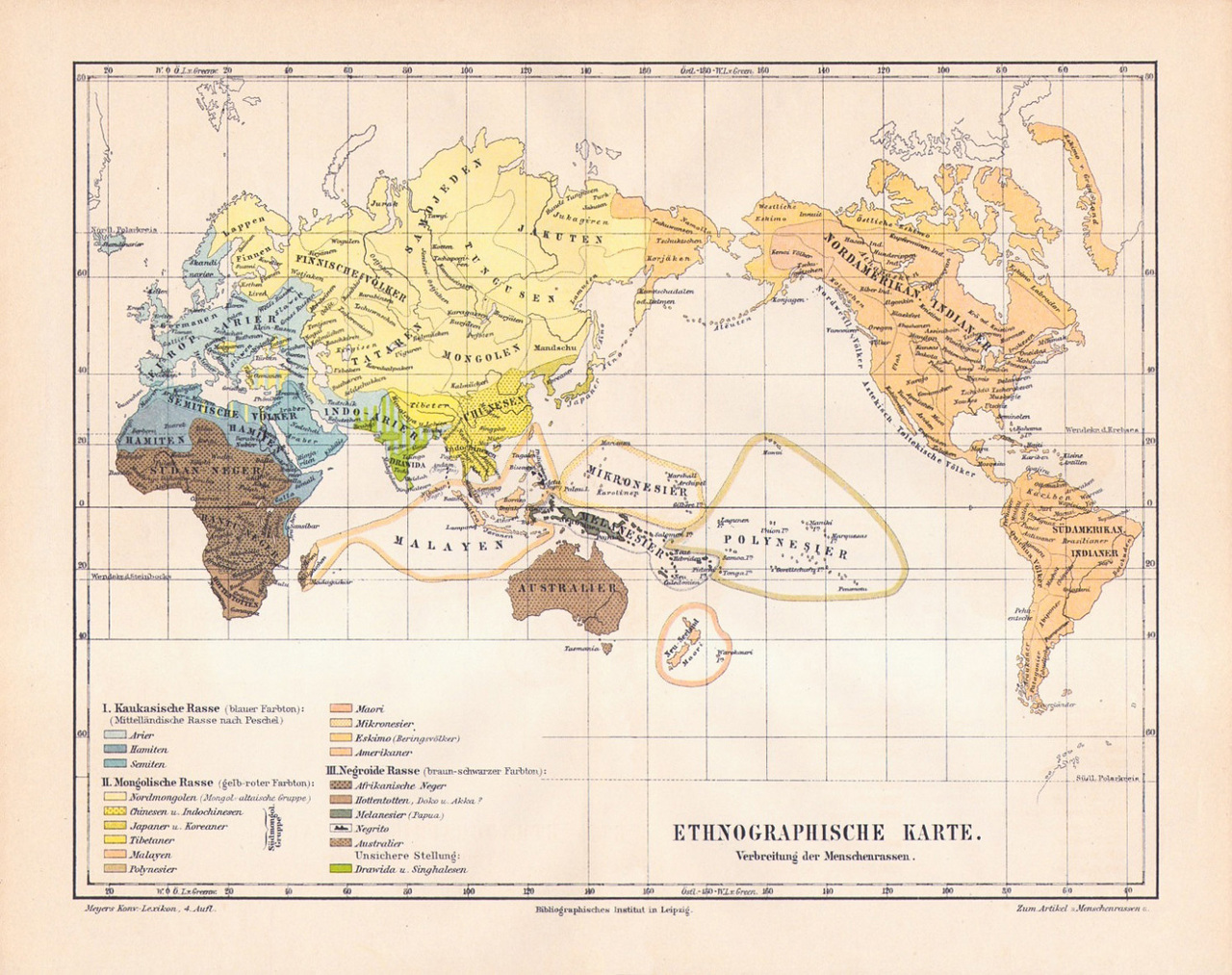
Ce mot (« race ») et ce concept (« racialisation ») sont, en revanche, en France comme dans les pays européens, systématiquement – et légitimement – bannis pour des raisons autant éthiques qu’historiques. C’est sur la notion de races (et son corollaire, leur hiérarchie) que se sont bâties les politiques de ségrégation d’individus isolés, de classes sociales et de populations à part entière (figure). On pense, en particulier, au traité pseudo-scientifique d’Arthur Gobineau (Essai sur l’inégalité des races humaines, Paris, 1853 - 1855), aux théories associant criminalité/atavisme/race chez Cesare Lombroso (L’Homme criminel, Turin, 1876, et Le Crime, causes et remèdes, Turin, 1899) et au brûlot antisémite d’Adolf Hitler (Mein Kampf, 1924 - 1925).
Efficience thérapeutique potentiellement variable selon l’origine ethnique
Pourtant, même si en France il est désormais impensable (et faux, scientifiquement) de parler de « race humaine », l’expérience clinique montre des différences d’efficience thérapeutique selon l’origine géographique et l’ascendance de certaines communautés de patients. Dans le processus d’évaluation de l’efficience (et des éventuels effets indésirables des médicaments), les laboratoires pharmaceutiques « marchent sur des œufs » vis-à-vis de la population sur laquelle sont testées les nouvelles molécules. Comme le rappelle le laboratoire Pfizer sur son site internet institutionnel (pfizer.fr), « le sexe, l’âge et l’origine raciale ou ethnique peuvent tous avoir un impact sur la façon dont différentes personnes répondent au même médicament ou vaccin (…). Plus un groupe de participants à une étude clinique est diversifié, plus nous pouvons en apprendre sur la sécurité d’emploi et l’efficacité d’un médicament ou d’un vaccin potentiel pour les personnes présentant des caractéristiques similaires à celles des participants ».3
Diversifier la population cible dans les études cliniques
Certaines communautés ont-elles été sous-représentées dans des études cliniques antérieures ? Des obstacles entravent-ils une participation plus inclusive, et donc représentative de la diversité biologique de la population cible ? Il existe, certes, des barrières linguistiques et culturelles, des défis financiers (frais de déplacement, par exemple), des séquelles encore vives de discrimination et/ou mauvais traitements. Pourtant, de plus en plus, cette diversité est une nécessité pour un meilleur jugement des effets positifs (recherchés) de nouvelles molécules et une appréciation des éventuels effets négatifs : ceux-ci sont forcément influencés par des facteurs génétiques, alimentaires, microbiotiques, etc. (incluant donc la notion de diversité géographique et ethnique).
Prenons un exemple allant dans le sens de la légitimité d’intégrer de telles données : la diversité ethnique dans les essais cliniques sur le cancer apparaît en effet essentielle pour garantir l’équité et la généralisation des avancées thérapeutiques dans les sociétés multiculturelles. À ce jour, l’absence de consensus sur la documentation de l’origine ethnique, en partie due à la complexité de la terminologie et à la crainte de discrimination, conduit dans un nombre significatif de cas à une prise en charge sous-optimale des patients issus de populations minoritaires. De plus, les critères d’éligibilité, tels que les seuils d’inclusion stricts en laboratoire, ne tiennent souvent pas compte des variations entre groupes ethniques, ce qui peut exclure des patients sans justification fondée sur des données probantes. Un récent article montre la grande disparité entre les protocoles de l’Agence européenne des médicaments (EMA) et ceux de la Food and Drug Administration (FDA) américaine entre 2020 et 2022 : sur 56 essais analysés, seuls deux tiers des publications de résultats principaux incluaient des informations sur l’origine ethnique. Les groupes « caucasiens » et « asiatiques » ont été documentés dans la plupart de ces essais et présentaient également les pourcentages de participants les plus élevés, tandis que les autres sous-groupes ethniques étaient moins fréquemment documentés et ne représentaient qu’une faible proportion des participants aux essais.4 Si les recommandations américaines encouragent l’inclusion, des recommandations similaires font défaut en Europe. De fait, les autorités réglementaires, les organismes de recherche et les défenseurs des patients européens ne devraient-ils pas établir des recommandations pour améliorer la diversité ethnique dans les essais cliniques, que ce soit sur le cancer ou dans d’autres domaines de spécialité biomédicale, en alignant les pratiques de recherche sur la composition de plus en plus multiculturelle des sociétés contemporaines ?
Faut-il faire évoluer la réglementation ?
Comment faire, donc, alors même que le droit français se révèle particulièrement frileux (on le comprend) vis-à-vis de l’enregistrement de telles informations dans les bases de données ? La loi n° 78 - 17 Informatique et Libertés du 6 janvier 1978 (modifiée le 6 août 2004), réglementant le traitement des données personnelles, indique qu’il est interdit « de traiter des données à caractère personnel qui révèlent la prétendue origine raciale ou l’origine ethnique (…) d’une personne physique ». Néanmoins, sur dérogation accordée par le comité d’éthique local, cette donnée peut malgré tout être collectée s’il existe une justification scientifique préalable, et sous réserve du consentement de la personne concernée. Sans équivoque, les esprits doivent évoluer, et la communauté biomédicale serait bien inspirée de relire le brillant ouvrage de Claude Lévi-Strauss Race et Histoire (1952) au sein duquel l’ethnologue humaniste défend l’idée d’une « diversité nécessaire » : « Aucune culture n’est seule ; elle est toujours donnée en coalition avec d’autres cultures, et c’est cela qui lui permet d’édifier des séries cumulatives ».5
2. Journal of racial and ethnic health disparities. Springer. https://link.springer.com/journal/40615 (page consultée le 3 avril 2025).
3. Pfizer. La diversité ethnique et les essais cliniques en France : où en est-on ? https://www.pfizer.fr/actualites/votre-sante/la-diversite-ethnique-et-les-essais-cliniques-en-france-ou-en-est-on (page consultée le 3 avril 2025).
4. Puhr HC, Winckler EC, Preusser M. Ethnic origin in cancer clinical trials: Overrated or understated? A comprehensive analysis of cancer clinical trials leading to FDA and EMA approvals between 2020 and 2022.ESMO Open. 2025;10(1):104093.
5. Lévi-Strauss C. Race et Histoire. Paris, Gallimard / Unesco, 1952.
Une question, un commentaire ?